Журнал «Медицина неотложных состояний» №7(102), 2019
Вернуться к номеру
Порушення вмісту фосфору в сироватці крові критично хворих дітей із гострою дихальною недостатністю: проспективне обсерваційне когортне дослідження
Авторы: Філик О.В.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Тяжка гіпофосфатемія призводить до загрожуючих життю порушень. Даних про те, як впливає гіпофосфатемія на кінцеві результати лікування дітей із гострою дихальною недостатністю, до сьогодні залишається мало. Метою даного дослідження було встановити поширеність, причини та фактори ризику гіпофосфатемії в дітей із гострою дихальною недостатністю. Матеріали та методи. Із травня 2018 р. по травень 2019 р. нами проведено проспективне когортне одноцентрове дослідження на клінічній базі кафедри анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького (відділення анестезіології з ліжками інтенсивної терапії КНП «Львівська обласна дитяча клінічна лікарня «ОХМАТДИТ») серед пацієнтів віком від 1 міс. до 3 років. Рівень фосфору сироватки крові оцінювали в 1-шу (d1), 3-тю (d3), 5-ту (d5), 7-му та 9-ту добу (d7 та d9). Клінічні дані, що публікуються в даній статті, є частиною результатів клінічного дослідження «Diaphragm ultrasound and trends in electrolyte disorders and transthyretin level as a method to predict ventilation outcome in children: the prospective observational cohort study» (ISRCTN84734652; https://doi.org/10.1186/ISRCTN84734652). Упродовж часу дослідження у відділення були прийняті 57 пацієнтів із гострою дихальною недостатністю, у 4 із них рівень фосфору не моніторували. Таким чином, до дослідження були включені 53 пацієнти. Результати. Причинами гострої дихальної недостатності в дітей були: гостра серцева недостатність — 2 пацієнти (3,8 %), сепсис — 5 хворих (9,4 %), септичний шок — 10 хворих (18,9 %), енцефалопатія — 4 пацієнти (7,5 %), пневмонія — 36 хворих (67,9 %), гострий обструктивний бронхіт/бронхіоліт/бронхіальна астма — 6 пацієнтів (11,3 %), бронхолегенева дисплазія — 2 пацієнти (3,8 %). Ми розподілили всіх пацієнтів на групи відповідно до рівня фосфору при надходженні. У пацієнтів із нормофосфатемією при надходженні на лікування (n = 6) рівень фосфору поступово знижувався і на 3-й день становив 0,9 ммоль/л, на 5-й — 0,75 ммоль/л та на 7-й та 9-й дні — 0,72 і
0,65 ммоль/л відповідно. У пацієнтів із легкою гіпофосфатемією при надходженні на лікування (n = 31; рівень фосфору — 0,68 ± 0,09 ммоль/л), на етапах дослідження d3 та d5 рівень фосфору становив 0,42 ± 0,05 та 0,40 ± 0,07 ммоль/л відповідно, а до етапу d7 досягав тяжкої гіпофосфатемії і становив 0,30 ± 0,04 ммоль/л; на етапі d9 дещо збільшувався до 0,38 ± 0,08 ммоль/л. У пацієнтів із тяжкою гіпофосфатемією при надходженні на лікування (n = 16; рівень фосфору — 0,22 ± 0,04 ммоль/л), на етапі d3 рівень фосфору незначно збільшувався до 0,28 ± 0,03 ммоль/л, на етапах дослідження d5, d7 і d9 залишався практично незміненним. Висновки. Частота виявлення гіпофосфатемії в дітей із гострою дихальною недостатністю при надходженні на лікування становила 88,7 %, а на 5-й день лікування — 100 %. Причинами гіпофосфатемії в даній когорті пацієнтів було поєднання різних механізмів: перехід фосфору в клітини внаслідок респіраторного алкалозу та метаболічного ацидозу при сепсисі, використання бета-адреноміметиків та кортикостероїдів, рефідинг-синдром, а також неможливість забезпечити корекцію гіпофосфатемії при ентеральному харчуванні.
Актуальность. Тяжелая гипофосфатемия приводит к угрожающим жизни нарушениям. Данных о том, как влияет гипофосфатемия на конечные результаты лечения детей с острой дыхательной недостаточностью, до сих пор остается мало. Целью данного исследования было установить распространенность, причины и факторы риска гипофосфатемии у детей с острой дыхательной недостаточностью. Материалы и методы. С мая 2018 г. по май 2019 г. нами проведено проспективное когортное одноцентровое исследование на клинической базе кафедры анестезиологии и интенсивной терапии Львовского национального медицинского университета имени Данила Галицкого (отделение анестезиологии с койками интенсивной терапии КНП «Львовская областная детская клиническая больница «ОХМАТДЕТ») среди пациентов в возрасте от 1 мес. до 3 лет. Уровень фосфора сыворотки крови оценивали в 1-е (d1), 3-и (d3), 5-е (d5), 7-е и 9-е сутки (d7 и d9). Клинические данные, публикуемые в данной статье, являются частью результатов клинического исследования «Diaphragm ultrasound and trends in electrolyte disorders and transthyretin level as a method to predict ventilation outcome in children: the prospective observational cohort study» (ISRCTN84734652; https://doi.org/10.1186/ISRCTN84734652). В отделение были приняты 57 пациентов с острой дыхательной недостаточностью, у 4 из них уровень фосфора не мониторировали. Таким образом, в исследование были включены 53 пациента. Результаты. Причинами острой дыхательной недостаточности у детей были: острая сердечная недостаточность — 2 пациента (3,8 %), сепсис — 5 больных (9,4 %), септический шок — 10 больных (18,9 %), энцефалопатия — 4 пациента (7,5 %), пневмония — 36 больных (67,9 %), острый обструктивный бронхит/бронхиолит/бронхиальная астма — 6 пациентов (11,3 %), бронхолегочная дисплазия — 2 пациента (3,8 %). Мы разделили всех пациентов на группы в соответствии с уровнем фосфора при поступлении. У пациентов с нормофосфатемией при поступлении на лечение (n = 6) уровень фосфора постепенно снижался и на 3-й день составлял 0,9 ммоль/л, на 5-й — 0,75 ммоль/л и на 7-й и 9-й дни — 0,72 и 0,65 ммоль/л соответственно. У пациентов с легкой гипофосфатемией при поступлении на лечение (n = 31, уровень фосфора — 0,68 ± 0,09 ммоль/л), на этапах исследования d3 и d5 уровень фосфора составлял 0,42 ± 0,05 и 0,40 ± 0,07 ммоль/л, соответственно, а к этапу d7 достигал тяжелой гипофосфатемии и составлял 0,30 ± ± 0,04 ммоль/л; на этапе d9 несколько увеличивался до 0,38 ± 0,08 ммоль/л. У пациентов с тяжелой гипофосфатемией при поступлении на лечение (n = 16, уровень фосфора — 0,22 ± 0,04 ммоль/л), на этапе d3 уровень фосфора незначительно увеличивался до 0,28 ± 0,03 ммоль/л, на этапах исследования d5, d7 и d9 оставался практически неизмененным. Выводы. Частота выявления гипофосфатемии у детей с острой дыхательной недостаточностью при поступлении составляла 88,7 %, а на 5-й день лечения — 100 %. Причинами гипофосфатемии в данной когорте пациентов было сочетание различных механизмов: переход фосфора в клетки вследствие респираторного алкалоза и метаболического ацидоза при сепсисе, использование бета-адреномиметиков и кортикостероидов, рефидинг-синдром, а также невозможность обеспечить коррекцию гипофосфатемии при энтеральном питании.
Background. Severe hypophosphatemia lead to life-threatening complications. There is a little knowledge about impact of hypophosphatemia on long-term outcomes in children on mechanical ventilation. The aim of this study was to investigate the prevalence, causes and risk factors of hypophosphatemia in children with acute respiratory failure. Materials and methods. We complete a prospective single-center cohort study (May 2018 — May 2019) at the Department of Anesthesiology and Intensive Care, Danylo Halytsky Lviv National Medical University; Department of Anesthesiology and Intensive Care, Lviv Regional Children’s Hospital “OCHMATDYT”. We have examined patients aged 1 month to 3 years old with acute respiratory failure on invasive mechanical ventilation. Serum phosphorus level was evaluated on days 1, 3, 5, 7 and 9. Results described in this article is the part of the clinical study “Diaphragm ultrasound and trends in electrolyte disorders and transthyretin level as a method to predict ventilation outcome in children: the prospective observational cohort study”; ISRCTN84734652. We enrolled 57 patients with acute respiratory failure, in 4 patients, phosphorus level data weren’t monitored. Thus, we included 53 children in study results analysis. Results. The causes of acute respiratory failure in children were: acute heart failure — 2 cases (3.8 %); sepsis — 5 (9.4 %); septic shock — 10 (18.9 %); encephalopathy — 4 (7.5 %); pneumonia — 36 (67.9 %); acute obstructive bronchitis/bronchiolitis/bronchial asthma — 6 (11.3 %); bronchopulmonary dysplasia — 2 (3.8 %). All patients were divided into groups according to phosphorus level at admission. As a result, in 6 patients with normophosphatemia at admission, phosphorus level decreased to 0.9 mmol/l on day 3, to 0.75 mmol/l on day 5 and to 0.72 mmol/l and 0.65 mmol/l on days 7 and 9, respectively. In patients with mild hypophosphatemia at admission (n = 31; phosphorus level 0.68 ± 0.09 mmol/l), levels of phosphorus on days 3 and 5 were 0.42 ± 0.05 mmol/l and 0.40 ± 0.07 mmol/l, respectively. Moreover, on day 7 it reached level of severe hypophosphatemia (0.30 ± 0.04 mmol/l), and on day 9 slightly increased to 0.38 ± 0.08 mmol/l. In patients with severe hypophosphatemia at admission (n = 16; phosphorus level 0.22 ± 0.04 mmol/l), phosphorus level on day 3 increased to 0.28 ± 0.03 mmol/l, and remained virtually unchanged on days 5, 7 and 9. Conclusions. The incidence of hypophosphatemia in children with acute respiratory failure at admission was 88.7 %, and on day 5 of treatment increased to 100 %. The causes of hypophosphatemia were combinations of different mechanisms: phosphorus transport into the cells as a result of respiratory alkalosis, metabolic acidosis and sepsis; use of beta-adrenomimetics and steroids; refeeding syndrome as well as the inability to provide correction of hypophosphatemia with enteral nutrition alone.
гіпофосфатемія; гостра дихальна недостатність; діти
гипофосфатемия; острая дыхательная недостаточность; дети
hypophosphatemia; acute respiratory failure; children
Вступ
У пацієнтів відділення інтенсивної терапії (ВІТ) часто наявні електролітні порушення. Гіпофосфатемія є одним із найчастіших порушень. Частота її виявлення коливається від 42 % у 1–й день лікування до 62 % на 7–му добу [1]. 45 % з усіх випадків гіпофосфатемії трапляються в пацієнтів ВІТ.
Тяжка гіпофосфатемія може призвести до ускладнень та часто залишається нерозпізнаною в таких хворих [3]. Проте остаточно не встановлено, чи призведе корекція рівня фосфору до статистично значимого покращення результатів лікування в критично хворих дітей. З іншого боку, відомо, що діти з гіпофосфатемією довше перебувають у ВІТ та в лікарні загалом. Контроверсійним залишається питання чи є зв’язок між гіпофосфатемією та тяжкістю захворювання [2], гіпофосфатемією і летальністю в критично хворих пацієнтів із дихальною недостатністю та чи впливає гіпофосфатемія на тривалість штучної вентиляції легень (ШВЛ) [1, 2].
На сьогодні більшість досліджень щодо гіпофосфатемії присвячена дорослим пацієнтам та питанням корекції гіпофосфатемії в дітей, які потребують парентерального харчування або діалізних технологій, проте ця проблема є недостатньо вивченою в інших груп дітей, що лікуються у ВІТ [1].
З огляду на припущення, що гіпофосфатемія є поширеним та часто недостатньо діагностованим порушенням у критично хворих дітей, метою даного дослідження було вивчити поширеність та ймовірні причини і фактори ризику виникнення гіпофосфатемії в дітей.
Матеріали та методи
З травня 2018 р. по травень 2019 р. ми провели проспективне когортне одноцентрове дослідження на клінічній базі кафедри анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького (відділення анестезіології з ліжками інтенсивної терапії КНП «Львівська обласна дитяча клінічна лікарня «ОХМАТДИТ») серед пацієнтів віком від 1 міс. до 3 років. Протокол висновку біоетичної комісії Львівського національного медичного університету імені Данила Галицького № 1 від 30.01.2018 року. Клінічні дані, що публікуються в цій статті, є частиною результатів клінічного дослідження «Diaphragm ultrasound and trends in electrolyte disorders and transthyretin level as a method to predict ventilation outcome in children: the prospective observational cohort study» (ISRCTN84734652; https://doi.org/10.1186/ISRCTN84734652).
Критеріями включення в дослідження були: вік 1 міс. — 3 роки, клінічні та лабораторні ознаки гострої дихальної недостатності (незалежно від її причини), що потребувала проведення інвазивної конвекційної ШВЛ (через інтубаційну трубку). Критеріями виключення з дослідження були: відмова законних представників пацієнта брати участь у дослідженні, повторне надходження пацієнта у ВІТ (пацієнти могли бути включені в дослідження лише один раз), термінальний стан пацієнта при надходженні, що впродовж однієї доби закінчився летально. Рівень фосфору сироватки крові оцінювали в 1–шу (d1), 3–тю (d3), 5–ту (d5), 7–му та 9–ту добу (d7 та d9). Рівень фосфору сироватки крові визначали спектрофотометрично відповідно до інструкції для реагентів.
Статистично обробку результатів дослідження проводили за допомогою MS Exсel 2017 із розрахунком середнього значення, стандартного відхилення, медіани.
Включення пацієнтів у дослідження (рис. 1) відбувалося так: упродовж часу дослідження у відділення було прийнято 57 пацієнтів із гострою дихальною недостатністю, у 4 із них рівень фосфору не моніторували. Таким чином, до дослідження були включені 53 пацієнти. З них гіпофосфатемію при надходженні на лікування виявили в 47 дітей, нормальний рівень фосфору був лише у 6 пацієнтів. Не виявлено пацієнтів із гіперфосфатемією.
Результати
Основними причинами гострої дихальної недостатності в дітей, включених у дослідження, були: гостра серцева недостатність — 2 пацієнти (3,8 % від загальної кількості пацієнтів у дослідженні), сепсис — 5 пацієнтів (9,4 % відповідно), септичний шок — 10 пацієнтів (18,9 %), енцефалопатія — 4 пацієнти (7,5 %), пневмонія — 36 пацієнтів (67,9 %), гострий обструктивний бронхіт/бронхіоліт/бронхіальна астма — 6 пацієнтів (11,3 %), бронхолегенева дисплазія — 2 пацієнти (3,8 %) (табл. 1). Середній вік пацієнтів був 9,2 ± ± 6,5 міс. До дослідження увійшли 28 хлопчиків та 25 дівчаток. Індекс маси тіла пацієнтів становив 12,8 ± 2,5 кг/м2.
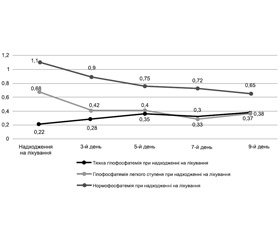
Ми проаналізували динаміку рівня фосфору в пацієнтів із гострою дихальною недостатністю та гіпофосфатемією різного ступеня вираженості, а також включили тих пацієнтів, у яких не було виявлено порушень рівня фосфору при надходженні на лікування, проте в подальшому розвивалася гіпофосфатемія (рис. 2).
У пацієнтів (n = 6), які при надходженні на лікування мали нормальний рівень фосфору (1,1 ммоль/л), спостерігалося його зниження впродовж перших 5 днів лікування у ВІТ. Ми верифікували в них розвиток гіпофосфатемії легкого ступеня (на етапі d3 медіана рівня фосфору становила 0,9 ммоль/л, на етапі d5 — 0,75 ммоль/л, на етапах d7 та d9 — 0,72 та 0,65 ммоль/л відповідно).
Серед дітей, які при надходженні на лікування мали гіпофосфатемію легкого ступеня вираженості (n = 31; рівень фосфору — 0,68 ± 0,09 ммоль/л), рівень фосфору на етапах d3 та d5 знижувався до 0,42 ± 0,05 та 0,40 ± 0,07 ммоль/л відповідно, на етапі дослідження d7 знижувався до ступеня тяжкої гіпофосфатемії і становив 0,30 ± 0,04 ммоль/л, на етапі дослідження d9 дещо зростав і становив 0,38 ± 0,08 ммоль/л.
У пацієнтів із тяжкою гіпофосфатемією при надходженні на лікування (n = 16, рівень фосфору — 0,22 ± 0,04 ммоль/л) на етапі дослідження d3 рівень фосфору зростав до 0,28 ± 0,03 ммоль/л, на етапах дослідження d5, d7 та d9 практично не змінювався і становив 0,35 ± 0,04, 0,33 ± 0,04 та 0,38 ± 0,08 ммоль/л відповідно.
Обговорення
Гіпофосфатемія є одним із найчастіших порушень, що розвиваються в критично хворих пацієнтів. Вона потенційно може призвести до ускладнень та часто залишається нерозпізнаною в таких хворих. Відомо, що 85 % фосфору міститься в кістках як гідроксіапатит; 15 % фосфору міститься в м’яких тканинах та лише 0,1 % — у позаклітинній рідині, і це та фракція, яку ми можемо виміряти. Дві третини фосфору крові є органічними та одна третина — неорганічною. Концентрація фосфору в крові зазвичай вимірюється як концентрація фосфатів, рівень яких може змінюватися залежно від росту, споживання та екскреції через нирки. Фосфор, крім його наявності в кістках, є основним внутрішньоклітинним аніоном, в основному у формі фосфатів, що відіграє важливу роль у метаболізмі. У клітинах більшість фосфору наявна у формі аденозинтрифосфату, нуклеїнових кислот та в клітинних мембранах. Дефіцит фосфору призводить до неадекватного постачання багатих на енергію фосфатів та, частково, пригнічення гліцеральдегід–3–фосфатдегідрогенази, що відіграє ключову роль у гліколізі. Окрім того, дефіцит фосфору знижує рівні аденозинтрифосфату та 2,3–дифосфогліцерату і призводить до зміщення кривої дисоціації «кисень — гемоглобін» вліво зі зниженням вивільнення кисню та порушенням його транспорту.
У новонароджених дітей вміст фосфору в організмі становить приблизно 16 г та зростає до 600–900 г у дорослих. 80 % фосфору міститься в кістках, 9 % — у скелетних м’язах. Поріг реабсорбції фосфору в нирках є вищим у дітей до 1 року порівняно з дорослими. Затримання фосфору в організмі пов’язане з мінералізацією кісток, нарощенням безжирової маси тіла та накопиченням білків. Важливо пам’ятати, що при проведенні парентерального харчування немовлятам ідеальним буде співвідношення між кальцієм та фосфором близько 1 (від 0,8 до 1,2), але це співвідношення є іншим при ентеральному харчуванні [7, 8]. У немовлят, дітей та підлітків належний рівень надходження кальцію, фосфору та магнію необхідний для забезпечення оптимального росту та мінералізації кісток (сильна рекомендація в ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition, 2018) [9].
Нормальним рівнем фосфору сироватки крові в дорослих осіб вважають 0,81–1,45 ммоль/л (2,5–4,5 мг/дл). Гіпофосфатемію залежно від ступеня тяжкості поділяють на легку — 0,65–0,81 ммоль/л (2–2,5 мг/дл), середньої тяжкості — 0,32–0,65 ммоль/л (1–2 мг/дл) та тяжку — менше 0,32 ммоль/л (менше 1 мг/дл). Легка та середньої тяжкості гіпофосфатемія зазвичай є безсимптомною, тоді як при тяжкій гіпофосфатемії рівень летальності пацієнтів зростає в 4 рази. Приблизно 5 % з усіх госпіталізованих пацієнтів мають гіпофосфатемію, тоді як серед популяції пацієнтів ВІТ цей показник зростає до 40 %.
Крім того, потрібно звертати увагу на межі нормальних значень кожної лабораторії для новонароджених дітей, особливо для недоношених. Нижня межа референтних значень є вищою в недоношених дітей (1,6 ммоль/л; 5 мг/дл) порівняно з дорослими (1 ммоль/л; 3 мг/дл). Якщо ж лабораторія використовує референтні значення для дорослих, то це може призвести до недооцінювання гіпофосфатемії в немовлят [9].
Гіпофосфатемію верифікують у 34 % пацієнтів після планових кардіохірургічних операцій. Критично висока частота гіпофосфатемії відмічається після великих операцій на печінці. Так, практично у всіх пацієнтів упродовж першого тижня після операції розвивається гіпофосфатемія. З іншого боку, у ретроспективному дослідженні, куди увійшли 2390 пацієнтів, установлено, що гіперфосфатемія є предиктором рівня летальності, а гіпофосфатемія не була асоційована з летальністю [4].
Гіпофосфатемія може бути діагностичним маркером рефідинг–синдрому, що на додаток включає поєднання низького рівня магнію та калію. За відсутності корекції гіпофосфатемії перебіг захворювання ускладнюється гастроінтестинальними, легеневими та серцево–судинними порушеннями. Інші його симптоми включають: порушення балансу рідини та натрію, дефіцит тіаміну та зміни рівня загального білка, метаболізму глюкози та жирів, інсулінорезистентність. Рефідинг–синдром можна верифікувати як на основі лише змін рівня електролітів, так і при врахуванні його клінічних проявів. Найбільш часто вживане визначення базується на гіпофосфатемії, лабораторних маркерах рівня фосфору від 0,32 до 1 ммоль/л або зниженні від початкового показника на 30 % або на більше як 0,16 ммоль/л [5].
Зазначають, що в критично хворих пацієнтів частота виявлення рефідинг–синдрому значно відрізняється залежно від того, які діагностичні критерії для його виявлення використовують, проте в гетерогенній групі усіх госпіталізованіх пацієнтів (у ВІТ та в іншіх відділеннях лікарні) його частота коливається від 0 до 80 %, якщо використовувати більш широкі критерії діагностики та верифікувати його впродовж перших 72 год після початку нутритивної підтримки. Найбільш типовими критеріями для встановлення діагнозу рефідинг–синдрому є порушення рівня електролітів плазми крові та периферичні набряки, що розвиваються гостро, чи рідинне перевантаження в поєднанні з дисфункцією систем органів. Відповідно до цього визначення рефідинг–синдром зустрічається у 2 % госпіталізованих пацієнтів [6]. У критично хворих пацієнтів найчастіше для діагностики рефідинг–синдрому використовують такі критерії, як порушення рівня електролітів (в основному фосфору) упродовж 72 год після початку харчування, що не пов’язано з іншими причинами. Частота виявлення рефідинг–гіпофосфатемії в пацієнтів у критичному стані становить 34–52 % [6].
Якщо зосередити увагу на клінічних симптомах гіпофосфатемії, то вони включають порушення дихання (слабкість дихальних м’язів, що призводить до невдалого відлучення пацієнтів від ШВЛ), гемодинаміки (оборотна міокардіальна дисфункція), неврологічні (центральна та периферична нейропатії) та гематологічні симптоми (анемія, порушення функції лейкоцитів та тромбоцитів). Тяжкий дефіцит фосфору може індукувати критичні клінічні порушення, включаючи м’язову слабкість, відтермінування відлучення від ШВЛ, порушення толерантності до глюкози, нозокоміальні інфекції та смерть. Де–які публікації демонструють, що тяжка гіпофосфатемія є чітким предиктором зростання рівня летальності при сепсисі. Проте в нещодавньому великому ретроспективному дослідженні, проведеному Suzuki та колегами [10], гіпофосфатемія не була визнана незалежним фактором ризику летальності для відділень інтенсивної терапії та загалом для лікарень.
Відомо, що основними механізмами виникнення гіпофосфатемії в пацієнтів ВІТ є: неадекватне споживання фосфору внаслідок мальнутриції/мальабсорбції, перерозподіл фосфору всередину клітини та втрата фосфору з організму (втрати із сечею при застосуванні петльових діуретиків, отруєння медикаментами). Крім того, особливі потреби в донації фосфору мають ті пацієнти, що потребують проведення парентерального харчування. Належний рівень надходження кальцію, фосфору та магнію з парентеральним харчуванням наведено в табл. 2 [9].
Brotfain та колегами встановлено, що пацієнти з гіпофосфатемією мають вищий рівень захворюваності. У загальній популяції госпіталізованих пацієнтів частота гіпофосфатемії середньої тяжкості становить 0,43–3,1 %, а 45 % з усіх випадків гіпофосфатемії трапляються в пацієнтів ВІТ. Потенційними факторами ризику гіпофосфатемії є мальнутриція, що зустрічається у 24 % пацієнтів із гіпофосфатемією, сепсис — у 34 %, застосування катехоламінів — 24 % випадків, діуретиків — у 36 % випадків, стероїдів — у 76 % випадків. Симптоми гіпофосфатемії здебільшого є неспецифічними та включають виснаження та роздратованість. Украй низький рівень фосфору (менше 1 мг/дл) може призводити до більш серйозних проблем, таких як зниження скоротливої здатності діафрагми, аритмії, зниження функції міокарда та тяжка застійна серцева недостатність [2].
Причини виникнення гіпофосфатемії можна розподілити на кілька груп. Першою з них є гіпофосфатемія внаслідок внутрішньоклітинного входження фосфору.
Зростання внутрішньоклітинного рівня pH стимулює гліколіз, що, зі свого боку, збільшує продукцію фосфорвмісних проміжних продуктів, скеровуючи фосфор внутрішньоклітинно та зменшуючи його концентрацію позаклітинно. Один із найбільш загальних шляхів для зростання внутрішньоклітинного pH — через гіпервентиляцію, що спричиняє респіраторний алкалоз. Респіраторний алкалоз спричиняє переміщення фосфатів внутрішньоклітинно за рахунок активації фосфофруктокінази, що стимулює внутрішньоклітинний гліколіз. Гліколіз призводить до споживання фосфатів та продукції фосфорильованих прекурсорів глюкози. Будь–яка причина гіпервентиляції (наприклад, сепсис, тривога, біль, діабетичний кетоацидоз, печінкова енцефалопатія, отруєння саліцилатами, злоякісний нейролептичний синдром) може призводити до гіпофосфатемії. Метаболічний ацидоз та дефіцит інсуліну мобілізують запаси внутрішньоклітинного фосфору, спричиняючи їх вихід у позаклітинне середовище та приводять до його втрат із сечею. Катехоламіни та агоністи бета–адренорецепторів також стимулюють входження фосфору всередину клітин. У більшості випадків внутрішньоклітинного входження фосфору як причини гіпофосфатемії його рівень нормалізується тоді, коли усунуто основну причину.
Гіпофосфатемія є однією з ранніх ознак, що спостерігаються при сепсисі та септичному шоку. Більше того, вона є незалежним фактором ризику розвитку аритмій та високого рівня летальності в пацієнтів із сепсисом. Агресивне лікування гіпофосфатемії може значно знизити частоту виникнення аритмій та покращити прогноз для пацієнта [2]. Продемонстровано, що рівень летальності в пацієнтів із септичним шоком та ранньою гіпофосфатемією і тромбоцитопенією є вищим. Окрім того, грамнегативна інфекція асоціюється з розвит– ком гіпофосфатемії. В гострому періоді сепсису основною причиною є перерозподіл фосфору всередину клітин, а призводить до цього високий рівень катехоламінів (адреналіну та норадреналіну), як ендогенних, так й екзогенних. Призначення глюкози та інсуліну стимулює метаболізм вуглеводів, респіраторний алкалоз індукує внутрішньоклітинне зростання pH, що змушує фосфор входити всередину клітин. На додаток ниркова екскреція фосфатів зростає внаслідок метаболічного ацидозу та застосування багатьох медикаментів.
Гіпофосфатемія та тромбоцитопенія є загальними клінічними ознаками ранньої стадії сепсису. Обидві ці ознаки, особливо коли вони тяжкі та супроводжують одна одну, найімовірніше, відображають тяжкість захворювання при сепсисі, ніж мають предикторну цінність щодо результатів лікування пацієнтів [2]. Тому в майбутньому потрібні проспективні мультицентрові дослідження, щоб краще проаналізувати потенційну клінічну роль гіпофосфатемії та тромбоцитопенії.
У нашому дослідженні 60 % пацієнтів із сепсисом (n = 3) та септичним шоком (n = 10) увійшли в групу тяжкої гіпофосфатемії при надходженні на лікування. Очевидно, що однією з важливих причин цих порушень був перерозподіл фосфору з позаклітинного середовища у внутрішньоклітинне. Крім того, варто відзначити, що всі ці пацієнти мали нутритивний дефіцит понад 15 % щодо належної за віком маси тіла, їм було неможливо відновити ентеральне харчування в повному об’ємі впродовж перших п’яти діб (внаслідок синдрому поліорганної дисфункції з гастроінтестинальним її компонентом при септичному шоку, високих доз інотропів і/або вазопресорів) та понад 2/3 із них потребували призначення петльових діуретиків для досягнення нульового гідробалансу. Очевидно, що скоригувати дефіцит фосфору без екзогенної його донації неможливо. На сьогодні на фармацевтичному ринку України тимчасово відсутні препарати для корекції дефіциту фосфору.
Другою значущою причиною гіпофосфатемії є збільшення екскреції фосфору із сечею.
Паратиреоїдний гормон стимулює нирки екскретувати фосфор, тому гіпофосфатемія є ознакою первинного та вторинного гіпопаратиреоїдизму. Втрати фосфору зростають внаслідок зниження активності натрій–фосфорних транспортерів. Ниркові втрати фосфору також трапляються при різкому збільшенні внутрішньосудинного об’єму внаслідок дилюції сироваткового кальцію, низький рівень котрого призводить до зростання вивільнення паратиреоїдного гормона. Діуретики (петльові, тіазидні, інгібітори карбоангідрази) впливають на здатність проксимальних канальців до реабсорбції фосфору, таким чином спричиняючи гіперфосфатурію та потенційно призводячи до гіпофосфатемії.
При аналізі поширеності використання петльових діуретиків у наших пацієнтів із гострою дихальною недостатністю нами встановлено, що всі хворі із септичним шоком отримували фуросемід щонайменше впродовж 3 діб, всі пацієнти з гострою серцевою недостатністю та бронхолегеневою дисплазією щонайменше впродовж 2 діб отримували петльові діуретики, 60 % пацієнтів із сепсисом епізодично 1–2–кратно отримували петльові діуретики впродовж лікування у ВІТ. З них у всіх пацієнтів із гострою серцевою недостатністю (n = 2) та бронхолегеневою дисплазією (n = 2) спостерігалася тяжка гіпофосфатемія при надходженні на лікування.
Третьою причиною є зниження інтестинальної абсорбції фосфору.
Фосфати можуть втрачатися через шлунково–кишковий тракт при хронічній діареї, синдромі мальабсорбції, тяжкому блюванні, втратах із назогастрального зонда. Також фосфати можуть бути зв’язані в просвіті шлунково–кишкового тракту при застосуванні фосфат–зв’язуючих антацидів.
Прояви мальабсорбції серед наших пацієнтів виявлялися при септичному шоку, нутритивному дефіциті, тяжкій пневмонії. У пацієнтів із пневмонією, у яких неможливо було забезпечити понад 75–80 % належного харчування, впродовж кількох діб лікування рівень фосфору критично знижувався та залишався на вкрай низьких цифрах, доки не регресувала дихальна недостатність.
І на завершення, гіпофосфатемія може розвиватися внаслідок зниження споживання фосфору з їжею. Це рідкісна причина, оскільки фосфор входить до всіх продуктів харчування. Джерелами фосфору є фрукти та овочі, м’ясо та молочні продукти. Вітамін D посилює абсорбцію фосфору та кальцію. Багато з наших пацієнтів під час перебування у ВІТ мають недостачу вітаміну D (відсутність інсоляції впродовж більш або менш тривалого проміжку часу), деякі з них мали його нестачу і до надходження у ВІТ, якщо їм не проводилася специфічна профілактика гіповітамінозу D. Недостатній рівень споживання фосфору в більшості пацієнтів на ШВЛ спостерігається через те, що більшість із них споживає менше їжі, а рівень фосфору в тій їжі, що вони споживають, може бути недостатнім. Крім того, лікування переважно зосереджене на поповненні енергетичних потреб разом із вітамінами, калієм, натрієм, хлором, а також кальцієм і магнієм, тоді як поповнення дефіциту фосфору може ігноруватися.
Окрім етіології розвитку гіпофосфатемії, варто звернути увагу і на її наслідки. Деякі фактори можуть утруднювати відлучення пацієнта від ШВЛ, зокрема і дисбаланс фосфору та порушення, що виникають внаслідок цього. Проте клінічний досвід щодо цієї проблеми є обмеженим у дорослих пацієнтів та невивченим у дітей. Було проведене дослідження [3] у пацієнтів із загостренням хронічного обструктивного захворювання легень (ХОЗЛ) щодо того, чи може гіпофосфатемія бути предиктором успішного відлучення від ШВЛ. Обстежені 67 пацієнтів, які були розподілені в групи з нормальним та зниженим рівнем фосфору (межею норми вважали 0,87 ммоль/л). Установлено, що гіпофосфатемія вірогідно впливає на успішність відлучення від ШВЛ у пацієнтів із ХОЗЛ, а рівень фосфору сироватки крові може бути індикатором успішності відлучення від ШВЛ. Хоча, з іншого боку, це можна пояснити усуненням таких причин, як респіраторний алкалоз, зменшення потреби в бета–адреноміметиках та кортикостероїдах, що само собою усуне першопричини підтримування низького рівня фосфору в крові у пацієнтів. В цьому ж дослідженні встановлено, що в цій групі пацієнтів із невдалим відлученням від ШВЛ були наявні ознаки слабкості дихальних м’язів, що відображалося в зниженні об’єму спонтанного вдиху, зниженні статичного комплайєнсу легень, що і призводило до невдалого відлучення від ШВЛ. Патогенетичними механізмами, що можуть спричиняти розвиток гіпофосфатемії в пацієнтів із ХОЗЛ, є інфекція, спричинена Pseudomonas aeruginosa, або гематологічна пухлина, низький рівень фосфору до загострення хвороби, гіпопротеїнемія та гіперлактатемія.
Отже, основними причинами гіпофосфатемії в дітей є комбінація багатьох факторів, що призводять до її виникнення та персистенції, а також неможливість відновлення ентерального харчування та відсутність препаратів для її корекції.
Висновки
У дітей із гострою дихальною недостатність частота виявлення гіпофосфатемії при надходженні на лікування становила 88,7 % (47 пацієнтів), та вже на 5–ту добу лікування — 100 % (53 пацієнти). Етіологічними чинниками гіпофосфатемії в даної групи пацієнтів є поєднання різних механізмів її виникнення: підвищення входження фосфору всередину клітин внаслідок респіраторного алкалозу, метаболічного ацидозу та сепсису, застосування бета–адреноміметиків та глюкокортикостероїдів, підвищення екскреції через нирки при застосуванні петльових діуретиків, гастроінтестинальна недостатність та синдром мальабсорбції, ймовірно, рефідинг–синдром, а також неможливість за допомогою лише ентерального харчування забезпечити корекцію вже наявної гіпофосфатемії.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Ahmed Nabih El Shazly, Doaa Refaey Soliman, Effat Hussien Assar, Eman Gamal Behiry, Ibrahim Abd El Naby Gad Ahmed. Phosphate disturbance in critically ill children: Incidence, associated risk factors and clinical outcomes. Annals of Medicine and Surgery. 2017. 21. 118e123. http://dx.doi.org/10.1016/j.amsu.2017.07.079.
2. Brotfain E., Schwartz A., Boniel A., Koyfman L., Boyko M., Kutz R. et al. Clinical outcome of critically ill patients with thrombocytopenia and hypophosphatemia in the early stage of sepsis. Anaesthesiology Intensive Therapy. 2016. 48(5). 294–299. ISSN 0209–1712 10.5603/AIT.a2016.0053.
3. Yuliang Zhao, Zhihai Li, Yinjun Shi, Gungke Cao, Fanying Meng, Wang Zhu, et al. Effect of hypophosphatemia on the withdrawal of mechanical ventilation in patients with acute exacerbations of chronic obstructive pulmonary disease. Biomedical Reports. 2016. 4. 413–416. DOI: 10.3892/br.2016.605.
4. Haider D.G., Lindner G., Wolzt M., Ahmad S.S., Sauter T., Leichtle A.B. et al. Hyperphosphatemia Is an Independent Risk Factor for Mortality in Critically Ill Patients: Results from a Cross–Sectional Study. PLoS ONE. 2015. 10(8). e0133426. doi:10.1371/journal.pone.0133426.
5. Rianne B., Koekkoek Kristine W.A.C., Arthur van Zan–ten R.H. Refeeding syndrome: relevance for the critically ill patient. Current Opinion in Critical Care. 2018. 24(4). 235–240. doi: 10.1097/MCC.0000000000000514.
6. Arthur van Zanten R.H. Changing paradigms in metabolic support and nutrition therapy during critical illness. Current Opinion in Critical Care. 2018. 24(4). 223–227. doi: 10.1097/MCC.0000000000000519.
7. Senterre T., Abu Zahirah I., Pieltain C., de Halleux V., Rigo J. Electrolyte and mineral homeostasis after optimizing early macronutrient intakes in VLBW infants on parenteral nutrition. J. Pediatr. Gastroenterol. Nutr. 2015. 61. 491e8.
8. Rigo J., Mohamed M.W., De Curtis M. Disorders of calcium, phosphorus and magnesium. In: Martin R.J., Fanaroff A.A., Walsh M.C., editors. Fanaroff and Martin neonatal–perinatal medicine. 9th ed. St. Louis: Elsevier Mosby, 2011. 1523e55.
9. Mihatsch W. et al. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Calcium, phosphorus and magnesium. Clinical Nutrition. 2018. https://doi.org/10.1016/j.clnu.2018.06.950.
10. Suzuki S. at al. Hypophosphatemia in critically ill patients. J. Crit. Care. 2013. 28(4). 536. 9–19. doi: 10.1016/j.jcrc.2012.10.011. Epub 2012, Dec 21.

/79-1.jpg)
/80-1.jpg)
/81-1.jpg)
/82-1.jpg)