Журнал "Гастроэнтерология" Том 53, №4, 2019
Вернуться к номеру
Изменения пуринового метаболизма при раке желудка
Авторы: Синяченко О.В., Алиев Р.Ф., Ермолаева М.В., Бондарь В.Г.
Донецкий национальный медицинский университет, г. Лиман, Украина
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Актуальність. Рак шлунка (РШ) вважається актуальною проблемою онкології, що пояснюється його високою поширеністю і смертністю внаслідок нього, запізнілою діагностикою захворювання, анатомо-топографічними особливостями органа, що вражається пухлиною, та низькою результативністю існуючих методів лікування. Роль дисметаболізму пуринів у процесах канцерогенезу залишається недостатньо вивченою, а його клінічна значущість вимагає уточнення. Збільшення вмісту сечової кислоти у крові є чинником ризику розвитку й подальшого тяжкого перебігу РШ. Вважається, що пуринові основи належать до пухлинних біомаркерів, але їх діагностична і прогностична роль при РШ залишається невивченою. Мета: оцінити стан пуринового метаболізму у хворих на РШ, встановити клініко-патогенетичну значущість виявлених змін. Матеріали та методи. Під наглядом перебували 88 хворих на РШ (усі чоловіки) віком від 29 до 79 років (в середньому 60 років). Локалізація пухлинного процесу у вихідному відділі шлунка мала місце в 76 % випадків, у тілі — в 16 %, в антральному відділі — в 3 %, а тотальне ураження відзначалося у 2 % від числа обстежених пацієнтів. Аденокарциному діагностовано в 72 % спостережень, аденогенний недиференційований РШ — у 18 %, плоскоклітинний — у 8 %, перстнеподібноклітинний — у 2 %. Співвідношення IА, IB, IIA, IIB, IIIA, IIIB і IV стадій РШ становило 1 : 3 : 9 : 12 : 6 : 5 : 6. Проростання пухлини в селезінку встановлено в 15 % випадків, в підшлункову залозу — в 7 %, в печінку — в 6 %, в стравохід — в 3 %, в діафрагму — у 2 %, в жовчний міхур — в 1 %. Метастази в лімфатичні вузли виявлено в 60 % спостережень РШ, у віддалені органи — в 14 %. У сироватці крові вивчали рівні продуктів пуринового метаболізму — сечової кислоти, оксипуринолу, аденіну, гуаніну, ксантину, гіпоксантину, активностей ксантиноксидази, ксантиндезамінази, аденозиндезамінази та 5-нуклеотидази. Результати. Зміни пуринового метаболізму встановлено в усіх хворих на РШ, у тому числі порівняно з контрольною групою здорових осіб рівень сечової кислоти був вищий у 2,0 раза, оксипуринолу — в 4,5 раза, аденіну — на 16 %, активності ксантиноксидази — у 2,1 раза, ксантиндезамінази — на 33 % й аденозиндезамінази — в 7,1 раза, підвищені показники яких констатовано відповідно в 99, 84, 39, 90, 53 та 100 % випадків, залежать від ступеня тяжкості перебігу пухлинного процесу, тотального ураження шлунка, проростання пухлини в печінку, підшлункову залозу і стравохід, наявності метастазів в парааортальні лімфатичні вузли, печінку, легеню, скелет і головний мозок, а порушення пуринового обміну погіршує трирічну виживаність пацієнтів на тлі виконаного хірургічного, медикаментозного й променевого лікування. Висновки. Зміни пуринового метаболізму беруть участь в патогенетичних побудовах РШ, відбивають особливості перебігу пухлинного процесу, причому параметри сечової кислоти й аденіну мають прогностичну значущість.
Актуальность. Рак желудка (РЖ) считается актуальной проблемой онкологии, что объясняется его высокой распространенностью и смертностью вследствие него, запоздалой диагностикой заболевания, анатомо-топографическими особенностями поражаемого опухолью органа и низкой результативностью существующих методов лечения. Роль дисметаболизма пуринов в процессах канцерогенеза остается недостаточно изученной, а его клиническая значимость требует уточнения. Увеличение содержания мочевой кислоты в крови является фактором риска развития и дальнейшего тяжелого течения РЖ. Считается, что пуриновые основания относятся к опухолевым биомаркерам, но их диагностическая и прогностическая значимость при РЖ остается неизученной. Цель: оценить состояние пуринового метаболизма у больных РЖ, установить клинико-патогенетическую значимость выявленных изменений. Материалы и методы. Под наблюдением находились 88 больных РЖ (все мужчины) в возрасте от 29 до 79 лет (в среднем 60 лет). Локализация опухолевого процесса в выходном отделе желудка имела место в 76 % случаев, в теле — в 16 %, в антральном отделе — в 3 %, а тотальное поражение отмечено у 2 % от числа обследованных пациентов. Аденокарцинома диагностирована в 72 % наблюдений, аденогенный недифференцированный РЖ — в 18 %, плоскоклеточный — в 8 %, перстневидноклеточный — в 2 %. Соотношение IА, IB, IIA, IIB, IIIA, IIIB и IV стадий РЖ составило 1 : 3 : 9 : 12 : 6 : 5 : 6. Прорастание опухоли в селезенку установлено в 15 % случаев, в поджелудочную железу — в 7 %, в печень — в 6 %, в пищевод — в 3 %, в диафрагму — в 2 %, в желчный пузырь — в 1 %. Метастазы в лимфатические узлы обнаружены в 60 % наблюдений РЖ, в отдаленные органы — в 14 %. В сыворотке крови изучали уровни продуктов пуринового метаболизма — мочевой кислоты, оксипуринола, аденина, гуанина, ксантина, гипоксантина, активностей ксантиноксидазы, ксантиндезаминазы, аденозиндезаминазы и 5-нуклеотидазы. Результаты. Изменения пуринового метаболизма установлены у всех больных РЖ, в том числе по сравнению с контрольной группой здоровых лиц уровень мочевой кислоты был выше в 2,0 раза, оксипуринола — в 4,5 раза, аденина – на 16 %, активности ксантиноксидазы — в 2,1 раза, ксантиндезаминазы — на 33 % и аденозиндезаминазы — в 7,1 раза, повышенные показатели которых констатированы соответственно в 99, 84, 39, 90, 53 и 100 % случаев, зависят от степени тяжести течения опухолевого процесса, тотального поражения желудка, прорастания опухоли в печень, поджелудочную железу и пищевод, наличия метастазов в парааортальные лимфатические узлы, печень, легкое, скелет и головной мозг, а нарушения обмена пуринов ухудшают трехлетнюю выживаемость пациентов на фоне выполненного хирургического, медикаментозного и лучевого лечения. Выводы. Изменения пуринового метаболизма участвуют в патогенетических построениях РЖ, отражают особенности течения опухолевого процесса, причем параметры мочевой кислоты и аденина имеют прогностическую значимость.
Background. Gastric cancer (GC) is considered an urgent problem of oncology, due to its high incidence and mortality, diagnosis at a later stage of the disease progression, anatomical and topographical features of the organ affected by the tumor and the low effectiveness of the existing methods of treatment. The role of purine dysmetabolism in carcinogenesis remains insufficiently studied, and its clinical significance requires clarification. An increased level of uric acid in the blood is a risk factor for the development and further severe course of gastric cancer. Purine bases are considered to belong to the tumor biomarkers; however, their diagnostic and prognostic significance in GC remains uninvestigated. The purpose was to assess the state of purine metabolism in patients with gastric cancer, to establish the clinical and pathogenetic significance of the identified changes. Materials and methods. A total of 88 patients with cancer (all men) aged from 29 to 79 years (mean age 60 years) were analyzed. Localization of the tumor process occurred in the stomach pylorus in 76 % cases, in the body — in 16 %, in the antrum — in 3 %, and in 2 % of all cases examined the entire stomach was affected. Adenocarcinoma was diagnosed in 72 % of cases, undifferentiated adenogenic stomach cancer — in 18 %, squamous cancer — in 8 %, colloid GC — in 2 %. The ratio of IA, IB, IIA, IIB, IIIA, IIIB and IV stages of the GC was 1 : 3 : 9 : 12 : 6 : 5 : 6. The tumor spread to the spleen was found in 15 % of cases, the pancreas — in 7 %, the liver — 6 %, the esophagus — 3 %, the diaphragm — 2 %, the gallbladder — 1 %. Lymph node metastases were found in 60 % of the GC observations, distant metastases — in 14 %. The blood serum levels of products of purine metabolism — uric acid, hydroxypurinol, adenine, guanine, xanthine, hypoxanthine, xanthine oxidase, xanthine deaminase, adenosine deaminase, and 5'-nucleotidase activities were studied. Results. The changes in purine metabolism were found in all patients with gastric cancer, including compared with the control group of healthy people, the level of uric acid was 2.0 times higher, oxypurinol 4.5 times higher, adenine — by 16 %, xanthine oxidase activity by 2.1 times, xanthine deaminase — by 33 % and adenosine deaminase — by 7.1 times, the elevated rates of which were found in 99, 84, 39, 90, 53 and 100 % of cases, respectively, depending on the severity of the tumor process, total lesion of the stomach, spread of the tumor to the liver, pancreas, and esophagus, the presence of metastases in para-aortic lymph nodes, liver, lung, bones and brain. The altered purine metabolism worsens three-year survival of patients against the background of surgical, medical, and radiation treatment. Conclusion. Changes in purine metabolism are involved in the pathogenetic constructions of the GC, reflect the peculiarities of the course of the tumor process; and the parameters of uric acid and adenine have prognostic significance.
рак; шлунок; пурини; метаболізм
рак; желудок; пурины; метаболизм
cancer; stomach; purines; metabolism
Введение
Рак повсеместно наносит огромный медико-социальный и экономический урон обществу [1, 2]. Первостепенной проблемой онкологии считается рак желудка (РЖ), что объясняется его высокой распространенностью [3] и смертностью вследствие него [4], запоздалой диагностикой заболевания, анатомо-топографическими особенностями поражаемого опухолью органа и низкой результативностью существующих методов лечения [5].
Во всем мире увеличивается число людей с нарушениями пуринового метаболизма [6], роль которых в процессах канцерогенеза остается недостаточно изученной, а их клиническая значимость требует уточнения [7]. При этом высокое содержание в крови конечного продукта обмена пуринов мочевой кислоты (UA) относится к важным патогенетическим факторам многих онкологических заболеваний [8, 9], а постоянная гиперурикемия ухудшает выживаемость таких больных [10, 11]. Уже было установлено, что увеличение содержания UА в крови является фактором риска развития и дальнейшего тяжелого течения РЖ [12]. Считается, что пуриновые основания относятся к биомаркерам рака, но их диагностическая и прогностическая значимость при РЖ остается неизученной [13].
Цель: оценить состояние пуринового метаболизма при РЖ, установить клинико-патогенетическую значимость выявленных изменений, определить роль гиперурикемии в выживаемости больных.
Материалы и методы
Под наблюдением находились 88 больных РЖ (все мужчины) в возрасте от 29 до 79 лет (в среднем (60,40 ± 1,08) года). Локализация опухолевого процесса в выходном отделе желудка имела место в 76,4 % случаев, в теле — в 15,9 %, в антральном отделе — в 3,4 %, а тотальное поражение отмечено у 2,3 % от числа пациентов. Аденокарцинома диагностирована в 71,6 % наблюдений, аденогенный недифференцированный РЖ — в 18,2 %, плоскоклеточный — в 8,0 %, перстневидноклеточный — в 2,3 %. Соотношение IА, IB, IIA, IIB, IIIA, IIIB и IV стадий РЖ составило 1 : 3 : 9 : 12 : 6 : 5 : 6. Прорастание опухоли в селезенку установлено в 14,8 % случаев, в поджелудочную железу — в 6,8 %, в печень — в 5,7 %, в пищевод — в 3,4 %, в диафрагму — в 2,3 %, в желчный пузырь — в 1,1 %. Метастазы в лимфатические узлы обнаружены в 60,2 % наблюдений РЖ, в отдаленные органы — в 13,6 %. Показатель тяжести течения опухолевого процесса (IWT) составил (5,5 ± 0,43) отн.ед.
Для диагностики рака и его метастазов применяли рентгеновский аппарат Multix Compact Siеmens (Германия), компьютерный томограф Somazom Emotion-6 Siemens (Германия), магнитно-резонансный томограф Gygoscan Intera Philips (Нидерланды), сонограф Envisor Philips (Нидерланды), фиброскопы Olympus GIF-Q20 (Япония), EXERA-II Olympus (Япония) и Fujinon FG-1Z (Япония). Используя биохимические анализаторы Olympus AU640 (Япония) и BS-200 (Китай), спектрофотометры SPECORD S-600 (Германия), «Искролайн-100» (Россия) и «СФ-46» (Россия), в сыворотке крови изучали уровни продуктов пуринового метаболизма — мочевой кислоты, оксипуринола (ОР), аденина (Ad), гуанина (Gu), ксантина (Xa), гипоксантина (Hx), активности ксантиноксидазы (ХO), ксантиндезаминазы (XD), аденозиндезаминазы (AD) и 5-нуклеотидазы (5N). Интегральную степень изменения показателей пуринового метаболизма (IPM) высчитывали по формуле:
где М1 — показатель у больного, М2 — средний показатель у здоровых лиц контрольной группы, SD — стандартное отклонение показателя у здоровых лиц. Измененным значением считали IPM > 3 отн.ед. Подсчитывали (в процентах) число измененных показателей пуринового обмена (> M + SD здоровых лиц). В качестве контроля обследованы 30 практически здоровых мужчин возрасте от 20 до 68 лет (в среднем (39,70 ± 1,90) года).
Проведенные исследования одобрены комиссией по биоэтике Донецкого национального медицинского университета, больные представили письменное информированное согласие на участие в исследовании.
Статистическая обработка полученных результатов проведена с помощью компьютерного вариационного, непараметрического, корреляционного одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (M), их стандартные ошибки (SE) и отклонения (SD), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), критерии однофакторной дисперсии (D), однородности дисперсии Брауна — Форсайта (BF) и многофакторного дисперсионного анализа Уилкоксона — Рао (WR), различий Стьюдента (t), а также достоверность статистических показателей (р). Подсчитывали степень прогностически позитивного результата модели (PPV) и трехлетнюю выживаемость больных по методу Каплана — Мейера (St).
Результаты
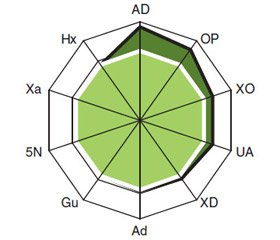
У больных РЖ содержание в крови UA составляет (547,10 ± 13,78) мкмоль/л, OP — (110,30 ± ± 7,32) мкмоль/л, Ad — (142,10 ± 4,10) е.э., Gu — (186,30 ± 4,80) е.э., Xa — (151,20 ± 2,99) е.э., Hx — (169,50 ± 4,09) е.э., активность XO — (7,50 ± ± 0,47) нмоль/мл • мин, XD — (8,10 ± 0,52) нмоль/мл × × мин, AD — (11,40 ± 1,24) нмоль/мл • мин и 5N — (6,00 ± 0,10) нмоль/мл • мин. По сравнению с аналогичными показателями у здоровых лиц контрольной группы установлено достоверное повышение уровня UA в 2,0 раза (t = 11,62, p < 0,001), OP — в 4,5 раза (t = 6,81, p < 0,001), Ad — на 16 % (t = 2,39, p = 0,019), XO — в 2,1 раза (t = 4,87, р < 0,001), XD — на 33 % (t = 2,22, p = 0,028) и AD — в 7,1 раза (t = 4,69, p < 0,001) (рис. 1). Трехмерные гистограммы интегральных показателей ферментов пуринового обмена (XO + XD + + AD) у больных РЖ и здоровых лиц контрольной группы представлены на рис. 2.
Повышение концентрации AD в сыворотке крови (> M + SD здоровых лиц) обнаружено у 100,0 % больных РЖ, UA — у 98,9 %, XO — у 89,8 %, ОР — у 84,1 %, XD — у 53,4 %, 5N — у 39,8 %, Ad — у 38,6 %, Hx — у 30,7 %, Gu — у 23,9 %, Xa — у 19,3 % (рис. 3). В целом интегральные изменения показателей пуринового метаболизма обнаружены во всех случаях РЖ, а гиперурикемия (UA > 420 мкмоль/л здоровых лиц) — в 78,4 %. При этом IPM составил (3,70 ± 0,02) отн.ед.
У больных РЖ с нормальным уровнем UA в сыворотке крови показатель ОР составил (113,00 ± ± 11,06) мкмоль/л, Ad — (113,50 ± 3,59) е.э., Gu — (166,80 ± 0,40) е.э., Xa — (146,70 ± 7,00) е.э., Hx — (186,50 ± 8,00) е.э., XO — (7,30 ± 1,21) мкмоль/мл • мин, XD — (8,30 ± 1,00) мкмоль/мл • мин, AD — (7,20 ± 0,99) мкмоль/мл • мин, 5N — (5,80 ± 0,18) мкмоль/мл × × мин. В случаях гиперурикемии (рис. 4) установлено повышение на 32 % содержания Ad (t = 3,95, p < 0,001) и на 15 % — Gu (t = 2,18, p = 0,032) при уменьшении на 12 % активности Hx (t = 2,24, p = 0,028). Необходимо отметить, что параметры урикемии у больных РЖ прямо соотносятся со значениями в крови Ad (r = +0,666, p < 0,001), Gu (r = +0,521, p < 0,001), XO (r = +0,179, p = 0,049) и XD (r = +0,295, p = 0,001). Подчеркнем, что соответственно повышению возраста больных РЖ уменьшаются показатели аденинемии (r = –0,254, p = 0,018), ксантинемии (r = –0,225, p = 0,037) и гипоксантинемии (r = –0,233, p = 0,031).
По данным многофакторного дисперсионного анализа Уилкоксона — Рао, на интегральное состояние пуринового метаболизма оказывают воздействие показатель IWR (WR = 3,48, p > 0,001), тотальное поражение желудка (WR = 1,96, p = 0,049), прорастание опухоли в печень (WR = 3,31, p = 0,001), поджелудочную железу (WR = 2,03, p = 0,042) и пищевод (WR = 2,29, p = 0,021), метастазы в парааортальные лимфоузлы (WR = 2,25, p = 0,023), печень (WR = 12,09, p < 0,001), легкие (WR = 3,10, p = 0,002), скелет (WR = 4,39, p < 0,001) и головной мозг (WR = 2,64, p = 0,008). Как свидетельствует однофакторный дисперсионный анализ, уровень урикемии тесно связан с показателем IWT (D = 2,11, p = 0,023), прорастанием опухоли в печень (D = 3,21, p = 0,001) и селезенку (D = 2,43, p = 0,009), на оксипуринолемию влияет поражение антрального отдела желудка (D = 2,04, p = 0,024), плоскоклеточный морфологический вариант рака (D = 3,69, p < 0,001) и наличие метастазов в печень (D = 2,83, p = 0,002), на уровни Ad и Ха — метастазы в легкие (соответственно D = 2,81, p = 0,003 и D = 4,47, p < 0,001), на содержание Gu — прорастание опухоли в пищевод (D = 2,51, p = 0,001) и метастазирование в парааортальные лимфоузлы (D = 3,05, p < 0,001), на активность ХО — метастазирование в костно-суставной аппарат (D = 4,70, p < 0,001), на AD — метастазирование РЖ в головной мозг (D = 1,97, p = 0,026).
Обсуждение
Мы отобрали те показатели пуринового обмена, которые имели одновременно достоверные дисперсионные и корреляционные связи Пирсона с параметром IWT (рис. 5). К ним относятся уровни урикемии (D = 2,11, p = 0,023; r = +0,788, p < 0,001) и аденинемии (D = 4,24, p < 0,001; r = +0,618, p < 0,001). Как показал дисперсионный анализ однородности Брауна — Форсайта и непараметрический Кендалла, в прогрессировании РЖ участвуют показатели ОР (BF = 5,47, p < 0,001; τ = +0,811, p < 0,001) и активности ХО (BF = 4,50, p = 0,002; τ = +0,177, p = 0,015), а высокое содержание Ad определяет тяжесть течения заболевания (BF = 5,06, p < 0,001; τ = +0,149, p = 0,040), участвует в процессах метастазирования опухоли в лимфатические узлы (BF = 5,88, p = 0,027; τ = +0,306, p = 0,004) и печень (BF = 5,05, p = 0,027; τ = +0,165, p = 0,023). Кроме того, от степени активности XD прямо зависит прорастание РЖ в пищевод (BF = 44,83, p < 0,001; τ = +0,151, p = 0,037).
С уровнями отдельных показателей пуринового обмена степень дифференциации РЖ не связана, тогда как на IWT влияют параметры UA (BF = 43,17, p < 0,001), Ad (BF = 18,58, p < 0,001), Gu (BF = 5,06, p < 0,001), Xa (BF = 5,97, p < 0,001), Hx (BF = 6,31, p < 0,001), XO (BF = 2,74, p = 0,004) и 5N (BF = 8,56, p < 0,001). На интегральные признаки течения РЖ оказывает воздействие наличие у больных гиперурикемии, что продемонстрировал многофакторный дисперсионный анализ Уилкоксона — Рао (WR = 7,03, p < 0,001). При этом с IPM тесно связано (p < 0,001) формирование метастазов в печень (BF = 55,83), селезенку (BF = 108,29) и легкое (BF = 39,15).
После выполненной статистической обработки данных обследования установлена прогнознегативная значимость при РЖ уровней в сыворотке крови (> N + SD больных) UA > 670 мкмоль/л (PPV = 76,2 %) и Ad > 180 е.э. (PPV = 76,5 %). В связи с этим следует дать некоторые комментарии. UA, как сигнальная молекула, повышает скорость формирования неоплазменного процесса и миграции опухолевых клеток [14]. При злокачественных опухолях разных локализаций содержание UA в сыворотке крови выше, чем в случаях доброкачественных новообразований, и отражает степень тяжести рака [15]. Вместе с тем существует мнение [16], что наличие гиперурикемии у женщин с раком молочной железы обладает некими протекторными свойствами в отношении неблагоприятного течения опухолевого процесса в связи с наличием антиоксидантных свойств UA. Имеются данные, что при саркомах высокий уровень в крови UA является прогнозпозитивным фактором, способствующим увеличению сроков выживаемости больных [17]. Следует подчеркнуть, что у больных раком предстательной железы концентрации в сыворотке крови UA не выше, а ниже, чем у практически здоровых мужчин контрольной группы, и обратно коррелируют с уровнем простатического ракового антигена [18].
Пуриновое основание Ad (6-аминопурин) играет важную роль в метаболизме опухолевых клеток [19, 20]. Интрацеллюлярный аденозин может быть под действием AD преобразован в инозин, а тот — в Hx, Ad и далее в UA [21]. Мутации в гене AD и Ad являются одной из причин канцерогенеза [22], определяя синтез нуклеиновых кислот и темпы роста раковых клеток [23, 24].
После оценки состояния пуринового метаболизма 86,4 % от числа больных РЖ были прооперированы (в 38,2 % случаев выполнена гастрэктомия, а в 61,8 % — резекции желудка), 76,1 % проводили ХТ, 53,4 % — ЛТ. 41,8 % от числа пациентов получали антиметаболиты, 20,9 % — препараты платины, 10,5 % — таксаны, 9,0 % — подофиллотоксины, 7,5 % — антрациклины, 6,0 % — алкиланты, 4,5 % — алкалоиды барвинка. Использовали дистанционную телегамматерапию в режиме мелкого фракционирования дозы по 2 Гр и суммарной дозой до 60 Гр (в среднем (49,20 ± 4,39) Гр). Как видно из рис. 6, трехлетняя выживаемость у больных РЖ с гиперурикемией была на 16 % хуже.
Выводы
1. Изменения пуринового метаболизма установлены у всех больных РЖ, в том числе по сравнению с контрольной группой здоровых лиц достоверно выше уровни UA, OP, Ad, XO, XD и AD.
2. Дисметаболизм пуринов при РЖ зависит от степени тяжести течения опухолевого процесса, тотального поражения желудка, прорастания опухоли в печень, поджелудочную железу и пищевод, наличия метастазов в парааортальные лимфатические узлы, печень, легкое, скелет и головной мозг.
3. Нарушения обмена пуринов участвуют в патогенетических построениях РЖ, ухудшая выживаемость пациентов на фоне выполненного хирургического, медикаментозного и лучевого лечения.
4. Прогнознегативной значимостью при РЖ обладают показатели гиперурикемии и гипераденинемии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Информация о финансировании — личное участие.
Информация о вкладе каждого автора: Синяченко О.В. — концепция, дизайн исследования, написание текста; Алиев Р.Б. — сбор материалов, изучение литературы по проблеме; Ермолаева М.В. — обработка материалов, анализ данных литературы; Бондарь В.Г. — сбор материалов, оформление иллюстраций.
1. Haseeb M., Hussain S. Pharmacophore development for anti-lung cancer drugs. Asian. Pac. J. Cancer Prev. 2015. 16(18). 8307-11.
2. Nur U., Lyratzopoulos G., Rachet B., Coleman M.P. The impact of age at diagnosis on socioeconomic inequalities in adult cancer survival in England. Cancer Epidemiol. 2015. 39(4). 641-9. doi: 10.1016/j.canep.2015.05.006.
3. Bilici A. Treatment options in patients with metastatic gastric cancer: current status and future perspectives. World J. Gastroenterol. 2014. 20(14). 3905-15. doi: 10.3748/wjg.v20.i14.3905.
4. Wang Y., Lv Y., Liu T.S., Yan W.D., Chen L.Y., Li Z.H. et al. Cordycepin suppresses cell proliferation and migration by targeting CLEC2 in human gastric cancercells via Akt signaling pathway. Life Sci. 2019. 223(15). 110-9. doi: 10.1016/j.lfs.2019.03.025.
5. Aprile G., Ongaro E., Del Re M., Lutrino S.E., Bonotto M., Ferrari L. et al. Angiogenic inhibitors in gastric cancers and gastroesophageal junction carcinomas: A critical insight. Crit. Rev. Oncol. Hematol. 2015. 95(2). 165-78. doi: 10.1016/j.critrevonc.2015.02.009.
6. Hou C., Liu D., Wang M., Gong C., Li Y., Yang L. et al. Novel xanthine oxidase-based cell model using HK-2 cell for screening antihyperuricemic functional compounds. Free Radic. Biol. Med. 2019. 20(136). 135-45. doi: 10.1016/j.freeradbiomed.2019.04.007.
7. Garcia-Gil M., Camici M., Allegrini S., Pesi R., Petrotto E., Tozzi M.G. Emerging role of purine metabolizing enzymes in brain function and tumors. Int. J. Mol. Sci. 2018. 19(11). 3598. doi: 10.3390/ijms19113598.
8. Bjorge T., Lukanova A., Jonsson H., Tretli S., Ulmer H., Manjer J. et al. Metabolic syndrome and breast cancer in the me-can (metabolic syndrome and cancer) project. Cancer Epidemiol. Biomark. Prev. 2010. 19(1):. 1737-45. doi: 10.1158/1055-9965.EPI-10-0230.
9. Pasalic D., Marinkovic N., Feher-Turkovic L. Uric acid as one of the important factors in multifactorial disorders — facts and controversies. Biochem. Med. 2012. 22(2). 63-75. doi: 10.11613/BM.2012.007.
10. Kim H.J., Kim J.E., Jung J.H., Kim E.R., Hong S.N., Chang D.K. et al. Uric acid is a risk indicator for metabolic syndrome-related colorectal adenoma: results in a Korean population receiving screening colonoscopy. Korean J. Gastroenterol. 2015. 66(4). 202-8. doi: 10.4166/kjg.2015.66.4.202.
11. Yue C.F., Feng P.N., Yao Z.R., Yu X.G., Lin W.B., Qian Y.M. et al. High serum uric acid concentration predicts poor survival in patients with breast cancer. Clin. Chim. Acta. 2017. 473(10). 160-5. doi: 10.1016/j.cca.2017.08.027.
12. Kaji K., Hashiba A., Uotani C., Yamaguchi Y., Ueno T., Ohno K. et al. Grading of atrophic gastritis is useful for risk stratification in endoscopic screening for gastric cancer. Am. J. Gastroenterol. 2019. 114(1). 71-9. doi: 10.1038/s41395-018-0259-5.
13. Sun Q., Zhao W., Wang L., Guo F., Song D., Zhang Q. et al. Integration of metabolomic and transcriptomic profiles to identify biomarkers in serum of lung cancer. J. Cell Biochem. 2019. 25(2). 28482. doi: 10.1002/jcb.28482.
14. Fini M.A., Elias A., Johnson R.J., Wright R.M. Contribution of uric acid to cancer risk, recurrence, and mortality. Clin. Transl. Med. 2012. 1. 1-16. doi: 10.1186/2001-1326-1-16.
15. Liu D., Yun Y., Yang D., Hu X., Dong X., Zhang N. et al. What is the biological function of uric acid? An antioxidant for neural protection or a biomarker for cell death. Dis. Markers. 2019. 10(1). 4081962. doi: 10.1155/2019/4081962.
16. Kühn T., Sookthai D., Graf M.E., Schübel R., Freisling H., Johnson T. et al. Albumin, bilirubin, uric acid and cancer risk: results from a prospective population-based study. Br. J. Cancer. 2017. 117(10). 1572-9. doi: 10.1038/bjc.2017.313.
17. Szkandera J., Gerger A., Liegl-Atzwanger B., Stotz M., Samonigg H., Ploner F. et al. Uric acid levels in blood are associated with clinical outcome in soft-tissue sarcoma patients. Clin. Chem. Lab. Med. 2015. 53(3). 493-7. doi: 10.1515/cclm-2014-0486.
18. Benli E., Cirakoglu A., Ayyıldız S.N., Yüce A. Comparison of serum uric acid levels between prostate cancer patients and a control group. Cent. European J. Urol. 2018. 71(2). 242-7. doi: 10.5173/ceju.2018.1619.
19. Pedley A.M., Benkovic S.J. A new view into the regulation of purine metabolism: the purinosome. Trends Biochem. Sci. 2017. 42(1). 141-54. doi: 10.1016/j.tibs.2016.09.009.
20. Garcia-Gil M., Camici M., Allegrini S., Pesi R., Petrotto E., Tozzi M.G. Emerging role of purine metabolizing enzymes in brain function and tumors. Int. J. Mol. Sci. 2018. 19(11). 3598. doi: 10.3390/ijms19113598.
21. Camici M., Garcia-Gil M., Tozzi M.G. The inside story of adenosine. Int. J. Mol. Sci. 2018. 19(1). 784. doi: 10.3390/ijms19030784.
22. Zhang X.G., Ma G.Y., Kou F., Liu W.J., Sun Q.Y., Guo G.J. et al. Reynoutria japonica from traditional chinese medicine: a source of competitive adenosine deaminase inhibitors for anticancer. Comb. Chem. High Throughput. Screen. 2019. 14(4). 00618. doi: 10.2174/1386207322666190415100618.
23. Muller A., Homey B., Soto H., Ge N., Catron D., Buchanan M.E. et al. Involvement of chemokine receptors in breast cancer metastasis. Nature. 2010. 410(1). 50-6. doi: 10.1038/ 35065016.
24. Townsend M.H., Felsted A.M., Ence Z.E., Piccolo S.R., Robison R.A., O’Neill K.L. Elevated expression of hypoxanthine guanine phosphoribosyltransferase within malignant tissue. Cancer. Clin. Oncol. 2017. 6(6). 19-34. doi: 10.5539/cco.v6n2p19.

/16-1.jpg)
/17-1.jpg)
/17-2.jpg)
/18-1.jpg)
/19-1.jpg)