Журнал «Медицина неотложных состояний» №8(103), 2019
Вернуться к номеру
Дефіцит кальцію та магнію в дітей із гострою дихальною недостатністю: проспективне обсерваційне когортне дослідження
Авторы: Філик О.В.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Тяжка гіпомагніємія та некоригована гіпокальціємія можуть призводити до тяжких порушень в організмі пацієнта. Метою цього дослідження було встановити поширеність, фактори ризику розвитку гіпомагніємії та гіпокальціємії в дітей із гострою дихальною недостатністю. Робочою гіпотезою було те, що гіпомагніємія та гіпокальціємія впливають на тривалість відлучення пацієнтів від штучної вентиляції легень та тривалість перебування пацієнтів у відділенні інтенсивної терапії. Матеріали та методи. Нами проведено проспективне когортне одноцентрове дослідження на клінічній базі кафедри анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького (відділення анестезіології з ліжками інтенсивної терапії Львівської обласної дитячої клінічної лікарні «ОХМАТДИТ») серед пацієнтів віком від 1 міс. до 3 років. Рівень магнію та іонізованого кальцію сироватки крові оцінювали в 1-шу (d1), 3-тю (d3), 5-ту (d5), 7-му та 9-ту добу (d7 та d9). Клінічні дані, що публікуються в даній статті, є частиною результатів клінічного дослідження Diaphragm ultrasound and trends in electrolyte disorders and transthyretin level as a method to predict ventilation outcome in children: the prospective observational cohort study; ISRCTN84734652; https://doi.org/10.1186/ISRCTN84734652. У період дослідження у відділення було прийнято 57 пацієнтів із гострою дихальною недостатністю, до аналізу даних включено 54 пацієнти. При гіпомагніємії нижче 0,8 ммоль/л пацієнтам додавали до лікування магнію сульфат 25% в/в із розрахунку 50 мг/кг/добу до досягнення цільового рівня магнію сироватки крові понад 0,8 ммоль/л. При гіпокальціємії нижче 1,1 ммоль/л додавали до лікування кальцію глюконат 10% в/в із розрахунку 1 мл/кг/добу (еквівалентно 0,23 ммоль/кг/добу). Результати. Нормомагніємію виявили у 29,6 % пацієнтів, гіпомагніємію — у 70,4 %, нормокальціємію та гіпокальціємію — у 77,8 та 22,2 % відповідно. У пацієнтів із нормомагніємією при надходженні на лікування (0,82 ± 0,06 ммоль/л) спостерігалося зниження рівня магнію впродовж перших 3 днів лікування до 0,73 ± 0,08 ммоль/л, що потребувало корекції. У подальшому рівень магнію поступово зростав і на 9-ту добу лікування становив 1,10 ± 0,15 ммоль/л. Серед дітей, які при надходженні на лікування мали помірну гіпомагніємію (0,62 ± 0,11 ммоль/л) та отримували коригуючу терапію розчином магнію сульфату, рівень магнію нормалізовувався на етапі дослідження d5 і становив 0,85 ± 0,07 ммоль/л, на етапах дослідження d7 та d9 — 0,92 ± 0,11 та 0,95 ± 0,14 ммоль/л відповідно. При надходженні на лікування рівень іонізованого кальцію в групі пацієнтів із нормокальціємією становив 1,13 ± 0,04 ммоль/л та не потребував корекції впродовж усього періоду лікування у відділенні інтенсивної терапії. Однак у групі гіпокальціємії рівень іонізованого кальцію на етапі d1 становив 0,81 ± 0,08 ммоль/л, що потребувало проведення корекції. У результаті рівень іонізованого кальцію зростав на етапі дослідження d3 до 1,07 ± 0,03 ммоль/л та нормалізувався з етапу дослідження d5 і становив 1,17 ± 0,08 ммоль/л. Найчастішими факторами ризику розвитку гіпомагніємії серед наших пацієнтів були: застосування діуретиків, сепсис та антибіотик-асоційована діарея. 39,5 % пацієнтів із гіпомагніємією при надходженні впродовж перших 3–5 діб отримували петлеві діуретики, більшість із них мали сепсис. Викликає інтерес той факт, що в 31,6 % пацієнтів із гіпомагніємією зустрічалася гіпокальціємія порівняно з частотою виявлення гіпокальціємії в загальній когорті на рівні 22,2 %. Ми не виявили відмінностей у тривалості штучної вентиляції легень серед пацієнтів із гіпомагніємією та нормомагніємією (12,3 ± 1,8 доби порівняно з 14,1 ± 1,1 доби відповідно, p = 0,43). Також не було виявлено вірогідних відмінностей у тривалості штучної вентиляції легень серед пацієнтів із гіпокальціємією та нормокальціємією. Проте тривалість перебування у відділенні інтенсивної терапії була в 1,47 раза довшою (95% ДІ 1,2–1,9, p = 0,04) серед пацієнтів із гіпомагніємією при надходженні на лікування порівняно з пацієнтами з нормомагніємією. У нашому дослідженні не було виявлено відмінностей у рівні летальності серед пацієнтів із гіпомагніємією (рівень летальності — 23,7 %) та нормомагніємією (рівень летальності — 25 %), p = 0,27. Висновки. У дітей із гострою дихальною недостатністю частота виявлення гіпомагніємії при надходженні на лікування становила 70,4 %, гіпокальціємії — 22,2 %. Чинниками, асоційованими з розвитком гіпомагніємії в дітей із гострою дихальною недостатністю, можуть бути застосування петлевих діуретиків та сепсис. Не було виявлено відмінностей у тривалості штучної вентиляції легень серед пацієнтів із порушеннями рівня магнію та кальцію та без них. Проте тривалість перебування у відділенні інтенсивної терапії серед пацієнтів із гіпомагніємією була в 1,47 раза більша (95% ДІ 1,2–1,9, p = 0,04) порівняно з пацієнтами з нормомагніємією.
Резюме. Актуальность. Тяжелая гипомагниемия и некорригированная гипокальциемия могут приводить к тяжелым нарушениям в организме пациента. Целью этого исследования было установить распространенность, факторы риска развития гипомагниемии и гипокальциемии у детей с острой дыхательной недостаточностью. Рабочей гипотезой было то, что гипомагниемия и гипокальциемия влияют на продолжительность отлучения пациентов от искусственной вентиляции легких и длительность пребывания пациентов в отделении интенсивной терапии. Материалы и методы. Нами проведено проспективное когортное одноцентровое исследование на клинической базе кафедры анестезиологии и интенсивной терапии Львовского национального медицинского университета имени Данила Галицкого (отделение анестезиологии с койками интенсивной терапии Львовской областной детской клинической больницы «ОХМАТДЕТ») среди пациентов в возрасте от 1 мес. до 3 лет. Уровень магния и ионизированного кальция сыворотки крови оценивали в 1-е (d1), 3-и (d3), 5-е (d5), 7-е и 9-е сутки (d7 и d9). Клинические данные, публикуемые в данной статье, являются частью результатов клинического исследования Diaphragm ultrasound and trends in electrolyte disorders and transthyretin level as a method to predict ventilation outcome in children: the prospective observational cohort study; ISRCTN84734652; https://doi.org/10.1186/ISRCTN84734652. В период исследования в отделение были приняты 57 пациентов с острой дыхательной недостаточностью, в анализ данных включены 54 пациента. При гипомагниемии ниже 0,8 ммоль/л пациентам добавляли к лечению магния сульфат 25% в/в из расчета 50 мг/кг/сут до достижения целевого уровня магния в сыворотке крови более 0,8 ммоль/л. При гипокальциемии ниже 1,1 ммоль/л добавляли к лечению кальция глюконат 10% в/в из расчета 1 мл/кг/сут (эквивалентно 0,23 ммоль/кг/сут). Результаты. Нормомагниемию обнаружили у 29,6 % пациентов, гипомагниемию — у 70,4 %, нормокальциемию и гипокальциемию — у 77,8 и 22,2 % соответственно. У пациентов с нормомагниемией при поступлении на лечение (0,82 ± 0,06 ммоль/л) наблюдалось снижение уровня магния в течение первых 3 дней лечения до 0,73 ± 0,08 ммоль/л, что требовало коррекции в соответствии с описанным выше алгоритмом. В дальнейшем уровень магния постепенно увеличывался и на d9 составлял 1,10 ± 0,15 ммоль/л. Среди детей, которые при поступлении на лечение имели умеренную гипомагниемию (0,62 ± 0,11 ммоль/л) и получали корректирующую терапию раствором магния сульфата в/в, уровень магния нормализовывался на этапе исследования d5 и составлял 0,85 ± 0,07 ммоль/л, на этапах исследования d7 и d9 — 0,92 ± 0,11 и 0,95 ± 0,14 ммоль/л соответственно. При поступлении на лечение уровень ионизированного кальция в группе пациентов с нормокальциемией составлял 1,13 ± 0,04 ммоль/л и не нуждался в коррекции в течение всего периода лечения в отделении интенсивной терапии. Однако в группе гипокальциемии уровень ионизированного кальция на этапе d1 составлял 0,81 ± 0,08 ммоль/л, что требовало проведения коррекции. В результате уровень ионизированного кальция увеличивался на этапе исследования d3 до 1,07 ± 0,03 ммоль/л и нормализовался с этапа исследования d5, составляя 1,17 ± 0,08 ммоль/л. Частыми факторами риска развития гипомагниемии среди наших пациентов были: применение диуретиков, сепсис и антибиотик-ассоциированная диарея. 39,5 % пациентов с гипомагниемией при поступлении в течение первых 3–5 суток получали петлевые диуретики, большинство из них имели сепсис. Вызывает интерес тот факт, что у 31,6 % пациентов с гипомагниемией встречалась гипокальциемия по сравнению с частотой выявления гипокальциемии в общей когорте на уровне 22,2 %. Мы не обнаружили различий в продолжительности искусственной вентиляции легких у пациентов с гипомагниемией и нормомагниемией (12,3 ± 1,8 суток по сравнению с 14,1 ± 1,1 суток соответственно, p = 0,43). Также не было выявлено достоверных различий в продолжительности искусственной вентиляции легких у пациентов с гипокальциемией и нормокальциемией. Однако продолжительность пребывания в отделении интенсивной терапии была в 1,47 раза больше (95% ДИ (1,2–1,9), p = 0,04) среди пациентов с гипомагниемией при поступлении на лечение по сравнению с пациентами с нормомагниемией. В нашем исследовании не было обнаружено различий в уровне летальности среди пациентов с гипомагниемией (уровень летальности — 23,7 %) и нормомагниемией (уровень летальности — 25 %), p = 0,27. Выводы. У детей с острой дыхательной недостаточностью частота выявления гипомагниемии при поступлении на лечение составляет 70,4 %, гипокальциемии — 22,2 %. Факторами, ассоциированными с развитием гипомагниемией, могут быть применение петлевых диуретикив и сепсис. Не было выявлено различий в продолжительности искусственной вентиляции легких у пациентов с нарушением уровня магния и кальция и без него. Однако продолжительность пребывания в отделении интенсивной терапии среди пациентов с гипомагниемией была в 1,47 раза больше (95% ДИ 1,2–1,9, p = 0,04) по сравнению с пациентами с нормомагниемией.
Background. Severe hypomagnesemia and uncorrected hypocalcemia can lead to severe disorders. The aim of this study was to investigate the prevalence and risk factors of hypomagnesemia and hypocalcemia in children with acute respiratory failure. The study hypothesis was that hypomagnesemia and hypocalcemia prolong weaning from mechanical ventilation (MV) and duration of stay in the intensive care unit (ICU). Materials and methods. We complete a prospective single-center cohort study at the Department of Anesthesiology and Intensive Care of Danylo Halytsky Lviv National Medical University (Department of Anesthesiology and Intensive Care, Lviv Regional Children’s Clinical Hospital “OHMATDYT”). We examined patients from 1 month to 3 years old with acute respiratory failure on invasive MV. Serum magnesium and ionized calcium levels were evaluated on the first (d1), third (d3), fifth (d5), seventh (d7) and ninth (d9) days. Results described in this article is the part of the clinical study “Diaphragm ultrasound and trends in electrolyte disorders and transthyretin level as a method to predict ventilation outcome in children: the prospective observational cohort study”; ISRCTN84734652. We enrolled 57 patients with acute respiratory failure, and the analysis of study results included 53 children. If serum magnesium level was below 0.8 mmol/l, all patients received magnesium sulfate 25% intravenously 50 mg/kg/day to reach the target serum magnesium level above 0.8 mmol/l. In case of hypocalcemia (serum ionized calcium level below 1.1 mmol/l), patients received calcium gluconate 10% intravenously 1 ml/kg/day (equivalent to 0.23 mmol/kg/day). Results. We found normomagnesemia in 29.6 % of patients, hypomagnesemia — in 70.4 %, normocalcemia and hypocalcemia — in 77.8 and 22.2 % of individuals, respectively. In patients with normomagnesemia at admission (0.82–0.06 mmol/l), magnesium level reduced to 0.73 ± 0.08 mmol/l within the first 3 days of treatment and required correction. Subsequently, serum magnesium level gradually increased and by the d9 reached 1.10 ± 0.15 mmol/l. Patients with moderate hypomagnesemia at admission (serum magnesium level of 0.62 ± 0.11 mmol/l) also received magnesium sulfate intravenously, and magnesium level normalized by the d5 and was 0.85 ± 0.07 mmol/l, and on study stages d7 and d9 — 0.92 ± 0.11 mmol/l and 0.95 ± 0.14 mmol/l, respectively. The level of ionized calcium in the group of patients with normocalcemia was 1.13 ± 0.04 mmol/l at admission and did not require correction. However, in the group of patients with hypocalcemia, the level of ionized calcium on the d1 was 0.81 ± 0.08 mmol/l and required correction. As a result, the level of ionized calcium increased on d3 to 1.07 ± 0.03 mmol/l and normalized on the d5 — 1.17 ± 0.08 mmol/l. The most common risk factors for hypomagnesemia in our patients were diuretics, sepsis and antibiotic-associated diarrhea. 39.5 % of patients with hypomagnesemia received loop diuretics within the first 3–5 days after admission, most of them had sepsis. It was interesting that 31.6 % of persons with hypomagnesemia had hypocalcemia, as compared to the incidence of hypocalcemia in the overall cohort at the level of 22.2 %. We have not found differences in the duration of MV among patients with hypomagnesemia and normomagnesemia (12.3 ± 1.8 days versus 14.1 ± 1.1 days, respectively; p = 0.43). In addition, there were no significant differences in duration of MV among patients with hypocalcemia and normocalcemia. However, the length of stay in the ICU was 1.47 times longer (95% confidence interval (CI) 1.2–1.9, p = 0.04) among patients with hypomagnesemia at admission as compared to the patients with normomagnesemia. We have not found differences in mortality rates among patients with hypomagnesemia (23.7 %) and normomagnesemia (25 %), p = 0.27. Conclusions. The incidence of hypomagnesemia in children with acute respiratory failure at admission was 70.4 %, and the incidence of hypocalcemia — 22.2 %. Factors associated with the development of hypomagnesemia might be the use of loop diuretics and sepsis. We have not found differences in duration of MV among patients with and without magnesium and calcium disorders. However, the duration of stay in the ICU among patients with hypomagnesemia was 1.47 times higher (95% CI 1.2–1.9, p = 0.04) as compared to the patients with normomagnesemia.
гіпомагніємія; гіпокальціємія; штучна вентиляція легень; діти
гипомагниемия; гипокальциемия; искусственная вентиляция легких; дети
hypomagnesemia; hypocalcemia; mechanical ventilation; children
Вступ
Електролітні порушення часто зустрічаються в пацієнтів відділення інтенсивної терапії (ВІТ) для дітей. Зміни вмісту магнію та кальцію в дітей раннього віку в критичному стані є одним із найчастіших порушень разом із порушеннями рівня фосфору сироватки крові [1, 6, 7]. Дефіцит магнію є поширеною проблемою серед пацієнтів у критичному стані, що корелює з вищим рівнем летальності та гіршими результатами лікування пацієнтів ВІТ. Гіпомагніємію виявляють у 40 % госпіталізованих пацієнтів, приблизно в 60 % хірургічних пацієнтів, у 65 % пацієнтів ВІТ загального профілю та в 90 % пацієнтів ВІТ хірургічного профілю [2, 3]. Проте існує мало даних про те, якою є поширеність гіпомагніємії та гіпокальціємії серед дітей із гострою дихальною недостатністю.
Метою цього дослідження було встановити поширеність, фактори ризику розвитку гіпомагніємії та гіпокальціємії в дітей із гострою дихальною недостатністю. Робочою гіпотезою було те, що гіпомагніємія та гіпокальціємія впливають на тривалість відлучення пацієнтів від штучної вентиляції легень (ШВЛ) та на тривалість перебування пацієнтів у ВІТ.
Матеріали та методи
Із травня 2018 року по травень 2019 року ми провели проспективне когортне одноцентрове дослідження на клінічній базі кафедри анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького (відділення анестезіології з ліжками інтенсивної терапії Львівської обласної дитячої клінічної лікарні «ОХМАТДИТ») серед пацієнтів віком від 1 міс. до 3 років. Протокол висновку біоетичної комісії Львівського національного медичного університету імені Данила Галицького № 1 від 30.01.2018 року. Клінічні дані, що публікуються в даній статті, є частиною результатів клінічного дослідження Diaphragm ultrasound and trends in electrolyte disorders and transthyretin level as a method to predict ventilation outcome in children: the prospective observational cohort study; ISRCTN84734652; https://doi.org/10.1186/ISRCTN84734652.
Критеріями включення в дослідження були: вік 1 міс. — 3 роки, клінічні та лабораторні ознаки гострої дихальної недостатності (незалежно від її причини), що потребувала проведення інвазивної конвекційної ШВЛ (через інтубаційну трубку). Критеріями виключення з дослідження були: відмова законних представників пацієнта брати участь у дослідженні, повторне надходження пацієнта у ВІТ (пацієнти могли бути включені в дослідження лише один раз), термінальний стан пацієнта при надходженні, що впродовж однієї доби закінчився летально. Рівень кальцію та магнію сироватки крові оцінювали в 1-шу (d1), 3-тю (d3), 5-ту (d5), 7-му та 9-ту добу (d7 та d9). Рівень магнію сироватки крові визначали спектрофотометрично відповідно до інструкції для реагентів. Рівень іонізованого кальцію сироватки крові визначали за допомогою аналізатора показників кислотно-лужної рівноваги, лактату й електролітів плазми крові OPTI CCA-TS Blood Gas and Electrolite Analyser.
Статистичну обробку результатів дослідження проводили за допомогою MS Exсel 2017 з розрахунком середнього значення, стандартного відхилення, медіани.
Включення пацієнтів у дослідження (рис. 1) відбувалося так: упродовж часу дослідження у відділення було прийнято 57 пацієнтів із гострою дихальною недостатністю, у 3 із них рівень кальцію та магнію не моніторували. Таким чином, до дослідження були включені 54 пацієнти. Серед включених до дослідження пацієнтів було виявлено такі комбінації електролітних порушень: гіпокальціємію та гіпомагніємію при надходженні на лікування виявили у 12 пацієнтів, нормокальціємію та гіпомагніємію — у 26, нормокальціємію та нормомагніємію — у 16. Не було виявлено пацієнтів із гіперкальціємією та/або гіпермагніємією.
Традиційні, пропоновані нами в клініці інтервенції під час дослідження. При виявленні в хворих лабораторних ознак гіпомагніємії нижче 0,8 ммоль/л пацієнтам додавали до лікування магнію сульфат 25% із розрахунку 50 мг/кг/добу та в подальшому проводили корекцію дозування в бік його нарощення для того, щоб досягти в пацієнтів рівня магнію сироватки крові понад 0,8 ммоль/л. Після досягнення цього рівня пацієнтам до моменту відновлення понад 75 % належного об’єму ентерального харчування продовжували введення 50 мг/кг/добу магнію сульфату 25%.
При виявленні в пацієнта лабораторних ознак гіпокальціємії нижче 1,1 ммоль/л приймали рішення додати до лікування кальцію глюконат 10% із розрахунку 1 мл/кг/добу (еквівалентно 0,23 ммоль/кг/добу). Після досягнення нормокальціємії дозування знижували до 0,5 мл/кг/добу, яке залишали до моменту відновлення понад 75 % належного об’єму ентерального харчування.
Результати
Основними причинами гострої дихальної недостатності в дітей, включених у дослідження, були: гостра серцева недостатність — у 2 пацієнтів (3,7 % від загальної кількості пацієнтів у дослідженні), сепсис — у 5 (9,3 %), септичний шок — у 11 (20,4 %), енцефалопатія — у 4 (7,4 %), пневмонія — у 36 (66,7 %), гострий обструктивний бронхіт/бронхіоліт/бронхіальна астма — у 6 (11,1 %), бронхолегенева дисплазія — у 2 (3,7 % відповідно) (табл. 1). Середній вік пацієнтів був 9,6 ± 6,5 міс. До дослідження увійшли 28 хлопчиків та 26 дівчаток. Індекс маси тіла пацієнтів становив 13,2 ± 2,5 кг/м2.
Для оцінювання динаміки рівня магнію та іонізованого кальцію в пацієнтів із гострою дихальною недостатністю ми розподілили пацієнтів на такі групи: група пацієнтів із нормомагніємією (n = 16, 29,6 % від усіх включених у дослідження пацієнтів) та група пацієнтів із гіпомагніємією (n = 38, 70,4 % від усіх включених у дослідження пацієнтів), а також для аналізу показників ми виділили групу пацієнтів із нормокальціємією (n = 42, 77,8 % від усіх включених у дослідження пацієнтів) та групу пацієнтів із гіпокальціємією (n = 12, 22,2 % від усіх включених у дослідження пацієнтів).
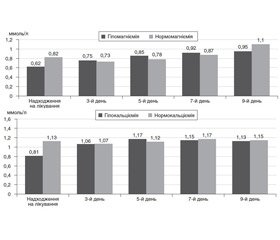
Ми проаналізували динаміку рівня магнію в пацієнтів із гострою дихальною недостатністю, включених у дослідження (рис. 2).
У пацієнтів, які при надходженні на лікування мали нормальний рівень магнію (n = 16, рівень магнію становив 0,82 ± 0,06 ммоль/л), спостерігалося його зниження впродовж перших 3 днів лікування до 0,73 ± 0,08 ммоль/л, що потребувало корекції відповідно до описаного нами вище алгоритму інтервенцій. У подальшому він поступово зростав і на 9-ту добу лікування становив 1,10 ± 0,15 ммоль/л. Серед дітей, які при надходженні на лікування мали помірну гіпомагніємію й отримували коригуючу терапію розчином магнію сульфату (n = 38, рівень магнію становить 0,62 ± 0,11 ммоль/л), рівень магнію нормалізувався на етапі дослідження d5 і становив 0,85 ± 0,07 ммоль/л, на етапах дослідження d7 та d9 — 0,92 ± 0,11 та 0,95 ± 0,14 ммоль/л відповідно.
Крім того, наводимо цікаву динаміку рівня іонізованого кальцію в сироватці крові в пацієнтів із гострою дихальною недостатністю (рис. 3). При надходженні на лікування рівень іонізованого кальцію в групі пацієнтів із нормокальціємією (n = 42) становив 1,13 ± 0,04 ммоль/л, дещо знижувався до етапу дослідження d3 і становив 1,07 ± 0,02 ммоль/л, перебував у межах нормальних референтних значень упродовж подальшого лікування пацієнтів. У даній групі пацієнтів корекція рівня кальцію сироватки крові не проводилася. Однак у групі гіпокальціємії (n = 12) рівень іонізованого кальцію при надходженні на лікування становив 0,81 ± 0,08 ммоль/л, що потребувало проведення корекції відповідно до описаного алгоритму інтервенції. Як результат рівень іонізованого кальцію зростав на етапі дослідження d3 до 1,07 ± 0,03 ммоль/л та нормалізувався з етапу дослідження d5 і становив 1,17 ± 0,08 ммоль/л.
Обговорення
Магній — четвертий за поширеністю катіон в організмі людини. Поширеність його дефіциту є загальною та все ще недостатньо діагностованою проблемою серед пацієнтів ВІТ. Дефіцит магнію виявляють у понад 50 % пацієнтів ВІТ [1]. При гіпомагніємії тривалість перебування пацієнта на ШВЛ та у ВІТ подовжується, зростає рівень летальності. Типовими причинами зниження рівня магнію сироватки крові є втрати з шлунково-кишкового тракту та із сечею, водночас мальнутриція та знижене споживання магнію також призводять до його дефіциту.
У табл. 2 наведений належний рівень надходження кальцію та магнію для дітей, що необхідні для забезпечення оптимального росту та мінералізації кісток (сильна рекомендація в ESPGHAN/ESPEN/ESPR/CSPEN Guidelines on pediatric parenteral nutrition, 2018) [9].
У нашому дослідженні частота поширеності гіпомагніємії серед пацієнтів віком 1–3 роки з гострою дихальною недостатністю становила 70,4 %. І хоча в більшості публікацій вказують на вірогідно вищий рівень летальності серед пацієнтів із гіпомагніємією [1, 4, 7, 8], у нашому дослідженні не було виявлено відмінностей у рівні летальності серед пацієнтів із гіпомагніємією (померли 9 пацієнтів із 38, рівень летальності — 23,7 %) порівняно з летальністю пацієнтів із нормальним рівнем магнію в сироватці крові (померли 4 пацієнти з 16, рівень летальності — 25 %), p = 0,27. Крім того, при виявленні пацієнтів із гіпомагніємією необхідно брати до уваги фактори ризику розвитку цього порушення. Ці фактори ризику включають у дорослих пацієнтів погано контрольований діабет ІІ типу, вживання алкоголю, тяжку діарею і стеаторею, застосування певних груп медикаментів (таких як діуретики та аміноглікозиди), сепсис. Серед наших пацієнтів найчастішими факторами ризику були застосування діуретиків, сепсис й антибіотик-асоційована діарея. 39,5 % з усіх пацієнтів із гіпомагніємією при надходженні (15 пацієнтів із 38) упродовж перших 3–5 діб отримували петлеві діуретики для досягнення нульового гідробалансу, що було беззаперечним фактором ризику розвитку гіпомагніємії, особливо коли ця ситуація поєднується з наявністю в них сепсису. Відомо, що маніфестація дефіциту магнію включає гіпокаліємію, гіпокальціємію, підвищену нейром’язову збудливість, виснаження дихальних м’язів та аритмії. Серед наших пацієнтів поєднання гіпомагніємії з гіпокальціємією зустрічалося у 12 пацієнтів із 54 дітей, які включені до дослідження, що становило 22,2 % для цієї когорти, та у 31,6 % пацієнтів із гіпомагніємією (у 12 пацієнтів із 38), що підтверджує вищу частоту виникнення гіпокальціємії при наявній гіпомагніємії.
Ми не виявили відмінностей у тривалості ШВЛ серед пацієнтів із гіпомагніємією та нормомагніємією (12,3 ± 1,8 доби порівняно з 14,1 ± 1,1 доби відповідно, p = 0,43). Також не було виявлено вірогідних змін у тривалості ШВЛ серед пацієнтів із гіпокальціємією і нормокальціємією. Проте тривалість перебування у ВІТ була в 1,47 раза довшою (95% ДІ 1,2–1,9, p = 0,04) серед пацієнтів із гіпомагніємією при надходженні на лікування порівняно з пацієнтами з нормомагніємією.
Автори багатьох публікацій відмічають, що суплементація препаратів магнію суттєво впливає на рівень летальності серед пацієнтів із гіпомагніємією [1, 2, 5, 6]. У нашому дослідженні всі пацієнти впродовж 1–2 діб із моменту верифікації гіпомагніємії починали отримувати магнію сульфат для корекції гіпомагніємії, що, ймовірно, і може пояснити відсутність різниці в рівнях летальності серед пацієнтів із гіпомагніємією та нормомагніємією.
Висновки
У дітей із гострою дихальною недостатністю частота виявлення гіпомагніємії при надходженні на лікування становила 70,4 % (38 пацієнтів), частота виявлення гіпокальціємії — 22,2 % (12 пацієнтів). Поєднання гіпомагніємії та гіпокальціємії спостерігалося у 22,2 % (12 пацієнтів). Чинниками, асоційованими з розвитком гіпомагніємії в дітей із гострою дихальною недостатністю, включених у дослідження, можуть бути застосування петлевих діуретиків та сепсис. Не було виявлено відмінностей у тривалості ШВЛ серед пацієнтів із гіпомагніємією та нормомагніємією, а також серед пацієнтів із гіпокальціємією і нормокальціємією. Проте тривалість перебування у ВІТ серед пацієнтів із гіпомагніємією була в 1,47 раза довшою (95% ДІ 1,2–1,9, p = 0,04) порівняно з пацієнтами з нормомагніємією.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Seyed Ali Javad Mousavi, Saeed Salimi, Mahdi Rezai. Serum Magnesium Level Impact on the Outcome of Patients Admitted to the Intensive Care Unit. Tanaffos Journal. 2010. 9(4). Р. 28-33. http://www.tanaffosjournal.ir/en/archive.php?lrid=240.
2. Baek Sung-Jin, Byeon Jung Hye, Eun So-Hee, Eun Baik-Lin, Kim Gun-Ha. Risk of low serum levels of ionized magnesium in children with febrile seizure. BMC Pediatrics. 2018. 18. Р. 297-303. https://doi.org/10.1186/s12887-018-1271-z.
3. Blaine J., Chonchol M., Levi M. Renal control of calcium, phosphate, and magnesium homeostasis. Clin. J. Am. Soc. Nephrol. 2015. 10(7). Р. 1257-72. doi: 10.2215/CJN.09750913.
4. Won Hee Kim, Yoon Ha Kim, Yuna An, Jong Ho Moon, Eun Ji Noh, Jong Woon Kim. Total and ionized serum magnesium and calcium levels during magnesium sulfate administration for preterm labor. Obstet. Gynecol. Sci. 2018. 61(1). Р. 56-62. https://doi.org/10.5468/ogs.2018.61.1.56.
5. Kulpmann W.R., Gerlach M. Relationship between ionized and total magnesium in serum. Scand. J. Clin. Lab. Invest. Suppl. 1996. 224. Р. 251-8. PMID: 8865441.
6. Ahmed El Beleidy, Seham Awad El Sherbini, Hebat Allah Fadel Elgebaly, Arwa Ahmed. Calcium, magnesium and phosphorus deficiency in critically ill children. Egyptian Pediatric Association Gazette. 2017. 65(2). Р. 60-64. https://doi.org/10.1016/j.epag.2017.03.004.
7. Rianne B., Koekkoek Kristine W.A.C., Arthur van Zanten R.H. Refeeding syndrome: relevance for the critically ill patient. Current Opinion in Critical Care. 2018. 24(4). Р. 235-240. doi: 10.1097/MCC.0000000000000514.
8. Rigo J., Mohamed M.W., De Curtis M. Disorders of calcium, phosphorus and magnesium / Martin R.J., Fanaroff A.A., Walsh M.C., editors. Fanaroff and Martin neonatal-perinatal medicine. 9th ed. St. Louis: Elsevier Mosby, 2011. Р. 1523e55.
9. Mihatsch W. et al. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Calcium, phosphorus and magnesium. Clinical Nutrition. 2018. https://doi.org/10.1016/j.clnu.2018.06.950.

/40-1.jpg)
/40-2.jpg)
/41-1.jpg)
/42-1.jpg)