Международный эндокринологический журнал Том 16, №2, 2020
Вернуться к номеру
Рівень вітаміну D у дітей з низькорослістю внаслідок затримки внутрішньоутробного розвитку на тлі нормосоматотропінемії
Авторы: Большова О.В.(1), Музь Н.М.(1), Кваченюк Д.А.(1), Ризничук М.О.(2)
(1) — ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
(2) — Вищий державний навчальний заклад України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
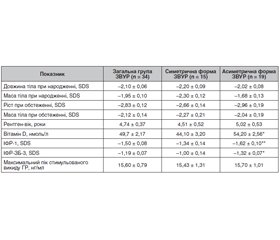
Актуальність. У популяції дітей препубертатного віку з затримкою внутрішньоутробного розвитку відсутні дані про статус вітаміну D через певний час після народження, вплив вітаміну D на вісь «гормон росту (ГР)/ростові фактори». Особливий інтерес викликає група пацієнтів, в яких зберігається суттєве відставання в рості на тлі зниження рівнів інсуліноподібного фактора росту 1 (ІФР-1) та нормального стимульованого викиду гормона росту. Метою дослідження стало визначення рівнів 25-гідроксикальциферолу (25(ОН)D) у плазмі крові дітей з низькорослістю внаслідок затримки внутрішньоутробного розвитку (ЗВУР) на тлі нормосоматотропінемії. Матеріали та методи. Обстежені 34 дитини (14 дівчаток і 20 хлопчиків) із затримкою росту (середній вік — 6,95 ± 0,46 року), які при народженні мали ознаки ЗВУР. Симетричний тип ЗВУР виявили у 15 (44,2 %) пацієнтів, асиметричний тип — у 19 (55,8 %) пацієнтів. За результатами функціональних тестів у всіх пацієнтів встановлено наявність нормального піку викиду ГР (> 10 нг/мл). Гормональне обстеження включало: визначення рівнів тиреотропного гормона, вільного тироксину (Т4) в плазмі крові імунорадіометричним методом за допомогою стандартних наборів Immunotech® kit (Чехія). На момент обстеження всі пацієнти перебували в стані еутиреозу. Рівні ГР, ІФР-1 та ІФР-ЗБ-3 у плазмі крові визначали методом твердофазного імуноферментного аналізу з використанням наборів Immulіte 2000 ХРі (Siemens, США). Рівень 25(ОН)D у сироватці крові визначався імунохемілюмінесцентним методом (Abbott, США). Оцінку результатів здійснювали відповідно до рекомендацій Міжнародного товариства ендокринологів (2011). Результати. Встановлено, що у дітей препубертатного віку, народжених з ознаками ЗВУР, середній показник SDS росту на момент обстеження становив –2,83 ± 0,12. Суттєвої різниці між показниками росту та маси тіла пацієнтів із симетричною й асиметричною формою на момент обстеження не визначено (р > 0,05). Вміст вітаміну D у плазмі крові дітей з ознаками ЗВУР загалом по групі становив 49,70 ± 2,17 нмоль/л. Недостатність вітаміну D встановлено у 16 обстежених (47 %), а дефіцит вітаміну D — у 18 дітей (53 %). Не встановлено суттєвих відмінностей між показниками вітаміну D у дівчаток і хлопчиків з ознаками ЗВУР (51,79 ± 3,38 і 48,36 ± 2,86 нмоль/л відповідно, р > 0,05). SDS росту у групі пацієнтів з асиметричним типом ЗВУР слабко корелює (r = 0,38) з вмістом вітаміну D. Рівень вітаміну D вірогідно відрізнявся залежно від типу ЗВУР (з симетричною формою — 44,1 ± 3,2 нмоль/л, з асиметричною формою — 54,20 ± 2,56 нмоль/л, р < 0,05). SDS ІФР-1 у групі пацієнтів з асиметричним типом ЗВУР слабко корелював (r = 0,36) з вмістом вітаміну D. На тлі вірогідного зниження рівня ІФР-ЗБ-3 у дітей з асиметричною формою ЗВУР порівняно з показниками дітей із симетричною формою (–1,32 ± 0,07 та –1,00 ± 0,14 SDS відповідно, р < 0,05) спостерігали зниження рівнів ІФР-1 (–1,62 ± 0,10 та –1,34 ± 0,14 SDS відповідно, р = 0,05). Висновки. Пацієнти, які народилися з ознаками ЗВУР, навіть на тлі нормосоматотропінемії, можуть зберігати суттєвий дефіцит росту, різке зниження ІФР-1 та ІФР-ЗБ-3 протягом тривалого часу після народження. Отримані результати свідчать про наявність гіповітамінозу D у всіх пацієнтів препубертатного віку, які народилися з ознаками затримки внутрішньоутробного розвитку. Не встановлено кореляційного зв’язку між рівнем вітаміну D і максимальним піком стимульованого викиду гормона росту. Однак пацієнти з асиметричним типом ЗВУР мають слабку кореляцію (r = 0,36) між SDS ІФР-1 та вмістом вітаміну D, вірогідне зниження рівнів ІФР-1, ІФР-ЗБ-3, а також вітаміну D порівняно з його рівнем при симетричному типі ЗВУР. До переліку досліджень при обстеженні дітей з низькорослістю, які народилися з ознаками затримки внутрішньоутробного розвитку, рекомендовано включати визначення рівня вітаміну D у плазмі крові незалежно від типу захворювання та стану соматотропної функції.
Актуальность. В популяции детей допубертатного возраста с задержкой внутриутробного развития отсутствуют данные о статусе витамина D через некоторое время после рождения, влиянии витамина D на ось «гормон роста (ГР)/ростовые факторы». Особый интерес вызывает группа пациентов, которые сохраняют существенное отставание в росте на фоне снижения уровней инсулиноподобного фактора роста 1 (ИФР-1) и нормального стимулированного выброса гормона роста. Целью исследования стало определение уровней 25-гидроксикальциферола (25(ОН)D) в плазме крови детей с низкорослостью вследствие задержки внутриутробного развития (ЗВУР) на фоне нормосоматотропинемии. Материалы и методы. Обследованы 34 ребенка (14 девочек и 20 мальчиков) с задержкой роста (средний возраст — 6,95 ± 0,46 года), которые при рождении имели признаки ЗВУР. Симметричный тип ЗВУР обнаружили у 15 (44,2 %) пациентов, асимметричный тип — у 19 (55,8 %) пациентов. По результатам функциональных тестов у всех пациентов установлено наличие нормального пика выброса ГР (> 10 нг/мл). Гормональное обследование включало: определение уровней ТТГ, свободного тироксина (Т4) в плазме крови иммунорадиометрическим методом стандартными наборами Immunotech® kit (Чехия). На момент обследования все пациенты находились в состоянии эутиреоза. Уровни ГР, ИФР-1 и ИФР-ЗБ-3 в плазме крови определяли методом твердофазного иммуноферментного анализа с использованием наборов Immulіte 2000 ХРі (Siemens, США). Уровень 25-гидроксикальциферола в сыворотке крови определялся иммунохемилюминесцентным методом (Abbott, США). Оценку результатов осуществляли согласно рекомендациям Международного общества эндокринологов (2011). Результаты. Установлено, что у детей допубертатного возраста, рожденных с признаками ЗВУР, средний показатель SDS роста на момент обследования составил –2,83 ± 0,12. Существенной разницы между показателями роста и массы тела у пациентов с симметричной и асимметричной формой на момент обследования не наблюдалось (р > 0,05). Содержание витамина D в плазме крови детей с признаками задержки внутриутробного развития в целом по группе составило 49,70 ± 2,17 нмоль/л. Недостаточность витамина D установлена у 16 обследованных (47 %), а дефицит витамина D — у 18 детей (53 %). Не установлено существенных различий между показателями витамина D у девочек и мальчиков (51,79 ± 3,38 и 48,36 ± 2,86 нмоль/л соответственно, р > 0,05). SDS роста в группе пациентов с асимметричным типом ЗВУР слабо коррелирует (r = 0,38) с содержанием витамина D. Уровень витамина D достоверно отличался в зависимости от типа ЗВУР (с симметричной формой — 44,1 ± 3,2 нмоль/л, с асимметричной формой — 54,20 ± 2,56 нмоль/л, р < 0,05). SDS ИФР-1 в группе пациентов с асимметричным типом ЗВУР слабо коррелировал (r = 0,36) с содержанием витамина D. На фоне снижения уровня ИФР-ЗБ-3 у детей с асимметричной формой ЗВУР по сравнению с показателями детей с симметричной формой (–1,32 ± 0,07 и –1,00 ± 0,14 SDS соответственно, р < 0,05) наблюдали снижение уровней ИФР-1 (–1,62 ± 0,10 и –1,34 ± 0,14 SDS соответственно, р = 0,05). Выводы. Полученные результаты свидетельствуют о наличии гиповитаминоза D у всех пациентов допубертатного возраста, родившихся с признаками задержки внутриутробного развития. Не установлено корреляционной связи между уровнем витамина D и максимальным пиком стимулированного выброса гормона роста. Однако пациенты с асимметричным типом ЗВУР имеют слабую корреляцию (r = 0,36) между SDS ИФР-1 и содержанием витамина D, достоверное снижение уровней ИФР-1, ИФР-ЗБ-3, а также витамина D по сравнению с его уровнем при симметричном типе ЗВУР. В перечень исследований при обследовании детей с низкорослостью, родившихся с признаками задержки внутриутробного развития, рекомендуется включать определение уровня витамина D в плазме крови независимо от типа заболевания и состояния соматотропной функции.
Background. There are no data about the status of vitamin D and its effect on the growth hormone/growth factors axis in prepubertal children with intrauterine growth restriction (IGR). Of particular interest is a group of patients who remain significantly short on the background of a decrease in insulin-like growth factor 1 (IGF-1) levels and normal stimulated release of growth hormone (GH). The purpose of our study was to determine the levels of 25-hydroxycalciferol in the blood plasma of prepubertal children with short stature due to IGR on the background of normosomatotropinemia. Materials and methods. We examined 34 prepubertal children (14 girls and 20 boys) with short stature (average age — 6.95 ± 0.46 years) who had signs of IGR at birth. A symmetrical type of IGR was found in 15 (44.2 %) patients, an asymmetrical type — in 19 (55.8 %). According to the results of functional tests all patients had a normal GH peak release (> 10 ng/ml). Thyroid-stimulating hormone, free thyroxine levels in the blood plasma were determined by the immunoradiometric assay with standard Immunotech® kit (Czech Republic). At the time of examination, all patients were euthyroid. GH, IGF-1 and insulin-like growth factor binding protein 3 (IGFBP-3) levels were determined by enzyme-linked immunosorbent assay using Immulite 2000 Xi kits (Siemens, USA). 25-hydroxycalciferol level was determined by the immunochemiluminescent method (Abbott, USA). The results were evaluated according to the guidelines of the International Society of Endocrinology (2011). Results. It was found that in prepubertal children with IGR signs at birth, the average height standard deviation score (SDS) at the time of the examination was –2.83 ± 0.12. There were no significant differences between the height and body weight in patients with a symmetrical and an asymmetrical types of IGR at the time of examination (p > 0.05). Vitamin D content in the blood plasma of children with IGR signs was 49.70 ± 2.17 nmol/l in the whole group. Vitamin D insufficiency below 75 nmol/l was found in 16 (47 %) patients, and vitamin D deficiency below 50 nmol/l — in 18 (53 %). No significant differences were found between vitamin D values in girls and boys with signs of IGR (51.79 ± 3.38 nmol/l and 48.36 ± 2.86 nmol/l, respectively, p > 0.05). Height SDS in the group of patients with an asymmetrical type of IGR weakly correlates (r = 0.38) with vitamin D content. Vitamin D level significantly differed depending on IGR type (in a symmetrical type — 44.1 ± 3.2 nmol/l, in an asymmetrical type — 54.20 ± 2.56 nmol/l, p < 0.05). IGF-1 SDS in the group of patients with an asymmetrical type of IGR weakly correlated (r = 0.36) with vitamin D level. On the background of a significant decrease in IGFBP-3 content in children with an asymmetrical type of IGR compared to those with a symmetrical type (–1.32 ± 0.07 SDS and –1.00 ± 0.14 SDS, p < 0.05), there was a reduction in IGF-1 levels (–1.62 ± 0.10 SDS and –1.34 ± 0.14 SDS, p = 0.05). Conclusions. Patients born with signs of IGR, even against normosomatotropinemia, may still have significant growth deficit, a sharp decrease in IGF-1 and IGFBP-3 for a long time after birth. The results obtained indicate the presence of hypovitaminosis D in all prepubertal patients who were born with the signs of intrauterine growth restriction. No correlation was found between vitamin D level and the maximum peak of stimulated growth hormone release. However, patients with an asymmetrical type of IGR have a weak correlation (r = 0.36) between IGF-1 SDS and vitamin D content, a significant decrease in the content of IGF-1, IGFBP-3, as well as vitamin D compared to its level in a symmetrical type of IGR. It is recommended to include the determination of vitamin D level in the blood plasma irrespective of the type of disease and the state of somatotropic function in the list of studies for the examination of children with short stature who were born with signs of intrauterine growth restriction.
затримка внутрішньоутробного розвитку; діти препубертатного віку; гормон росту; нормосоматотропінемія; вітамін D; інсуліноподібний фактор росту 1
задержка внутриутробного развития; дети допубертатного возраста; гормон роста; нормосоматотропинемия; витамин D; инсулиноподобный фактор роста 1
intrauterine growth restriction; prepubertal children; growth hormone; normosomatotropinemia; vitamin D; insulin-like growth factor-1
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- González-Leal R., Martínez-Villanueva J., Argente J., Martos-Moreno G.Á. Influence of neonatal anthropometry on the comorbidities of the obese patient. An. Pediatr. (Barc.). 2019. № 90(6). Р. 362-369. doi: 10.1016/j.anpedi.2018.05.017.
- Renes J.S., van Doorn J., Hokken-Koelega A.C.S. Current Insights into the Role of the Growth Hormone-Insulin-Like Growth Factor System in Short Children Born Small for Gestational Age. Horm. Res. Paediatr. 2019. № 92. Р. 15-27. doi: 10.1159/000502739.
- Finken M.J.J., van der Steen M., Smeets C.C.J., Walenkamp M.J.E., de Bruin C., Hokken-Koelega A.C.S., Wit J.M. Children Born Small for Gestational Age: Differential Diagnosis, Molecular Genetic Evaluation, and Implications. Endocr. Rev. 2018. № 39(6). Р. 851-894. doi: 10.1210/er.2018-00083.
- Wang H., Xiao Y., Zhang L., Gao Q. Maternal early pregnancy vitamin D status in relation to low birth weight and small-for-gestational-age offspring. J. Steroid Biochem. Mol. Biol. 2018. № 175. Р. 146-150. doi: 10.1016/j.jsbmb.2017.09.010.
- Hu Z., Tang L., Xu H.L. Maternal Vitamin D Deficiency and the Risk of Small for Gestational Age: A Meta-analysis. Iran J. Public Health. 2018. № 47(12). Р. 1785-1795.
- Chen Y., Zhu B., Wu X., Li S. Association between maternal vitamin D deficiency and small for gestational age: evidence from a meta-analysis of prospective cohort studies. BMJ. Open. 2017. № 7(8). e016404. doi: 10.1136/bmjopen-2017-016404.
- Bi W.G., Nuyt A.M., Weiler H. Association Between Vitamin D Supplementation During Pregnancy and Offspring Growth, Morbidity, and Mortality: A Systematic Review and Meta-analysis. JAMA Pediatr. 2018. № 172(7). Р. 635-645. doi: 10.1001/jamapediatrics. 2018.0302.
- Leffelaar E.R., Vrijkotte T.G., van Eijsden M. Maternal early pregnancy vitamin D status in relation to fetal and neonatal growth: results of the multi-ethnic Amsterdam Born Children and their Development cohort. Br. J. Nutr. 2010. № 104(1). Р. 108-17. doi: 10.1017/S000711451000022X.
- Santamaria C., Bi W.G., Leduc L., Tabatabaei N. Prenatal vitamin D status and offspring's growth, adiposity and metabolic health: a systematic review and meta-analysis. Br. J. Nutr. 2018. № 119(3). Р. 310-319. doi: 10.1017/S0007114517003646.
- Bogazzi F., Rossi G., Lombardi M. Vitamin D status may contribute to serum insulin-like growth factor I concentrations in healthy subjects. J. Endocrinol. Invest. 2011. № 34(8). e200-3. doi: 10.3275/7228.
- Ciresi A., Giordano C. Vitamin D across growth hormone (GH) disorders: From GH deficiency to GH excess. Growth Horm. IGF Res. 2017. № 33. Р. 35-42. doi: 10.1016/j.ghir.2017.02.002.
- Esposito S., Leonardi A., Lanciotti L., Cofini M. Vitamin D and growth hormone in children: a review of the current scientific knowledge. J. Transl. Med. 2019. № 17(1). Р. 87. doi: 10.1186/s12967-019-1840-4.
- Greulich W.W., Pyle S.I. Radiographic Atlas of Skeletal Development of the Hand and Wrist. – 2nd ed. USA: Pyle Stanford University Press, 1959 (Year of the printing: 1993). 256 р.
- Tanner J.M., Davies P.S. Clinical longitudinal standards for height and height velocity for north American children. J. Pediatr. 1985. № 107(3). Р. 317-29. doi: 10.1016/s0022-3476(85)80501-1.
- Ranke M.B. Diagnosis of growth hormone deficiency and growth hormone stimulation tests. Diagnostics of endocrine function in Children and Adolescents. Basel, Karger. 2011. 4th ed. Р. 102-137.
- de Waal W.J., Hokken-Koelega A.C., Stijnen T., de Muinck Keizer-Schrama S.M., Drop S.L.; The Dutch Working Group on Growth Hormone. Endogenous and stimulated GH secretion, urinary GH excretion, and plasma IGF-I and IGF-II levels in prepubertal children with short stature after intrauterine growth retardation. Clin Endocrinol (Oxf). 1994. № 41(5). Р. 621-30. doi: 10.1111/j.1365-2265.1994.tb01828.x.
- Lo T.H., Wu T.Y., Li P.C., Ding D.C. Effect of Vitamin D supplementation during pregnancy on maternal and perinatal outcomes. Ci Ji Yi Xue Za Zhi. 2019. № 31(4). Р. 201-206. doi: 10.4103/tcmj.tcmj_32_19.
- Tao R.X., Meng D.H., Li J.J., Tong S.L. Current Recommended Vitamin D Prenatal Supplementation and Fetal Growth: Results from the China-Anhui Birth Cohort Study. J. Clin. Endocrinol. Metab. 2018. № 103(1). Р. 244-252. doi: 10.1210/jc.2017-00850.
- Esmeraldo C.U.P., Martins M.E.P., Maia E.R., Leite J.L.A. Vitamin D in Term Newborns: Relation with Maternal Concentrations and Birth weight. Ann. Nutr. Metab. 2019. № 75(1). Р. 39-46. doi: 10.1159/000502044.
- Delecroix C., Brauner R., Souberbielle J.C. Vitamin D in children with growth hormone deficiency due to pituitary stalk interruption syndrome. BMC Pediatr. 2018. № 18(1). Р. 11. doi: 10.1186/s12887-018-0992-3.
- Chowdhury R., Taneja S., Kvestad I. Vitamin D status in early childhood is not associated with cognitive development and linear growth at 6–9 years of age in North Indian children: a cohort study. Nutr. J. 2020. № 19(1). Р. 14. doi: 10.1186/s12937-020-00530-2.
- Ameri P., Giusti A., Boschetti M. Vitamin D increases circulating IGF1 in adults: potential implication for the treatment of GH deficiency Eur. J. Endocrinol. 2013. № 169(6). Р. 767-72. doi: 10.1530/EJE-13-0510.

/32.jpg)