Международный эндокринологический журнал Том 16, №2, 2020
Вернуться к номеру
Асоціативні зв’язки між рівнем вітаміну D, імунологічними характеристиками й об’ємом щитоподібної залози у хворих на гіпотиреоз унаслідок автоімунного тиреоїдиту
Авторы: Гончарова О.А.
Харківська медична академія післядипломної освіти, м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
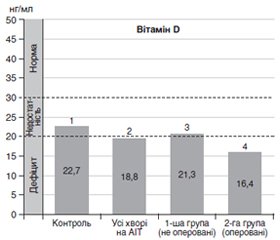
Актуальність. Провідним чинником гіпотиреозу у хворих на автоімунний тиреоїдит (АІТ) є деструкція щитоподібної залози (ЩЗ) під впливом автоімунного процесу. Тому суттю патогенетичної терапії АІТ вважається призначення імуномодуляторів. Розуміння особливостей автоімунних порушень при АІТ дасть змогу обґрунтувати вимоги до таких препаратів. Мета: встановити наявність можливих асоціативних зв’язків при гіпотиреозі внаслідок АІТ між об’ємом ЩЗ, рівнем вітаміну D та імунологічними показниками. Матеріали та методи. Проведено порівняльний аналіз тиреоїдного статусу за рівнями тиреотропного гормону й вільного тироксину, вмістом вітаміну D у крові й показниками імунного гомеостазу (CD3, CD4, CD8, CD16, CD22, антитіла до тиреоїдної пероксидази й тиреоглобуліну) у 55 жінок із медикаментозно компенсованим гіпотиреозом унаслідок АІТ. Першу групу становили 29 жінок з АІТ, які не менше ніж рік отримували індивідуально підібрану замісну тиреоїдну терапію, з об’ємом ЩЗ 11,05 ± 1,86 см3. Другу групу сформували 26 жінок, не менше ніж рік тому прооперованих із приводу доброякісних вузлових утворень у ЩЗ на тлі АІТ, з об’ємом ЩЗ 4,26 ± 1,89 см3 (р < 0,05 між групами). Контрольну групу становили 12 жінок без АІТ і гіпотиреозу, об’єм ЩЗ 8,7 ± 0,6 см3. Результати. Показники тиреоїдного статусу в усіх хворих на гіпотиреоз унаслідок АІТ перебували в межах референсних норм. Уміст вітаміну D у загальній групі жінок з АІТ і гіпотиреозом був вірогідно (р < 0,02) нижчим, ніж у контрольній групі, при тому що в контролі він відповідав статусу недостатності (22,7 нг/мл), а на тлі АІТ — дефіциту вітаміну D (18,3 нг/мл). У хворих із меншим об’ємом ЩЗ (друга група) рівень вітаміну D був вірогідно (р < 0,05) нижче, ніж у першій групі. Показники клітинного імунітету були в межах референсних норм, але при цьому рівень натуральних кілерів у другій групі був вірогідно (р < 0,05) нижчим. Рівні антитиреоїдних антитіл в обох групах були високими, що свідчило про активність автоімунного процесу. Висновки. У пацієнток з гіпотиреозом на тлі автоімунного тиреоїдиту в стані медикаментозної компенсації менші розміри щитоподібної залози асоціюються з більш вираженим дефіцитом вітаміну D. Розміри щитоподібної залози в пацієнток з автоімунним тиреоїдитом не асоціюються з вираженими змінами показників клітинного імунітету, крім зниження рівня натуральних кілерів на тлі меншого об’єму ЩЗ. Стійка активність автоімунного процесу в пацієнток із гіпотиреозом унаслідок автоімунного тиреоїдиту на тлі тривалої та успішної замісної тиреоїдної терапії обумовлює необхідність підключення до неї адекватних імуномодуляторів, у тому числі вітаміну D.
Актуальность. Ведущим фактором гипотиреоза у больных аутоиммунным тиреоидитом (АИТ) является деструкция щитовидной железы (ЩЖ) под влиянием аутоиммунного процесса. Поэтому сущностью патогенетической терапии АИТ считается назначение иммуномодуляторов. Понимание особенностей аутоиммунных нарушений при АИТ позволит обосновать требования к таким препаратам. Цель: установить наличие возможных ассоциативных связей при гипотиреозе вследствие АИТ между объемом ЩЖ, уровнем витамина D и иммунологическими показателями. Материалы и методы. Проведен сравнительный анализ тиреоидного статуса по уровням тиреотропного гормона и свободного тироксина, уровня витамина D в крови и показателей иммунного гомеостаза (CD3, CD4, CD8, CD16, CD22, антитела к тиреоидной пероксидазе и тиреоглобулину) у 55 женщин с медикаментозно компенсированным гипотиреозом вследствие АИТ. Первую группу составили 29 женщин с АИТ, не менее года получающих индивидуально подобранную заместительную терапию препаратами левотироксина, с объемом ЩЖ 11,05 ± 1,86 см3, вторую группу — 26 женщин, не менее года назад прооперированных по поводу доброкачественных узловых образований в ЩЖ на фоне АИТ, с объемом ЩЖ 4,26 ± 1,89 см3 (р < 0,05 между группами). Контрольную группу составили 12 женщин без АИТ и гипотиреоза, объем ЩЖ 8,7 ± 0,6 см3. Результаты. Показатели тиреоидного статуса у больных АИТ находились в пределах референсных норм, однако уровень витамина D в общей группе женщин с АИТ и гипотиреозом был достоверно (р < 0,02) ниже, чем в контрольной группе. В контрольной группе он соответствовал статусу недостаточности (22,7 нг/мл), а на фоне АИТ — дефицита витамина D (18,3 нг/мл). У больных с меньшим объемом ЩЖ (вторая группа) уровень витамина D был достоверно (р < 0,05 ) ниже, чем в первой группе. Показатели клеточного иммунитета были в пределах референсных норм, но при этом уровень натуральных киллеров во второй группе был достоверно (р < 0,05) ниже. Уровни антитиреоидных антител в обеих группах были высокими, что свидетельствовало об активности аутоиммунного процесса. Выводы. У пациенток с гипотиреозом на фоне АИТ в состоянии медикаментозной компенсации меньшие размеры ЩЖ ассоциируются с более выраженным дефицитом витамина D. Размеры ЩЖ у пациенток с АИТ не ассоциируются с выраженными изменениями показателей клеточного иммунитета, кроме снижения уровня натуральных киллеров при меньшем объеме ЩЖ. Стойкая активность аутоиммунного процесса у пациенток с гипотиреозом вследствие АИТ на фоне длительной и успешной заместительной терапии препаратами левотироксина обусловливает необходимость подключения к ней адекватных иммуномодуляторов, в том числе витамина D.
Background. The leading factor of hypothyroidism in patients with autoimmune thyroiditis is destruction of the thyroid gland under the influence of the autoimmune process. Therefore, the essence of pathogenetic therapy for autoimmune thyroiditis is the prescription of immunomodulators. Understanding the features of autoimmune disorders in autoimmune thyroiditis will allow justifying the requirements for such drugs. Aim: to determine if there is an association between thyroid volume, vitamin D level, and immunological parameters in hypothyroidism due to autoimmune thyroiditis. Materials and methods. A comparative analysis of thyroid status in terms of thyroid-stimulating hormone and free thyroxine content, blood vitamin D levels and immune homeostasis indicators (CD3, CD4, CD8, CD16, CD22, thyroid peroxidase antibodies and thyroglobulin antibodies) was performed in 55 women with drug-compensated hypothyroidism due to autoimmune thyroiditis. The first group consisted of 29 women with autoimmune thyroiditis who for at least one year received individually selected thyroid replacement therapy, with thyroid volume of 11.05 ± 1.86 cm3, the second group — of 26 women, at least a year ago operated for benign thyroid nodules against the background of autoimmune thyroiditis, with thyroid volume of 4.26 ± 1.89 cm3 (p < 0.05 between groups). The control group included 12 women without autoimmune thyroiditis and hypothyroidism, thyroid volume was 8.7 ± 0.6 cm3. Results. While the thyroid status indicators in autoimmune thyroiditis patients were within the reference norms, the vitamin D level in the general group of women with autoimmune thyroiditis and hypothyroidism was significantly (p < 0.02) lower than in the control group, despite the fact that in the control group it corresponded to deficiency status (22.7 ng/ml), and against the background of autoimmune thyroiditis — to vitamin D deficiency (18.3 ng/ml). In patients with a smaller thyroid volume (group 2), the content of vitamin D was significantly (p < 0.05) lower than in group 1. Indicators of cellular immunity were within the reference standards, but the level of natural killers in group 2 was significantly (p < 0.05) lower. The levels of antithyroid antibodies in both groups were high, indicating the activity of the autoimmune process. Conclusions. In patients with hypothyroidism on the background of autoimmune thyroiditis in a state of drug compensation, smaller thyroid glands are associated with a more pronounced vitamin D deficiency. Thyroid volumes in patients with autoimmune thyroiditis are not associated with pronounced changes in cellular immunity, except for a decrease in the level of natural killers in smaller thyroid volume. The persistent activity of the autoimmune process in patients with hypothyroidism due to autoimmune thyroiditis against the background of prolonged and successful thyroid replacement therapy necessitates the addition of adequate immunomodulators to it, including vitamin D.
автоімунний тиреоїдит; гіпотиреоз; вітамін D; об’єм щитоподібної залози; клітинний і гуморальний імунітет
аутоиммунный тиреоидит; гипотиреоз; витамин D; объем щитовидной железы; клеточный и гуморальный иммунитет
autoimmune thyroiditis; hypothyroidism; vitamin D; thyroid volume; cellular and humoral immunity
Вступ
Матеріали та методи
Результати
/39_2.jpg)
Обговорення
Висновки
- Rydzewska M., Jaromin M., Pasierowska I.E., Stożek K., Bossowski A. Role of the T and B lymphocytes in pathogenesis of autoimmune thyroid diseases. Thyroid Research. 2018. 2. 11. URL: https://doi.org/10.1186/s13044-018-0046-9.
- Prietl B., Treiber G., Pieber T.R., Amrein K. Vitamin D and immune function. Nutrients. 2013. 5. 2502-2521.
- Baeke F., Takiishi T., Korf H., Gysemans C., Mathieu C. Vitamin D: Modulator of the immune system. Curr. Opin. Pharmacol. 2010. 10. 482-496.
- Kim D. The Role of Vitamin D in Thyroid Diseases. Int. J. Mol. Sci. 2017. 18(9). E.1949. doi: 10.3390.
- D’Aurizio F., Villalta D., Metus P., Doretto P., Tozzoli R. Is vitamin D a player or not in the pathophysiology of autoimmune thyroid diseases? Autoimmun. Rev. 2015. 14. 363-369.
- Hewison M. An update on vitamin D and human immunity. Clin. Endocrinol. 2012. 76. 315-325.
- Evliyaoğlu O., Acar M., Özcabı B., Erginöz E., Bucak F., Ercan O., Kucur M. Vitamin D Deficiency and Hashimoto’s Thyroiditis in Children and Adolescents: a Critical Vitamin D Level for This Association? J. Clin. Res Pediatr. Endocrinol. 2015. 7(2). 128-33. doi: 10.4274.
- Talaei A., Ghorbani F., Asemi Z. The Effects of Vitamin D Supplementation on Thyroid Function in Hypothyroid Patients: A Randomized, Double-blind, Placebo-controlled Trial. Indian J. Endocrinol. Metab. 2018. 22(5). 584-588. doi: 10.4103.
- Kim D. Low vitamin D status is associated with hypothyroid Hashimoto’s thyroiditis. Hormones (Athens). 2016. 15(3). 385-393. doi: 10.14310.
- Pankiv V., Pankiv I. Association of vitamin D status with body mass index in adolescents in Ukraine. Romanian Journal of Diabetes, Nutrition and Metabolic Diseases. 2018. 25(4). 377-381.
- Ke W., Sun T., Zhang Y., He L., Wu Q., Liu J., Zha B. 25-Hydroxyvitamin D serum level in Hashimoto’s thyroiditis, but not Graves’ disease is relatively deficient. Endocr. J. 2017. 64(6). 581-587. doi.org/10.1507/endocrj.EJ16-0547.
- Bozkurt N.C., Karbek B., Ucan B., Sahin M., Cakal E., Ozbek M., Delibasi T. The association between severity of vitamin D deficiency and Hashimoto’s thyroiditis. Endocr. Pract. 2013. 19. 479-484.
- Yasuda T., Okamoto Y., Hamada N. et al. Serum vitamin D levels are decreased and associated with thyroid volume in female patients with newly onset Graves’ disease. Endocrine. 2012. 42. 739-741.
- Bizzaro G., Shoenfeld Y. Vitamin D and thyroid autoimmune diseases: The known and the obscure. Immunol. Res. 2015. 61. 107-109.
- D’Aurizio F., Villalta D., Metus P., Doretto P., Tozzoli R. Is vitamin D a player or not in the pathophysiology of autoimmune thyroid diseases? Autoimmunity reviews. 2015. 14(5). 363-369.
- Holick M.F. The D-batable Institute of Medicine report: a D-lightful perspective. Endocrine Practice. 2011. 17(1). 143-149.
- Pankiv I.V. The effect of vitamin D supplementation on insulin resistance and arterial stiffness in patients with hypothyroidism. Міжнародний ендокринологічний журнал. 2018. 14(7). 36-40. DOI: 10.22141/2224-0721.14.7.2018.148774.
- Hosny S.S., Aboromia M.M.M., Ibrahim N.A., El Halim D.K.A. The relationship between vitamin D level and thyroid antibodies in primary hypothyroidism. The Egyptian Journal of Internal Medicine. 2019. 31(2). 164-170. DOI: 10.4103/ejim.ejim_104_18.
- Mazokopakis E.E., Kotsiris D.A. Hashimoto’s autoimmune thyroiditis and vitamin D deficiency. Current aspects. Hell. J. Nucl. Med. 2014. 17(1). 37-40. doi: 10.1967/s002449910120.
- Effraimidis G., Badenhoop K., Tijssen J.G., Wiersinga W.M. Vitamin D deficiency is not associated with early stages of thyroid autoimmunity. Eur. J. Endocrinol. 2012. 167(1). 43-48. doi: 10.1530/EJE-12-0048.
- Yasmeh J., Farpour F., Rizzo V., Kheradnam S., Sachmechi I. Hashimoto thyroiditis not associated with vitamin D deficiency. Endocr Pract. 2016. 22(7). 809-813. doi: 10.4158/EP15934.
- Goldsmith D.J.A. Should we correct vitamin D deficiency/insufficiency in chronic kidney disease patients with inactive forms of vitamin D or just treat them with active vitamin D forms? Nephrology Dialysis Transplantation. 2016. 31(5). 698-705. doi.org/10.1093/ndt/gfw082.
- Bakr H.G., Meawed T.E. Relevance of 25(OH) Vitamin D deficiency on Hashimoto’s Thyroiditis. Egypt J. Immunol. 2017. 24(2). 53-62.
- Sassi F., Tamone C., D’Amelio P. Vitamin D: Nutrient, Hormone, and Immunomodulator. Nutrients. 2018. 10(11). E1656. doi: 10.3390/nu10111656.
- Mandal A., Viswanathan C. Natural killers: In health and disease. Hematol. Oncol. Stem Cell Ther. 2015. 8. 47-55.
- Popko K., Górska E. The role of natural killer cells in pathogenesis of autoimmune diseases. Cent. Eur. J. Immunol. 2015. 40(4). 470-476. doi: 10.5114/ceji.2015.56971.
- Fogel L., Yokoyama W.M., French A.R. Natural killer cells in human autoimmune disorders. Arthitis Res Ther. 2013. 15. 216-224.
- Lee E.K., Sunwoo J.B. Natural Killer Cells and Thyroid Diseases. Endocrinol. Metab. (Seoul). 2019. 34(2). 132-137. doi: 10.3803/EnM.2019.34.2.132.

/39.jpg)
/39_3.jpg)