Международный эндокринологический журнал Том 16, №2, 2020
Вернуться к номеру
Клініко-патогенетична значущість коморбідного остеодефіциту при цукровому діабеті в жінок у період менопаузи
Авторы: Синяченко О.В., Єрмолаєва М.В., Морозюк Д.М., Верзілов С.М.
Донецький національний медичний університет, м. Лиман, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
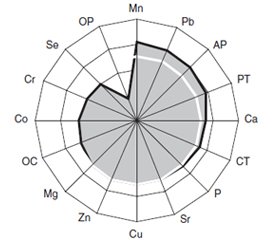
Актуальність. Остеодефіцит (ОД) є серйозною проблемою через високу захворюваність, смертність та значні витрати на медичне обслуговування, причому в жінок у менопаузальному періоді ламкість кісток унаслідок остеопорозу більше виражена, а остеопоротичні переломи хребта трапляються втричі частіше, ніж у чоловіків. З ОД тісно пов’язаний цукровий діабет (ЦД) 2-го типу, а деякі гормональні й пептидні маркери кісткового метаболізму одночасно визначають мінералізацію кісток і стан вуглеводного обміну. Мета дослідження: оцінити перебіг ЦД у жінок у період менопаузи та вивчити клініко-патогенетичний зв’язок із наявністю в них ОД. Матеріали та методи. Обстежених жінок (n = 261) розподілили на дві групи — 17 % із ЦД (основна) і 83 % без ЦД (група порівняння). У 51 % випадків діагностований ОД (співвідношення остеопенії та остеопорозу — 4 : 1). Дослідження вуглеводного обміну включало визначення показників інсулінорезистентності НОМА та тяжкості метаболічного синдрому, рівнів у крові інсуліну, глюкози, глікованого гемоглобіну й С-пептиду, а маркерами кісткового метаболізму були рівні в крові паратгормону, кальцитоніну, остеокальцину, остеопонтину, активності лужної фосфатази, остеоасоційованих хімічних елементів (Ca, P, Mg, Co, Cr, Cu, Mn, Pb, Se, Sr, Zn). Результати. ЦД діагностований у 34 % жінок з ОД, що прямо співвідноситься з їх віком, частотою й вираженістю інших ознак метаболічного синдрому (гіперінсулінемія, гіперліпідемія, гіперурикемія, артеріальна гіпертензія, ожиріння), відсутністю випадків нормоліпідемії і ІІА типу порушень ліпідного обміну, але превалюванням ІІВ типу, більш високим показником у крові активності лужної фосфатази й меншими значеннями остеопонтину та селену, причому тяжкість перебігу ЦД тісно пов’язана з параметрами мінеральної щільності кістки і рівнем фосфатемії, розвиток діабетичних ретинопатії, нефропатії й периферичної макро-/мікроангіопатії відповідно залежить від вмісту селену, цинку та остеопонтину, а показник кальцемії має прогностичну значущість. Висновки. Доведена патогенетична значущість коморбідного ОД, параметрів мінеральної щільності кістки і маркерів кісткового метаболізму в сироватці крові жінок у період менопаузи в розвитку ЦД, тяжкості його перебігу й ускладнень, а показники остеопонтину, кальцію, селену та цинку мають прогностичну значущість.
Актуальность. Остеодефицит (ОД) является серьезной проблемой из-за высокой заболеваемости, смертности и значительных затрат на медицинское обслуживание, причем у женщин в менопаузальном периоде ломкость костей вследствие остеопороза более выражена, а остеопоротические переломы позвоночника встречаются втрое чаще, чем у мужчин. С ОД тесно связан сахарный диабет (СД) 2-го типа, а некоторые гормональные и пептидные маркеры костного метаболизма одновременно определяют минерализацию костей и состояние углеводного обмена. Цель исследования: оценить течение СД у неменструирующих женщин и изучить клинико-патогенетическую связь с наличием у них ОД. Материалы и методы. Обследованных женщин (n = 261) распределили на две группы — 17 % из них с СД (основная) и 83 % без СД (группа сравнения). В 51 % случаев диагностирован ОД (соотношение остеопении и остеопороза — 4 : 1). Исследование углеводного обмена включало определение показателей инсулинорезистентности НОМА и тяжести метаболического синдрома, уровней в крови инсулина, глюкозы, гликозилированного гемоглобина и С-пептида, а маркерами костного метаболизма были параметры в крови паратгормона, кальцитонина, остеокальцина, остеопонтина, активности щелочной фосфатазы, остеоассоциированных химических элементов (Ca, P, Mg, Co, Cr, Cu, Mn, Pb, Se, Sr, Zn). Результаты. СД диагностирован у 34 % женщин с ОД в периоде менопаузы, что прямо соотносится с их возрастом, частотой и выраженностью других признаков метаболического синдрома (гиперинсулинемия, гиперлипидемия, гиперурикемия, артериальная гипертензия, ожирение), отсутствием случаев нормолипидемии и ІІА типа нарушений липидного обмена, но превалированием ІІВ типа, более высоким показателем в крови активности щелочной фосфатазы и меньшими значениями остеопонтина и селена, причем тяжесть течения СД тесно связана с параметрами минеральной плотности кости и уровнем фосфатемии, развитие диабетических ретинопатии, нефропатии и периферической макро- и микроангиопатии соответственно зависит от содержания селена, цинка и остеопонтина, а показатель кальцемии обладает прогностической значимостью. Выводы. Доказана патогенетическая значимость коморбидного ОД, параметров минеральной плотности кости и маркеров костного метаболизма в сыворотке крови женщин с отсутствием менструального цикла в развитии СД, тяжести его течения и осложнений, а показатели остеопонтина, кальция, селена и цинка обладают прогностической значимостью.
Background. Osteoporosis is a serious problem due to the high morbidity, mortality and significant costs for medical care. Moreover, in women in the menopausal period, bone fragility due to osteoporosis is more pronounced, and osteoporotic vertebral fractures are three times more common than in men. Type 2 diabetes mellitus (DM) is closely associated with osteoporosis, and some hormonal and peptide markers of bone metabolism simultaneously determine bone mineralization and the state of carbohydrate metabolism. The purpose was to assess the course of diabetes in women during menopause and to study the clinical and pathogenetic relationship with the presence of osteoporosis in them. Materials and methods. Two hundred and sixty-one women with menopause were examined. They were divided into two groups: 17 % with DM (main one) and 83 % without DM (comparison group). In 51 % of cases, osteoporosis was diagnosed (osteopenia and osteoporosis ratio was 4 : 1). The study of carbohydrate metabolism included the determination of insulin resistance HOMA index and the severity of metabolic syndrome, blood levels of insulin, glucose, glycosylated hemoglobin and C-peptide, and markers of bone metabolism were serum parameters of parathyroid hormone, calcitonin, osteocalcin, osteopontin, alkaline phosphatase activity, chemical elements (Ca, P, Mg, Co, Cr, Cu, Mn, Pb, Se, Sr, Zn). Results. DM was diagnosed in 34 % of women with osteoporosis, which directly correlates with their age, frequency and severity of other signs of metabolic syndrome (hyperinsulinemia, hyperlipidemia, hyperuricemia, arterial hypertension, obesity), the absence of cases of normal lipidemia and type IIA lipid metabolism disorders, but with the prevalence of type IIB, a higher rate of alkaline phosphatase activity in the blood and lower values of osteopontin and selenium. Besides, DM severity is closely related to the parameters of mineral bone density and phosphatemia level, and the development of diabetic retinopathy, nephropathy and peripheral macro-/microangiopathy, respectively, depends on the content of selenium, zinc and osteopontin, and the rate of calcemia has prognostic significance. Conclusions. The pathogenetic significance of comorbid osteoporosis, parameters of bone mineral density and markers of bone metabolism in the blood serum of women with menopause in the development of DM, the severity of its course and complications has been proven, and the indicators of osteopontin, calcium, selenium and zinc have prognostic significance.
цукровий діабет; жінки; остеодефіцит
диабет сахарный; женщины; остеодефицит
diabetes mellitus; women; osteoporosis
Вступ
Матеріали та методи
Результати
/54.jpg)
Обговорення
Висновки
- Kim H.J., Jang B.H., Kim M.J., Kim K.C., Kuon W.J., Kim C.K. Prevalence of and associations between metabolic syndrome and the constitutions defined by Korean eight constitution medicine. Medicine. 2020. 99(7). 19074. doi: 10.1097/MD.0000000000019074.
- Lozano-Cuenca J., Valencia-Hernández I., López-Canales O.A. et al. Possible mechanisms involved in the effect of the subchronic administration of rosuvastatin on endothelial function in rats with metabolic syndrome. Braz. J. Med. Biol. Res. 2020. 53(2). 9304. doi: 10.1590/1414-431X20199304.
- O’Donovan A.N., Herisson F.M., Fouhy F. et al. Gut microbiome of a porcine model of metabolic syndrome and HF-pEF. Am. J. Physiol. Heart Circ. Physiol. 2020. 7(2). 00512. doi: 10.1152/ajpheart.00512.2019.
- Li R.C., Zhang L., Luo H. et al. Subclinical hypothyroidism and anxiety may contribute to metabolic syndrome in Sichuan of China: a hospital-based population study. Sci. Rep. 2020. 10(1). 2261. doi: 10.1038/s41598-020-58973-w.
- Alberti K.G., Zimmet P., Shaw J. The metabolic syndrome — a new worldwide definition. Lancet. 2015. 366(9491). 1059-62. doi: 10.1016/S0140-6736(05)67402-8.
- Ford E.S. Prevalence of the metabolic syndrome defined by the international diabetes federation among adults in the U.S. Diabetes Care. 2015. 28(11). 2745-9. doi: 10.2337/diacare.28.11.2745.
- Hevener A.L., Ribas V., Moore T.M., Zhou Z. The impact of skeletal muscle ERα on mitochondrial function and metabolic health. Endocrinology. 2020. 161(2). 017. doi: 10.1210/endocr/bqz017.
- Seo Y.R., Kim J.S., Kim S.S., Jung J.G., Yoon S.J. Association between alcohol consumption and metabolic syndrome determined by facial flushing in Korean women. Korean J. Fam. Med. 2020. 14(2). 0141. doi: 10.4082/kjfm.19.0141.
- Eshaghi F.S., Ghazizadeh H., Kazami-Nooreini S. et al. Association of a genetic variant in AKT1 gene with features of the metabolic syndrome. Genes. Dis. 2019. 6(3). 290-5. doi: 10.1016/j.gendis.2019.03.002.
- Bhalwar R. Metabolic syndrome: The Indian public health perspective. Med. J. Armed Forces India. 2020. 76(1). 8-16. doi: 10.1016/j.mjafi.2019.12.001.
- Yang X., Luo W., Han S. et al. Prevalence of high-risk coronary plaques in patients with and without metabolic syndrome and the relationship with prognosis. BMC Cardiovasc. Disord. 2020. 20(1). 73-9. doi: 10.1186/s12872-020-01358-8.
- Kayal R.A., Tsatsas D., Bauer M.A. еt al. Diminished bone formation during diabetic fracture healing is related to the premature resorption of cartilage associated with increased osteoclast activity. J. Bone Miner. Res. 2007. 22(2). 560-8. doi: 10.1359/ jbmr.070115.
- Yamagishi S., Nakamura K., Inoue H. Possible participation of advanced glycation end products in the pathogenesis of osteoporosis in diabetic patients. Med. Hypotheses. 2015. 65. 1013-5. doi: 10.1016/j.mehy.2015.07.017.
- Huang W., Shu L., Zhao H., Chen S., Zhang H., Song G. Association of the triglyceride to high-density lipoprotein ratio and the visceral adiposity index with metabolic syndrome in diabetic susceptible population. Horm. Metab. Res. 2020. 52(2). 95-103. doi: 10.1055/a-1089-7991.
- Kaneko K., Yatsuya H., Li Y. еt al. Risk and population attributable fraction of metabolic syndrome and impaired fasting glucose for incidence of type 2 diabetes mellitus among middle-aged Japanese. J. Diabetes Investig. 2020. 5(2). 13230. doi: 10.1111/jdi.13230.
- Horikawa K., Kasai Y., Yamakawa T., Sudo A. Prevalence of osteoarthritis, osteoporotic vertebral fractures, and spondylolisthesis among the elderly in a Japanese village. J. Orthop. Surg. 2016. 14(1). 9-12.
- Chin K.Y., Ima-Nirwana S., Mohamed I.N. et al. Insulin-like growth factor-1 is a mediator of age-related decline of bone health status in men. Aging Male. 2014. 17(1). 102-6. doi: 10.3109/13685538.2014.896895.
- Mohan S., Baylink D.J. Impaired skeletal growth in mice with haploinsufficiency of IGF-I: Genetic evidence that differences in IGF-I expression could contribute to peak bone mineral density differences. J. Endocrinol. 2005. 185. 415-20. doi: 10.1677/joe.1.06141.
- Riquelme-Gallego B., García-Molina L., Cano-Ibáñez N. et al. Circulating undercarboxylated osteocalcin as estimator of cardiovascular and type 2 diabetes risk in metabolic syndrome patients. Sci Rep. 2020. 10(1). 1840. doi: 10.1038/s41598-020-58760-7.
- Seibel M.J. Biochemical markers of bone remodeling. Endocr. Metab. Clin. N. Am. 2013. 32(1). 83-113. doi: 10.1016/S0889-8529(02)00077-4.
- Zoch M.L., Clemens T.L., Riddle R.C. New insights into the biology of osteocalcin. Bone. 2016. 82(2). 42-9. doi: 10.1016/j.bone.2015.05.046.
- Lee N.K. Endocrine regulation of energy metabolism by the skeleton. Cell. 2007. 130. 456-69. doi: 10.1016/j.cell.2007.05.047.
- Kindblom J.M. Plasma osteocalcin is inversely related to fat mass and plasma glucose in elderly Swedish men. J. Bone Miner. Res. 2009. 242. 785-91. doi: 10.1359/jbmr.081234.
- De Pergola G. Independent relationship of osteocalcin circulating levels with obesity, type 2 diabetes, hypertension, and HDL cholesterol. Endocr. Metab. Imm. Disord. Drug Targets. 2016. 16. 270-5. doi: 10.2174/1871530317666170106150756.
- Garcia-Martin A. Osteocalcin as a marker of metabolic risk in healthy postmenopausal women. Menopause. 2011. 18(1). 537-41. doi: 10.1097/gme.0b013e3181f8565e.
- Bullo M., Moreno-Navarrete J.M., Fernandez-Real J.M., Salas-Salvado J. Total and undercarboxylated osteocalcin predict changes in insulin sensitivity and beta cell function in elderly men at high cardiovascular risk. Am. J. Clin. Nutr. 2012. 95. 249-55. doi: 10.3945/ajcn.111.016642.
- Kanazawa I. Serum osteocalcin level is positively associated with insulin sensitivity and secretion in patients with type 2 diabetes. Bone. 2011. 48(4). 720-5. doi: 10.1016/j.bone.2010.12.020.
- Iki M. Serum undercarboxylated osteocalcin levels are inversely associated with glycemic status and insulin resistance in an elderly Japanese male population: Fujiwara-kyo Osteoporosis Risk (FORMEN) Study. Osteoporos Int. 2012. 23(2). 761-70. doi: 10.1007/s00198-011-1600-7.
- Movahed A. Reduced serum osteocalcin concentrations are associated with type 2 diabetes mellitus and the metabolic syndrome components in postmenopausal women: the crosstalk between bone and energy metabolism. J. Bone Miner. Metab. 2012. 30(3). 683-91. doi: 10.1007/s00774-012-0367-z.
- Sanchez-Enriquez S. Serum levels of undercarboxylated osteocalcin are related to cardiovascular risk factors in patients with type 2 diabetes mellitus and healthy subjects. World J. Diabetes. 2017. 8(8). 11-9. doi: 10.4239/wjd.v8.i1.11.

/54_2.jpg)