Резюме
Актуальність. Остеопороз (ОП) характеризується крихкістю скелета і схильністю людей до переломів, обумовлених зменшенням кісткової маси та погіршенням мікроархітектури кістки. У неменструюючих жінок ламкість кісток більш виражена, а остеопоротичні переломи зустрічаються втричі частіше. Погіршують перебіг ОП у менопаузальних жінок наявність і тяжкість коморбідного метаболічного синдрому (МС), що вимагає вдосконалення лікувальних заходів у таких хворих. Мета дослідження: підвищити ефективність лікування ОП у менопаузальних жінок із МС і якість вторинної профілактики у них кісткових переломів. Матеріали та методи. Протягом двох років під наглядом перебували 28 неменструюючих жінок із ОП віком від 37 до 72 років (у середньому 50 років). У всіх випадках настала фізіологічна менопауза. Мінеральну щільність кістки оцінювали за Т-індексом остеоденситограм, рентгенологічними індексами Барнета — Нордіна, Рохліна й клиноподібності. У сироватці крові досліджували показники, що відображали стан кісткового метаболізму і МС. Результати. У менопаузальних жінок, які страждають на ОП, переломи стегнової кістки, хребта, кісток зап’ястка та ІІ плеснової діагностовано в 39 % випадків. Остеофрактури були прямо пов’язані з віком хворих, параметром остеоденситометричного індексу, наявністю й тяжкістю перебігу коморбідного МС, його складових чинників (IV типу гіперліпідемії і цукрового діабету другого типу), наявності діабетичної нейропатії, а також із вихідними концентраціями в крові Mg, Mn, Pb та Se. Розроблено оптимальну вторинну профілактику кісткових переломів у менопаузальних жінок із коморбідними ОП і МС, засновану на індивідуальних підходах до тривалого призначення препаратів Са, Se, Zn, бісфосфонатів, ранелату Sr, фібратів й урикодепресорів з урахуванням характеру і тяжкості перебігу МС. Висновки. Запропонована медична технологія лікування ОП у неменструюючих жінок із МС дозволила скоротити число остеофрактур у 10 разів, зменшити активність у крові лужної фосфатази і показника остеоденситометричного індексу.
Актуальность. Остеопороз (ОП) характеризуется хрупкостью скелета и подверженностью людей переломам, обусловленным уменьшением костной массы и ухудшением микроархитектуры кости. У неменструирующих женщин ломкость костей более выражена, а остеопоротические переломы встречаются втрое чаще. Ухудшает течение ОП у менопаузальных женщин наличие коморбидного метаболического синдрома (МС) и его тяжесть, что требует совершенствования лечебных мероприятий у таких больных. Цель исследования: повысить эффективность лечения ОП у менопаузальных женщин с МС и качество вторичной профилактики у них костных переломов. Материалы и методы. В течение двух лет под наблюдением находились 28 неменструирующих женщин с ОП в возрасте от 37 до 72 лет (в среднем 50 лет). Во всех случаях наступила физиологическая менопауза. Минеральную плотность кости оценивали по Т-индексу остеоденситограмм, рентгенологическим индексам Барнетта — Нордина, Рохлина и клиновидности. В сыворотке крови исследовали показатели, которые отражали состояние костного метаболизма и МС. Результаты. У менопаузальных женщин, страдающих ОП, переломы бедренной кости, позвоночника, костей запястья и ІІ плюсневой диагностированы в 39 % случаев. Остеофрактуры были прямо связаны с возрастом больных, параметром остеоденситометрического индекса, наличием и тяжестью течения коморбидного МС, составляющих его факторов (IV типа гиперлипидемии и сахарного диабета второго типа), с наличием диабетической нейропатии, а также с исходными концентрациями в крови Mg, Mn, Pb и Se. Разработана оптимальная вторичная профилактика костных переломов у менопаузальных женщин с коморбидными ОП и МС, основанная на индивидуальных подходах к длительному назначению препаратов Са, Se, Zn, бисфосфонатов, ранелата Sr, фибратов и урикодепрессоров с учетом характера и тяжести течения МС. Выводы. Предложенная медицинская технология лечения ОП у неменструирующих женщин с МС позволила сократить число остеофрактур в 10 раз, уменьшить активность в крови щелочной фосфатазы и показатель остеоденситометрического индекса.
Background. Osteoporosis is characterized by the fragi-lity of the skeleton and the susceptibility to fractures due to a decrease in bone mass and deterioration in bone microarchitecture. In menopausal women, bone fragility is more pronounced, and osteoporotic fractures are three times more frequent. The presence and severity of the comorbid metabolic syndrome worsens the course of osteoporosis in menopausal women, which requires an improvement of therapeutic measures in such patients. The purpose was to increase the effectiveness of treatment for osteoporosis in menopausal women with metabolic syndrome and the quality of secondary prevention of bone fractures in them. Materials and methods. Twenty eight menopausal women with osteoporosis aged 37 to 72 years (average 50 years) were monitored for two years. In all cases, physio-logical menopause occurred. Bone mineral density was evaluated by the T-index of osteodensitograms, X-ray indices of Barnett-Nordin, Rokhlin and wedge shape. In the blood serum, parameters were studied that reflected the state of bone metabolism and metabolic syndrome. Results. In menopausal women suffering from osteoporosis, fractures of the femur, spine, wrist bones and second metatarsal were diagnosed in 39 % of cases. They were directly related to the age of the patients, bone density, the presence and severity of the course of comorbid metabolic syndrome, and constituents of the latter (type IV hyperlipidemia and type II diabetes melitus), the presence of diabetic neuropathy, as well as baseline blood concentrations of Mg, Mn, Pb and Se. An optimal secondary prevention of bone fractures in menopausal women with comorbid osteoporosis and metabolic syndrome was developed based on individual approaches to the long-term administration of Ca, Se, Zn, bisphosphonates, strontium ranelate, fibrates and drugs that block uric acid production, taking into account the nature and severity of metabolic syndrome. Conclusions. Proposed medical technique for the treatment of osteoporosis in menopausal women with metabolic syndrome has reduced the number of bone fractures by 10 times, as well as the blood activity of alkaline phosphatase and bone density.
Введение
Хрупкость скелета и подверженность людей переломам, обусловленным уменьшением костной массы и ухудшением микроархитектуры кости, определяются остеопорозом (ОП) [1]. Эта метаболическая костная патология является серьезной проблемой ХХІ века из-за высокой заболеваемости и значительных затрат на медицинское обслуживание [2]. Только в США ОП вызывает 1,5 миллиона переломов костей позвоночника, бедренной кости и дистального метаэпифиза лучевой кости за год, на лечение которых тратится свыше 10 миллиардов долларов [3]. У неменструирующих женщин ломкость костей более выражена, а остеопоротические переломы встречаются втрое чаще [4, 5].
Развитие ОП у женщин с наcтуплением периода менопаузы тесно связано с метаболическим синдромом (МС), или синдромом инсулинорезистентности Х [6, 7], при котором накопление конечных продуктов гликирования приводит к усилению ломкости костей [8, 9]. МС не только ухудшает течение ОП у неменструирующих женщин, но и снижает эффективность мероприятий по вторичной профилактике остеофрактур, что требует совершенствования лечебных мероприятий у таких больных [10].
Цель исследования — повысить эффективность вторичной профилактики переломов костей при ОП у менопаузальных женщин с МС.
Материалы и методы
Обследованы 133 неменструирующие женщины с остеодефицитом (при соотношении ОП и остеопении 1 : 4) и коморбидным МС, у которых ретроспективно оценены минеральная плотность кости, уровни в крови гормональных, пептидных и ферментных маркеров костного метаболизма, остеоассоциированных макро- и микроэлементов, характер клинико-лабораторных факторов МС. На первом этапе исходные лабораторные показатели сравнивали у представительниц с переломами костей и без таковых.
Вторым этапом работы стало двухлетнее проспективное наблюдение за 28 (21,1 % от общего числа) женщинами в возрасте от 37 до 72 лет (в среднем 50,1 ± 0,82 года), у которых изучали число остеопорозных переломов костей и динамику параметров остеоденситометрического Т-индекса (ТИ) и активности в крови щелочной фосфатазы (АР), используемых для прогнозирования остеофрактур у менопаузальных женщин с ОП. Медикаментозная вторичная профилактика переломов костей выполнена 25 (89,3 %) женщинам, в том числе в 13 случаях использовали препараты Са (кальцемин, кальцемин-адванс, Са-D3 Никомед), в 5 — одновременно с золендроновой кислотой (акластой), у 6 больных применяли ранелат Sr (бивалос). Критериями эффективности было число переломов, показатели динамики ТИ и активности АР.
Методом случайной выборки (родившиеся в четные и нечетные даты) эти 28 женщин были распределены на две группы по 14 человек (1-я — основная, 2-я — группа сравнения), которые в течение 2 лет соответственно получали разработанную нами так называемую рациональную, или оптимальную (усовершенствованную), вторичную профилактику остеопорозных переломов и общепринятое традиционное («нерациональное») профилактическое лечение. Согласно критерию Мак-Немара — Фишера обе группы были примерно одинаковы по частоте использования препаратов Са, бисфосфонатов и ранелата Sr. Основная группа отличалась принципом индивидуального подхода к назначению противоостеопорозных препаратов с учетом исходного содержания остеоассоциированных химических элементов, а также проведением медикаментозной коррекции составляющих МС.
Для диагностики ОП использовали рентгеновский аппарат Multix-Compact-Siеmens (Германия), остеоденситометр для проксимального отдела бедренной кости QDR-4500-Delphi-Hologic (США), сонограф Envisor-Philips (Нидерланды), а у некоторых женщин — магнитно-резонансный томограф Signa-Excite-HD (Германия). Минеральную плотность кости оценивали по ТИ остеоденситограмм, рентгенологическим индексам Барнетта — Нордина, Рохлина и клиновидности. В сыворотке крови исследовали показатели, которые отражали состояние костного метаболизма и МС. Определение уровней AP, глюкозы (Gluc), С-пептида, липидов (холестерина, триглицеридов, липопротеидов низкой плотности, аполипопротеидов В), мочевой кислоты и ксантиноксидазы выполняли с помощью биохимических анализаторов Olympus-AU-640 (Япония) и BS200 (Китай), изучение концентраций инсулина (Ins), паратирина, кальцитонина, остеокальцина и остеопонтина в крови проводили иммуноферментным методом (ридер PR2100 Sanofi diagnostic pasteur, Франция). Среди химических элементов изучали содержание в крови Ca, Co, Cr, Cu, Mg, Mn, P, Pb, Se, Sr и Zn, применяя атомно-эмиссионный спектрометр с индуктивно связанной аргоновой плазмой IRIS-Intepid-II-XDL и атомно-абсорбционный спектрометр SolAAr-Mk2-MOZe с электрографитовым атомизатором (Великобритания). Контрольную группу составили 30 практически здоровых менструирующих женщин в возрасте от 23 до 48 лет (в среднем 35,50 ± 2,31 года).
Для определения МС учитывали показатель тяжести инсулинорезистентности HOMA (Homeostatic Model Assessment) > 3 отн. ед., который оценивали по формуле НОМА = (Ins × Gluc) : 22,5, а степень тяжести МС WMS — по формуле WMS = √ Σ × НОМА, где Σ — сумма отдельных признаков МС.
Статистическая обработка полученных результатов выполнена с помощью компьютерного вариационного, непараметрического, корреляционного одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (M), их стандартные ошибки и отклонения (SD), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла, критерии однофакторной дисперсии (D), ее однородности Брауна — Форсайта и многофакторной Уилкоксона — Рао, различий Стьюдента и МакНемара — Фишера, достоверность статистических показателей (р). Подсчитывали прогностически позитивный результат модели (PPV).
Результаты
В течение двух лет наблюдения переломы костей констатированы у 11 (39,3 %) женщин с ОП, в том числе шейки бедра — у 4 (14,3 % от общего числа с ОП и 36,4 % с переломами), по 3 (соответственно по 10,7 и 27,3 %) — позвоночника (отделы Т6–8, Т11–12, L1) и дистального метаэпифиза лучевой кости, у 2 (7,1 и 18,2 %) — маршевый ІІ плюсневой кости. В 5 случаях женщины получали препараты Са, в 1 — Са с бисфосфонатами, тогда как на фоне ранелата Sr переломы отсутствовали.
По данным однофакторного дисперсионного анализа, развитие переломов с обратной зависимостью было связано с применением ранелата Sr и с прямой — с возрастом больных. На развитие переломов оказывал воздействие исходный показатель ТИ. Кроме того (рис. 1), переломы костей зависели от уровней НОМА и WMS коморбидного МС, а также от наличия гипергликемии (содержание Gluc > 5,9 ммоль/л) и манифестного сахарного диабета 2-го типа (на костные переломы у женщин с ОП оказывали достоверное воздействие показатели в крови Ins и Gluc).
/43.jpg)
По данным анализа однородности дисперсии Брауна — Форсайта и непараметрического корреляционного коэффициента Кендалла, формирование остеофрактур и достоверная динамика активности АР тесно и разнонаправленно связаны с исходными значениями плюмбемии. Кроме того, показатель разницы значений АР до и после лечения ОП зависит от уровней ОР и Sr. С учетом выполненного вариационного, дисперсионного и корреляционного анализа сделано заключение, имеющее практическую направленность: исходный показатель в крови Pb < 60 мкг/л (< M – SD женщин с ОП) является прогнозпозитивным критерием в отношении дальнейших костных переломов (PPV = 70,6 %).
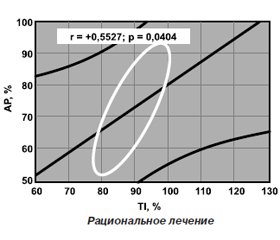
В группе женщин с переломами исходный показатель ТИ был достоверно (на 7,7 %) большим, тогда как рентгенологические индексы оказались малоинформативными. Необходимо отметить, что средние значения этого показателя у женщин до и после лечения составили 2,7 ± 0,04 – SD и 2,5 ± 0,09 – SD (различия достоверны), причем без переломов — 2,6 ± 0,04 – SD и 2,3 ± 0,08 – SD, а с переломами — 2,8 ± 0,07 – SD и 2,9 ± 0,12 – SD, что представлено на рис. 2.
До лечения показатель активности АР у женщин с последующими переломами и без таковых соответственно составил 148,3 ± 2,4 и 151,9 ± 1,7 Е/л.
В случае отсутствия остеофрактур уровень АР уменьшался на 24,9 %, составив 114,10 ± 4,92 Е/л, достоверно различалась и динамика АР в группах женщин с разной эффективностью лечения. У больных с переломами изначально на 38,2 % был выше уровень НОМА, на 34,2 % — показатель WMS, на 12,7 % — уровень гликемии, что еще раз указывает на неблагоприятное влияние коморбидного МС на течение ОП у женщин. Мы установили, что, по данным вариационного, дисперсионного и корреляционного анализа, прогнознегативными признаками в отношении возможных костных переломов у менопаузальных женщин являются параметры WSM > 6 oтн. eд. и ТИ > 2,8 – SD (< M + SD при ОП) (соответственно PPV = 63,6 и 72,7 %). Еще одним фактором риска остеофрактур при ОП у менопаузальных женщин можно считать IV тип гиперлипидемии, поскольку, по данным непараметрического критерия различий Мак-Немара — Фишера, в этой группе его частота была выше в 7,7 раза.
Группа женщин с развитием переломов костей отличалась от остальных больных с ОП более низким — на 43,7 % — содержанием в сыворотке крови Mn и на 22,6 % Se при увеличении концентрации Pb на 19,2 %. На рис. 3 представлены различия трехмерных интегральных гистограмм эссенциальных микроэлементов (Mn + Se + Zn) у женщин разных групп. Можно сделать заключение, что вторичную профилактику остеофрактур у женщин группы риска целесообразно проводить с подключением препаратов Mn, Se и Zn.
Рациональная (оптимальная) профилактика базировались на 6 основных принципах с учетом коморбидного МС:
1. У всех больных с показателем WMS > 5,5 oтн. eд. (> M + SD женщин с МС) в комплексе профилактических мероприятий использовали метформин (глюкофаж, сиофор) по 500–2000 мг/сут.
2. Всем больным с коморбидным сахарным диабетом при МС одновременно назначали препараты Se и Zn: во время завтрака использовали селено-рецис или натрия селенита пентагидрат (препарат цефасель), а самостоятельным препаратом сульфата Zn был цинктерал по 2 табл. (248 мг Zn) однократно в сутки за час до еды.
3. При уровне в крови Sr < 30 мкг/л (< M – SD женщин без остеодефицита) назначали ранелат Sr (бивалос) по 2 г/сут (1 саше), а противопоказанием была сопутствующая ишемическая болезнь сердца III–IV функционального класса, хроническая обструктивная болезнь легких, артериальная гипертензия со средним уровнем давления > 140 мм рт.ст. при параметре холестеринемии > 7 ммоль/л (> M + SD женщин без ОП).
4. Среди бисфосфонатов использовали золендроновую кислоту (акласту) по 5 мл внутривенно капельно в течение 15 минут на 100 мл физиологического раствора 1 раз в месяц. При этом не применяли петлевые диуретики, не назначали препарат в случаях сопутствующей хронической болезни почек, при показателях в крови Cа < 70 мг/л и Mg < 30 мг/л (< M – SD женщин без остеодефицита).
5. При наличии гиперурикемии (> 360 мкмоль/л) и активности ксантиноксидазы > 7 нмоль/мл/мин у женщин с МС назначали дополнительно аллопуринол по 100–200 мг 1 раз в сутки.
6. При уровне триглицеридемии > 3,5 ммоль/л (> M + SD женщин с МС) применяли фенофибрат по 200 мг 1 раз в сутки.
С методологической точки зрения необходимо было показать, что больные, получавшие рациональное лечение, не отличались от остальных пациентов по тяжести течения патологического процесса или даже превосходили 2-ю группу. Начнем с того, что параметр ТИ в обеих группах был равен, составляя соответственно 2,7 ± 0,05 – SD и 2,7 ± 0,06 – SD. Основная группа и группа сравнения с ОП были одинаковы по частоте МС и составляющих его факторов. Исключением являлось лишь коморбидное ожирение, которое констатировали в 92,5 % случаев в 1-й группе и в 50,0 % в 2-й (различия достоверны). У женщин с рациональным лечением был на 21,7 % достоверно большим индекс массы тела Кетле и на 19,7 % — показатель инсулинемии.
Необходимо отметить, что если в основной группе имела место прямая корреляция между динамикой активности АР и изменением ТИ до и после лечения, то в группе сравнения такая связь отсутствовала (рис. 4). Если показатели активности АР у женщин и 1-й, и 2-й группы в процессе существенно уменьшались (соответственно на 27,5 и 5,3 %), то параметр ТИ имел позитивную динамику лишь на фоне рационального лечения (уменьшение на 11,1 %). В 1-й и 2-й группах сравнительное сокращение активности сывороточной АР к концу наблюдения в среднем составило 23,1 %, тогда как достоверные различия параметра ТИ составили 9,1 %. Однофакторный анализ однородности дисперсии Брауна — Форсайта и многофакторный анализ Уилкоксона — Рао показали отсутствие различий в обеих группах обследованных с ОП в плане влияния на динамику ТИ возраста женщин, наличия и характера МС, в том числе тяжести течения и клинических проявлений коморбидного сахарного диабета.
/45.jpg)
По данным литературы [11, 12], для лечения ОП остаются препаратами первого выбора аминобисфосфонаты (алендронат, ризедронат, ибандронат, золендроновая кислота) и ранелат Sr, которые ингибируют опосредованный остеокластами процесс костной резорбции, в результате чего увеличивается костная масса и улучшается прочность кости, снижается риск переломов различной локализации.
По результатам теста однородности дисперсии Брауна — Форсайта и корреляционного непараметрического анализа Кендалла мы проанализировали антиостеопорозную эффективность лечения женщин 1-й и 2-й групп. У женщин основной группы результаты лечебных мероприятий по ТИ зависели от исходных показателей МС — НОМА и WMS, а в группе cравнения — от содержания С-пептида. Если во 2-й группе имела место корреляция динамики денситометрического индекса с параметрами WMS, HOMA, Gluc, гликозилированного гемоглобина, индекса массы тела, среднего артериального давления и периферического сосудистого сопротивления, то оптимальное лечение такие связи нивелировало и сохранялась лишь корреляция с исходными значениями WMS.
Как свидетельствует критерий однородности дисперсии Брауна — Форсайта, при рациональной вторичной профилактике костных переломов у менопаузальных женщин с ОП эффективность лечебных мероприятий была тесно связана с исходными показателями в крови Са и Cu, причем с последним существует обратная корреляционная зависимость Кендалла. В группе сравнения с нерациональной профилактикой достоверная обратная дисперсионно-корреляционная зависимость касалась показателя плюмбемии. В связи с этим сделаны следующие заключения: 1) в случаях гиперкупремии (Cu > 1,2 мг/л или > M + SD женщин с ОП) целесообразна разработка новых методов профилактики, возможно, с дополнительным назначением медьсвязывающих комплексонов (например, D-пеницилламина); 2) в случаях гиперплюмбемии (Pb > 92 мкг/л или > M ± SD женщин с ОП) необходимо проведение разработанной нами индивидуальной рациональной комбинированной медикаментозной терапии. Предложенная оптимальная двухлетняя медикаментозная профилактика костных переломов у менопаузальных женщин с ОП позволила сократить число развития остеофрактур с 10 до 1.
Выводы
1. В течение двух лет наблюдения за менопаузальными женщинами, страдающими ОП, переломы бедренной кости, позвоночника, костей запястья и ІІ плюсневой диагностированы в 39 % случаев.
2. Остеофрактуры прямо связаны с возрастом больных, параметром ТИ, наличием и тяжестью течения коморбидного МС, составляющих его факторов (гиперлипидемия IV типа и сахарный диабет), наличия диабетической нейропатии, с исходными концентрациями Mg, Mn, Pb и Se.
3. Разработанная оптимальная вторичная профилактика костных переломов у менопаузальных женщин с ОП, основанная на индивидуальных подходах к длительному назначению препаратов Са, Se, Zn, бисфосфонатов, ранелата Sr, фибратов и урикодепрессоров с учетом характера и тяжести течения МС, позволила сократить число остеофрактур, уменьшить активность в крови АР и величину остео-денситометрического индекса.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов и личной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Sugimoto T., Sato M., Dehle F.C., Brnabic A.J., Weston A., Burge R. Lifestyle-related metabolic disorders, osteoporosis, and fracture risk in Asia: A systematic review. Value Health Reg. Issues. 2016. 9 (1). 49-56. doi: 10.1016/j.vhri.2015.09.005.
2. Wong S.K., Chin K.Y., Suhaimi F.H., Ahmad F., Ima-Nirwana S. The relationship between metabolic syndrome and osteoporosis: a review. Nutrients. 2016. 8 (6). 347. doi: 10.3390/nu8060347.
3. Nayak N.K., Khedkar C.C., Khedkar G.D., Khedkar C.D. Osteoporosis. Encyclopedia of food and health. Oxford: Academic Press, 2016. 181-5.
4. Kaufman J.M., Goemaere S. Osteoporosis in men. Best Pract. Res. Clin. Endocrinol. Metab. 2008. 22 (5). 787-812.
5. Horikawa K., Kasai Y., Yamakawa T., Sudo A. Prevalence of osteoarthritis, osteoporotic vertebral fractures, and spondylolisthesis among the elderly in a Japanese village. J. Orthop. Surg. 2016. 14 (1). 9-12.
6. Li R.C., Zhang L., Luo H., Lei Y., Zeng L., Zhu J. et al. Subclinical hypothyroidism and anxiety may contribute to metabolic syndrome in Sichuan of China: a hospital-based population study. Sci Rep. 2020. 10 (1). 2261. doi: 10.1038/s41598-020-58973-w.
7. Seo Y.G., Song H.J., Song Y.R. Fat-to-muscle ratio as a predictor of insulin resistance and metabolic syndrome in Korean adults. J. Cachexia Sarcopenia Muscle. 2020. 7 (2). 12548. doi: 10.1002/jcsm.12548.
8. Kayal R.A., Tsatsas D., Bauer M.A., Allen B., Al-Sebaei M.O., Kakar S. et al. Diminished bone formation during diabetic fracture healing is related to the premature resorption of cartilage associated with increased osteoclast acti-vity. J. Bone Miner. Res. 2007. 22 (2). 560-8. doi: 10.1359/jbmr.070115.
9. Yamagishi S., Nakamura K., Inoue H. Possible participation of advanced glycation end products in the pathogenesis of osteoporosis in diabetic patients. Med. Hypotheses. 2005. 65. 1013-5. doi: 10.1016/j.mehy.2015.07.017.
10. Vollenweider P., Randin D., Tappy L., Jequier E., Nicod P., Scherrer U. Impaired insulin-induced sympathetic neural activation and vasodilation in skeletal muscle in obese humans. J. Clin. Invest. 2014. 93. 2365-71.
11. Brown J.P., Morin S., Leslie W. Bisphosphonates for treatment of osteoporosis. Expected benefits, potential harms, and drug holidays. Canad. Fam. Physic. 2014. 60 (1). 324-33. doi: 10.1210/endo.141.3.7366.
12. Compston J., Cooper A., Cooper C. UK clinical guideline for the prevention and treatment of osteoporosis. Arch. Osteoporos. 2017. 12 (1). 43-9.

/43.jpg)
/43_2.jpg)
/44.jpg)
/45.jpg)