Вступ
Незважаючи на застосування сучасних методів лікування, при гострому панкреатиті (ГП) загальна летальність залишається досить високою [1]. Тяжка форма ГП розвивається у 20–30 % пацієнтів, при цьому частота госпітальної смертності становить близько 15 %, і вона найчастіше обумовлена дисфункцією одного або декількох органів, що вимагає проведення інтенсивної терапії (ІТ) [2].
Дослідження М. Besselink et al. (2007) подало оновлення щодо лікування тяжкого ГП з акцентом на харчування, профілактику інфекції, біліарний панкреатит і хірургічне втручання [3].
Лікування тяжкого ГП принципово змінюється протягом останнього часу, коли наголошується нова парадигма less is more — менше антибіотиків, менше рідини, менше операцій, що може врешті-решт призвести до зменшення захворюваності й смертності хворих із ГП [4].
Пріоритетні запитання щодо проведення інтенсивної терапії у хворих із ГП у відділенні інтенсивної терапії (ВІТ) подані у WSES Guidelines for the management of severe acute pancreatitis (2019) [2]:
1. Які є показання до прийому хворих на ГП у реанімацію?
2. Коли показана рідинна ресусцитація і яку рідину слід вживати? Яка оптимальна швидкість вливання рідини й вимірювання реакції для початкової реанімації? Який переважний фармакологічний підхід до стійкого шоку?
3. Який правильний підхід до контролю болю?
4. Які існують показання до штучної вентиляції легень?
5. Яким є медичний підхід до абдомінального компартмент-синдрому? Яка роль таких препаратів, як аналоги соматостатину?
6. Ентеральне харчування (ЕХ): які існують показання, який тип харчування слід застосовувати і який найкращий спосіб введення ЕХ?
Огляд недавньої літератури з ведення пацієнтів із тяжким ГП, що надійшли у ВІТ, свідчить про адекватну оцінку ризику й прогнозу тяжкості (включно з моніторингом внутрішньочеревного тиску), індивідуальне введення рідини на користь збалансованих кристалоїдів, відмову від профілактичної антибіотикотерапії і раннє виявлення й лікування позапанкреатичних і грибкових інфекцій [5].
Визначено, що рання рідинна ресусцитація у хворих з ГП показана для оптимізації перфузії тканин без очікування погіршення гемодинаміки [2]. При проведенні інфузійної терапії рекомендовано часто виконувати переоцінку гемодинамічного статусу, бо відомо, що перевантаження рідиною має згубні наслідки. Ізотонічні кристалоїди є кращою рідиною (1В).
Інтенсивну гідратацію (введення ізотонічного розчину кристалоїдів у дозі 250–500 мл/год) рекомендовано застосовувати в усіх пацієнтів, за винятком тих, хто страждає від супутніх серцево-судинних і/або ниркових захворювань. Рання агресивна внутрішньовенна гідратація, за даними авторів, є найбільш корисною протягом перших 12–24 год, а поза межами цього періоду може бути малоефективною.
Мета роботи: проаналізувати динаміку показників гомеостазу, гемодинаміки й відновлення функції шлунково-кишкового тракту на тлі проведення інфузійної терапії у хворих із тяжким гострим панкреатитом.
Матеріали та методи
Обстежено й проаналізовано 120 пацієнтів із тяжким гострим панкреатитом, які лікувалися у відділенні анестезіології та інтенсивної терапії (ВАІТ) № 2 хірургічного профілю КЗ «Дніпровське клінічне об’єднання швидкої медичної допомоги» ДМР» за період із 2014 по 2018 р. (шифр К85 за МКХ-10).
Пацієнти з ГП отримали стандартну терапію згідно з клінічним протоколом надання медичної допомоги хворим із гострим панкреатитом (Наказ МОЗ України № 297 від 02.04.2010 «Про затвердження стандартів і клінічних протоколів надання медичної допомоги зі спеціальності «Хірургія»).
Дослідження проведено на підставі стратифікованого розподілу на групи порівняння залежно від функції шлунково-кишкового тракту (ШКТ) на 2-гу добу захворювання, що обумовило вибір методу нутритивної підтримки в комплексі інтенсивної терапії. Хворі були розподілені на підгрупи залежно від суміші, яку застосовували для проведення парентерального харчування.
1-ша група дослідження (n = 57) — пацієнти, у яких на 2-гу добу проведення інтенсивної терапії спостерігалися явища кишкової недостатності, що унеможливлювало проведення раннього ЕХ, тому покриття енергопотреб проводилось методом повного парентерального харчування. До 2-ї групи дослідження (n = 63) увійшли пацієнти, у яких із 2-ї доби в комплексі інтенсивної терапії починали проведення раннього ЕХ через назогастродуоденальний зонд зі швидкістю 20 мл/год із поступовим збільшенням об’єму введення на фоні відновлення функції ШКТ і комбінуванням із парентеральним харчуванням.
Для порівняння лабораторних і електрофізіологічних показників обстежено групу регіонарної норми (n = 23). Точки контролю: визначення вихідного стану при надходженні хворого в стаціонар і ВАІТ, 1-й день лікування, на 2-гу, 3-тю, 5-ту, 7-му, 14-ту, 21-шу й 28-му добу.
Кінцевими точками були обрані такі показники, як тривалість перебування у ВАІТ і стаціонарі. Також була проаналізована динаміка показників метаболічного статусу, запалення й органної дисфункції.
Усі пацієнти з ГП отримали стандартну терапію згідно з клінічним протоколом надання медичної допомоги хворим із гострим панкреатитом (Наказ МОЗ України № 297 від 02.04.2010 «Про затвердження стандартів та клінічних протоколів надання медичної допомоги зі спеціальності «Хірургія»).
Корекція дегідратації проводилася шляхом рідинної ресусцитації для оптимізації перфузії тканин. З урахуванням результатів проведеної проби Шелестюка і під контролем центрального венозного тиску вводили збалансовані електролітні розчини. Введення рідини проводили з частою переоцінкою гемодинамічного статусу. Потребу в рідині повторно оцінювали через певні проміжки часу — кожні 6 год протягом наступних 24–48 год після госпіталізації. Метою рідинної ресусцитації було зменшення рівнів гематокриту крові, вмісту сечовини й креатиніну сироватки крові, нормалізація водно-електролітного й кислотно-основного стану (КОС) у пацієнта з тяжким ГП.
Усім хворим після госпіталізації оцінювали ступінь тяжкості ГП, формулювали діагноз і проводили діагностично-лікувальну програму в умовах відділення анестезіології та інтенсивної терапії, де здійснювали моніторинг і корекцію основних показників вітальних функцій і лабораторних даних. При госпіталізації та в динаміці визначали активність альфа-амілази в сироватці крові, рівень діастази в сечі. Моніторували гематокрит крові (Ht, %). Аналізували показники загального аналізу крові й сечі, біохімічного аналізу крові: рівень загального білка й альбуміну сироватки крові, глюкози, креатиніну й сечовини, трансаміназ і білірубіну сироватки крові, визначали показники системи гемостазу (коагулограми).
Вираженість метаболічних змін оцінювали за показниками кислотно-лужного стану (pH, HCO3 сироватки крові) і рівня електролітів (Na+, Cl–, K+, ммоль/л) апаратом PL 1000 B Electrolyte Analyzer (Україна).
Визначення газового складу крові проводили апаратом Medica Easy Blood Gas REF 6101-0000 (Medica Corporation, США). Визначали сатурацію кисню венозної крові (SaO2v) та артеріальної крові (SaO2а).
Оцінювали гемодинамічний статус пацієнта: частоту серцевих скорочень, систолічний і діастолічний артеріальний тиск, середній артеріальний тиск, центральний венозний тиск. Моніторували частоту дихання, температуру тіла, діурез.
Реєстрацію показників центральної гемодинаміки здійснювали чотириканальним реографом 4-РГ-1 за методикою інтегральної реографії М.І. Тищенко (Росія). Розраховували значення фактичного об’єму циркулюючої крові (ОЦК, мл) і дефіцит об’єму циркулюючої крові, хвилинний об’єм кровообігу, серцевий індекс (СІ, л/хв/м2), ударний об’єм серця (УО, мл), загальний периферичний судинний опір (ЗПСО, дин • с • см–5).
Функція ШКТ визначалася на підставі вихідних показників диспептичного синдрому (нудота, блювання, діарея, здуття живота й порушення перистальтики), рівня внутрішньочеревного тиску (ВЧТ) і залишкового об’єму шлунка. Залишковий об’єм шлунка (в мл) реєструвався за кількістю виділень по назогастральному зонду, який встановлювався при надходженні у ВАІТ усім пацієнтам із тяжким ГП. Визначення рівня ВЧТ проводили шляхом вимірювання тиску в сечовому міхурі. Результат, отриманий у мм Н2О, переводили в мм рт.ст. за формулою: 1 мм рт.ст. = 13,6 мм Н2О. Для проведення статистично значущого аналізу диспепсії кожен симптом (нудота, блювання, запор, пронос і їх чергування) оцінювали в 0,5 бала. Підсумовували абсолютне значення балів.
Перед статистичною обробкою всі дані були перевірені на нормальність розподілу. Для кількісних показників з нормальним розподілом первинна статистична обробка включала розрахунок середнього арифметичного (М) і стандартного відхилення (Standard Deviation, SD). Для непараметричних даних первинна статистична обробка даних включала розрахунок медіани (Ме) й інтерквартильного розмаху — 25 і 75 перцентилів. Проводився кореляційний аналіз з розрахунком коефіцієнтів рангової кореляції Спірмена (R) і канонічної кореляції (Rс) для виявлення залежності між підмножинами даних у цілому на всіх етапах спостереження. Статистична обробка матеріалів дослідження проведена стандартними статистичними методами з використанням пакетів прикладних програм Microsoft Offiсe Excel 2010 (Office Home Business 2KB4Y-6H9DB-BM47K-749PV-PG3KT) і Statistica v.6.1 (Statsoft Inc., США) — ліцензійний № AGAR909E415822FA. Відмінності були статистично значимі при р < 0,05.
Результати
Проведений аналіз показав, що при госпіталізації пацієнти 1-ї і 2-ї груп дослідження за шкалою АРАСНЕ мали 18,0 од. (18,0; 19,0) і 19,0 од. (17,0; 20,0) відповідно. При госпіталізації середні значення амілази крові в пацієнтів 1-ї і 2-ї груп дослідження перевищували верхню межу норми в 3 рази (до 114,0 ± 21,1 мккатал/л і 99,8 ± 8,0 мккатал/л відповідно), діастази сечі — більше ніж у 7 разів (до 677,3 ± 78,9 мккатал/л і 839,8 ± 55,4 мккатал/л відповідно), що свідчило про розвиток тяжкого ГП. Через 1 добу проведення ІТ у хворих 1-ї і 2-ї груп спостереження вірогідно знизились середні значення α-амілази сироватки крові на 55,9 і 65,7 % відповідно та діастази сечі — на 10,8 і 16,8 % відповідно.
При надходженні у ВАІТ у хворих із ГП діагностували дегідратацію, що супроводжувалася розвитком гемоконцентрації. До основних критеріїв ефективності інтенсивної терапії в 1-шу добу її проведення у хворих із ГП належало ефективне лікування дегідратації, що супроводжувалася водно-електролітними порушеннями.
При госпіталізації у хворих із гострим панкреатитом діагностували дегідратацію, обумовлену розвитком основного захворювання. При цьому дефіцит ОЦК у хворих 1-ї групи становив 2437,5 мл (1440,5; 2816,0), у хворих 2-ї групи — 2437,0 мл (1540,0; 2946,0). Міжгрупові відмінності невірогідні (p = 0,546). Об’єм інфузійної терапії протягом 1-ї доби після госпіталізації у хворих 1-ї і 2-ї груп дослідження становив 3144,6 мл (2700,0; 3800,0) і 3400,0 мл (2575,0; 3800,0) відповідно. Міжгрупові відмінності були вірогідними (р = 0,059). На тлі проведення рідинної ресусцитації протягом першої доби після госпіталізації у хворих 1-ї і 2-ї груп дослідження реєстрували вірогідне зростання фактичного ОЦК на 27,3 і 26,1 % відповідно (р < 0,001). Міжгрупові відмінності не були вірогідними (р = 0,049).
На 2-гу добу ІТ об’єм інфузійної терапії становив у хворих 1-ї групи 3060,0 мл (2740,0; 3350,0), у хворих 2-ї групи — 3200,0 мл (2560,0; 3500,0). Поступово знижувався на 3-тю добу (p < 0,001 щодо попереднього етапу) до 2505,0 мл (2250,0; 2800,0) і 2600,0 мл (2200,0; 2650,0) відповідно. Міжгрупові відмінності були невірогідними (p = 0,449 між групами).
При дослідженні рівня електролітів сироватки крові у хворих 1-ї і 2-ї груп було відзначено, що при госпіталізації були дещо зниженими значення Na+ крові — до 133,2 ммоль/л (131,0; 141,1) і 132,5 ммоль/л (132,0; 139,0) відповідно). Рівень K+ сироватки крові становив 3,5 ммоль/л (3,4; 3,7) і 3,4 ммоль/л (3,1; 3,6) відповідно. На 2-гу добу ІТ значення Na+ і K+ сироватки крові стабілізувалися й були в межах норми упродовж усього дослідження.
При визначенні рівня Cl– сироватки крові встановлено, що при госпіталізації середні значення показника були 96,0 ммоль/л (92,0; 105,0) і 96,5 ммоль/л (91,0; 100,0) відповідно. Відмінності між групами були невірогідні (p = 0,928). З другої доби ІТ і протягом усього дослідження середні значення Cl– сироватки крові пацієнтів обох груп дослідження були в межах норми — 99,0 ммоль/л (97,0; 105,0) і 98,5 ммоль/л (95,0; 105,0) відповідно.
На момент госпіталізації в усіх пацієнтів 1-ї і 2-ї груп дослідження реєстрували розвиток метаболічного ацидозу. Рівень pH хворих 1-ї і 2-ї груп дорівнював 7,21 (7,13; 7,30) і 7,20 (7,12; 7,24) відповідно, міжгрупові відмінності були невірогідними (p = 0,217). Через 24 години на тлі проведення ІТ відбувалась нормалізація значень pH хворих обох груп, середні значення яких становили 7,36 (7,34; 7,39) і 7,37 (7,35; 7,40) відповідно (p < 0,001 щодо вихідного рівня). Вірогідних відмінностей між групами не відзначалось протягом усього дослідження.
Аналіз рівня бікарбонату сироватки крові виявив, що при госпіталізації хворих 1-ї і 2-ї груп середні значення HCO3 сироватки крові становили 17,5 ммоль/л (16,0; 20,8) і 16,5 ммоль/л (15,8; 21,2) відповідно (p = 0,059). Це було нижче від нижньої межі норми (22–26 ммоль/л) на 17,3 і 22,3 % відповідно. Але вже через добу ІТ відбувалась нормалізація показника до 23,3 ммоль/л (19,9; 24,0) і 22,7 ммоль/л (20,75; 25,7) відповідно (p = 0,001 до попереднього етапу). Відмінності між групами були невірогідні (p = 0,374). На 3-тю добу дослідження концентрація HCO3 становила 26,3 ммоль/л (22,4; 26,5) і 26,0 ммоль/л (24,1; 26,4) відповідно. Відмінності між групами були невірогідні (p = 0,695).
Проведено аналіз показників центральної гемодинаміки й кисневого статусу хворих із ГП. Визначено, що при госпіталізації у пацієнтів 2-ї групи середні значення УО крові та СІ порівняно з 1-ю групою хворих були більше на 10,1 і 13,5 % відповідно (рис. 1, 2).
На тлі проведення ІТ у хворих 1-ї групи середні значення УО крові та СІ поступово збільшувалися на 3-тю і 5-ту добу (p < 0,001). У хворих 2-ї групи значення УО і СІ були стабільними й не відрізнялися на етапах спостереження.
При госпіталізації у хворих 1-ї і 2-ї груп реєстрували вазоконстрикцію: середні значення ЗПСО були в межах 1899,0 ± 119,2 дин • с • см–5 і 1793,5 ± ± 101,6 дин • с • см–5. Міжгрупові відмінності були невірогідними (p = 0,504). На тлі проведення ІТ у пацієнтів 1-ї і 2-ї груп спостереження середні значення ЗПСО знижувалися вже на 2-гу добу ІТ до 1568,3 ± 98,7 дин • с • см–5 (p < 0,001) і 1349,7 ± ± 74,3 дин • с • см5 (p < 0,001) відповідно. Міжгрупові відмінності p = 0,084. Повна нормалізація судинного опору реєструвалася у хворих 2-ї групи на 3-тю добу ІТ (1204,0 ± 62,6 дин • с • см–5), у 1-й групі — на 5-ту добу (1178,6 ± 100,9 дин • с • см–5).
Визначено, що при надходженні в стаціонар у хворих як 1-ї, так і 2-ї груп спостереження сатурація кисню артеріальної і венозної крові була нижче від нижньої межі норми (рис. 3, 4).
У хворих як 1-ї, так і 2-ї груп спостереження SaO2a при госпіталізації була нижче від нижньої межі норми (94–100 %) — 93,6 % (90,2; 96,0) і 92,3 % (90,2; 94,0) відповідно. Уже через 24 години середні значення вірогідно збільшилися у хворих 1-ї групи до 94,6 % (92,2; 96,5) (p = 0,005), 2-ї групи — до 94,0 % (92,6; 96,0) (p = 0,001), що свідчило про адекватність проведення інтенсивної терапії ГП. Рівень SaO2a зберігався в межах норми протягом періоду спостереження й вірогідно не відрізнявся між групами.
Визначено, що при надходженні SaO2v була нижче від нижньої межі норми (70–80 %) у хворих як 1-ї, так і 2-ї груп спостереження на 14,4 і 14,8 % відповідно (рис. 4). При цьому показники SaO2v становили 61,7 % (53,0; 64,0) і 61,3 % (53,0; 63,2) відповідно й не відрізнялися між групами (p = 0,650). Через 24 години ІТ рівень SaO2v збільшився до 63,0 % (62,0; 70,0) і 67,4 % (61,0; 70,0) відповідно (p = 0,012 і p = 0,009 до попереднього етапу), але не досягав норми на відміну від динаміки SaO2a.
Нижньої межі норми SaO2v у хворих 1-ї і 2-ї груп досягала на 5-ту добу ІТ (p < 0,001 щодо вихідного рівня), коли її значення становили у хворих 1-ї групи 72,0 % (68,0; 74,0) (p = 0,002 до попереднього етапу), 2-ї групи — 71,0 % (64,0; 74,0) (p = 0,009). Міжгрупові відмінності були невірогідними (p = 0,324). На нашу думку, низькі вихідні значення SaO2v були обумовленні збільшенням екстракції кисню тканинами з моменту госпіталізації на тлі розвитку тканинної гіпоксії, що була обумовлена тяжким ГП. На підставі динаміки SaO2v, незважаючи на нормалізацію SaO2a через добу ІТ, компенсаторне збільшення екстракції кисню зберігалося до 5-ї доби після госпіталізації до повної нормалізації центральної гемодинаміки й перфузії тканин.
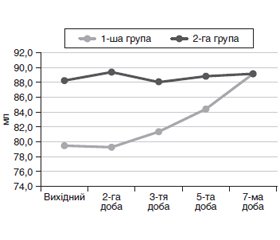
Аналіз порівняльної динаміки ВЧТ хворих 1-ї і 2-ї групи дослідження показав, що вже при госпіталізації хворих з ГП визначалося підвищення його значень до 11,5 (10,8; 12,0) і 10,0 (10,0; 11,5) мм рт.ст. відповідно, що було вище від норми на 23,8 і 22,3 % відповідно. Визначено, що вихідний рівень ВЧТ асоціювався з тяжкістю захворювання за АРАСРЕ ІІ (р = 0,054), гіперкортизолемією (р = 0,075), високим рівнем лейкоцитозу (р = 0,041) і С-реактивного білка крові (р = 0,013).
У пацієнтів 2-ї групи через 24 години після госпіталізації реєстрували вірогідне зниження рівня ВЧТ на 13,6 % до 9,0 мм рт.ст. (8,0; 10,0) (р < 0,001 до попереднього етапу). При цьому у хворих 1-ї групи не відбувалося вірогідних змін рівня ВЧТ, і він становив 11,0 мм рт.ст. (10,0; 11,8). Через 2 доби спостереження у 2-й групі тривало вірогідне зниження рівня ВЧТ до 8,0 мм рт.ст. (8,0; 9,0) з нормалізацією на 3-тю добу ІТ — 6,5 мм рт.ст. (6,0; 8,0). Міжгрупові відмінності були вірогідними (p = 0,004). У хворих 1-ї групи значення ВЧТ вірогідно знизились (р < 0,001) до 7,0 мм рт.ст. (6,0; 9,0) на 4-ту добу ІТ.
На 3-тю добу ІТ визначено взаємозв’язок між ВЧТ і високим рівнем глюкози крові (R = 0,30, р = 0,043), рівнем АСТ (R = 0,43, р = 0,003) і негативний зв’язок із сатурацією крові (R = –0,33, р = 0,033). Високий рівень ВЧТ корелював із розвитком органної дисфункції після 48 годин (R = 0,33, р = 0,023) і її тривалістю (R = 0,33, р = 0,027), плевритом (R = 0,32, р = 0,031), потребою в проведенні оперативних втручань (R = 0,46, р = 0,001). Визначена кореляція з низьким рівнем УО (R = –0,27, р = 0,068) та ОЦК (R = –0,31, р = 0,032).
Обговорення
Для початкового лікування гострого панкреатиту рекомендується проведення рідинної ресусцитації [6]. Однак оптимальна швидкість проведення рідинної ресусцитації, тип і мета інфузійної терапії залишаються невизначеними. G. Trikudanathan et al. (2012) провели огляд літератури, щоб дати уявлення про патофізіологічні зміни в мікроциркуляції підшлункової залози, які виникають у хворих з ГП [7]. Вивчено маркери раннього розпізнавання ступеня тяжкості панкреатиту, оптимального об’єму рідини. Високий рівень гематокриту крові, азоту сечовини та креатиніну сироватки крові при госпіталізації спонукав лікарів до застосування більш інтенсивних заходів ранньої реанімації.
Обґрунтовано, що неадекватний об’єм періопераційної інфузійної терапії (як надлишок, так і нестача) є одним із предикторів післяопераційних ускладнень. А. Brown et al. (2002) показали, що в пацієнтів з неадекватною інфузійною терапією, про яку свідчила персистенція гемоконцентрації протягом 24 год, розвинувся некротизуючий панкреатит [8].
Питання «що?», «коли?» і «як?» до сьогодні залишаються актуальними й дискутабельними [9, 10]. Визначено, що інфузійна терапія у хворих із гострим панкреатитом має бути цілеспрямованою, індивідуальною [11].
До задач інфузійної терапії відносять усунення гіповолемії та підтримку адекватного об’єму крові, відновлення електролітного балансу, нормалізацію КОС, збільшення органної перфузії та нормалізацію транспорту кисню. Гіповолемія, що зберігається, супроводжується периферичною вазоконстрикцією для підтримки кровотоку в серці й мозку, ішемією в інших органах. Гіперволемія обумовлює розвиток набряку тканин, порушення функції легень, серцево-судинної системи та ШКТ і сприяє розвитку періопераційних ускладнень [12].
При проведенні періопераційної інфузійної терапії перевагу слід віддавати програмі збалансованої інфузійної терапії на основі кристалоїдів. B.U. Wu et al. (2011) провели рандомізоване контрольоване дослідження для оцінки впливу цільового протоколу рідинної ресусцитації на показники запалення в пацієнтів із гострим панкреатитом [13]. Проведено порівняльну характеристику впливу інфузійної терапії збалансованим і звичайним фізіологічним розчином. Доведено, що через 24 години на тлі проведення інфузійної терапії збалансованим розчином рівень показників запалення вірогідно знижувався порівняно з пацієнтами, яким рідинна ресусцитація проводилася звичайним фізіологічним розчином (p = 0,035), реєстрували більш виражену динаміку зниження рівня С-реактивного білка (р = 0,02).
Настанови Міжнародної асоціації панкреатології та Американської асоціації підшлункової залози рекомендують збалансований розчин для початкової фази реанімації [14]. Ізотонічні кристалоїдні розчини для інфузії містять розчинені у воді електроліти в співвідношенні, більш-менш наближеному до складу плазми. Дотримуючись осмотичного градієнту, вода й розчинені в ній молекулярні частинки безперешкодно проходять через судинний ендотелій, у судинному просторі залишається близько 20 % введеного об’єму кристалоїдів. Тому головна мета інфузії ізотонічних кристалоїдів — це відновлення позасудинного компартменту (при позаклітинному дефіциті).
Гіперхлоремічний гіперволемічний ацидоз — це побічний ефект проведення інфузійної терапії ізотонічними розчинами кристалоїдів у великих обсягах. Для його розвитку необхідно комбінувати декілька складових: інфузію плазмозамінників на основі ізотонічного розчину NaCl, великий об’єм розчину, високу швидкість введення і/або порушення діяльності нирок.
Розчин 0,9% NaCl не є ні нормальним, ні ненормальним, ні незбалансованим. Іони натрію і хлориду частково активні, осмотичний коефіцієнт дорівнює 0,926. Фактична осмоляльність 0,9% сольового розчину становить 287 мОсм/кг Н2О, що повністю відповідає осмоляльності плазми (285–295 мОсм/кг), тому його називають фізіологічним. Однак за електролітним складом 0,9% розчин NaCl є сіллю, що складається з іона Na+ і аніона Cl– по 154 ммоль, що відрізняється від середніх показників норми плазми здорової людини. При проведенні тривалої інтенсивної терапії у хірургічних хворих інфузія розчину з великою концентрацією хлориду у великих об’ємах може призвести до розвитку гіперхлоремічного гіперволемічного ацидозу [15].
Гіперхлоремічний метаболічний ацидоз із рівнем Cl– > 114 ммоль/л асоціюється з двократним збільшенням летальності. Гіперхлоремія здатна зменшувати перфузію нирок і порушувати секрецію реніну [16]. Порушення функції нирок призводить до значних порушень гомеостазу в результаті того, що адекватно не забезпечується: підтримання сталості концентрації осмотично активних речовин в крові, участь в регуляції ОЦК і позаклітинних рідин, регуляція іонного складу крові й кислотно-лужного стану, виведення кінцевих продуктів азотистого обміну, участь у метаболізмі білків, вуглеводів і ліпідів, регуляція артеріального тиску й еритропоезу [17].
Отже, використання збалансованих розчинів для корекції втрат рідини й електролітів на сьогодні є обґрунтованим. Використання збалансованих розчинів запобігає розвитку гіперхлоремічного ацидозу, електролітного дисбалансу, знижує частоту розвитку гострої ниркової дисфункції та необхідність у проведенні замісної ниркової терапії.
До збалансованих розчинів історично належать розчин Рінгера лактату і його більш сучасні похідні. Одним із сучасних збалансованих розчинів для корекції композиційних порушень є Плазмовен® (ПрАТ «Фармацевтична фірма «Дарниця»). Цей лікарський засіб є унікальним розчином електролітів зі збалансованим складом від українського виробника.
Плазмовен® запобігає виникненню метаболічного ацидозу і є ізотонічним розчином електролітів, у якому концентрації електролітів відповідають їх плазмовим концентраціям. Він застосовується для корекції втрат зовнішньоклітинної рідини (тобто втрати води й електролітів у пропорційній кількості). Метою введення розчину є відновлення й підтримання нормальних осмотичних умов у зовнішньоклітинному й внутрішньоклітинному просторі.
До переваг Плазмовену® відносять стабілізацію КОС і запобігання розвитку метаболічного ацидозу. За аніонним складом лікарський засіб являє собою збалансовану комбінацію хлоридів, ацетатів і малатів, що запобігає виникненню метаболічного ацидозу. Плазмовен® як буфер резервної лужності містить ацетат і малат, що мають переваги порівняно з лактатом. Завдяки вмісту малату Плазмовен® підсилює детоксикаційну функцію печінки.
Висновки
1. Перебіг тяжкого ГП супроводжувався дегідратацією, що характеризувалася зниженням ОЦК у 2 рази від належного і супроводжувалася гемоконцентрацією, електролітними розладами, розвитком метаболічного ацидозу й зниженням SaO2a і SaO2v.
2. При проведенні інфузійної терапії збалансованими кристалоїдами (Плазмовен®) через 24 години на тлі вірогідного зниження показників амілази крові, діастази сечі й гематокриту крові реєстрували нормалізацію рівня Na+, Cl–, K+, pH, HCO3 сироватки крові.
3. Проведення рідинної ресусцитації збалансованими кристалоїдами (Плазмовен®) під контролем показників системної та центральної гемодинаміки протягом першої доби ІТ супроводжувалося вірогідним зростанням рівня фактичного ОЦК у хворих 1-ї і 2-ї груп на 27,3 і 26,1 %, збільшенням рівня УО і СІ на тлі зменшення вазоконстрикції та нормалізації SaO2a, що свідчило про адекватність проведення інтенсивної терапії тяжкого ГП.
Конфлікт інтересів. Не заявлений.

/28.jpg)