Журнал «Медицина неотложных состояний» Том 16, №4, 2020
Вернуться к номеру
Бiохiмiчнi показники крові щурів з інфравезикальною обструкцією при введенні біологічно активних композицій, що містять нейротрофічні фактори
Авторы: Глоба В.Ю.(1), Самбург Я.Ю.(2), Божок Г.А.(1), Легач Є.I.(1)
(1) — Інститут проблем крiобiології і кріомедицини НАН України, м. Харків, Україна
(2) — Харківська медична академія післядипломної освіти, м. Харків, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
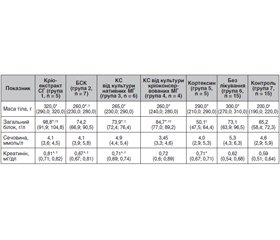
Існує багато урологічних захворювань, які супроводжуються інфравезикальною обструкцією. При цьому розвивається обструктивна уропатія, що може призводити до ниркової недостатності з подальшою інвалідизацією і загибеллю хворих. Сьогодні не існує методів лікування, які є альтернативою хронічному гемодіалізу та трансплантації нирки, що сприяють структурному і функціональному відновленню нирок. Досліджували біохімічні показники крові (рівні загального білка, сечовини, креатиніну) після введення біологічно активних композицій, що містять нейротрофічні фактори, у самок щурів з інфравезикальною обструкцією. Експериментальну модель отримували шляхом накладання лігатури на дистальний відділ сечового тракту. Як біологічно активні композиції використовували кріоекстракт спінальних гангліїв, кондиціоновані середовища від культур нативних і кріоконсервованих мантійних гліоцитів, базове середовище культивування, кортексин. Біологічно активні композиції вводили внутрішньочеревно тваринам протягом 10 днів. Визначали показники білкового й азотистого обмінів. Застосування всіх біологічно активних композицій не викликало підвищення рівнів сечовини в крові. При цьому кріоекстракт спінальних гангліїв і кондиціоновані середовища від культур нативних і кріоконсервованих мантійних гліоцитів підвищували рівень загального білка на 51,5, 13,3, 29,9 % відповідно порівняно з показниками контрольних тварин. Тільки в щурів з інфравезикальною обструкцією, яким здійснювалося введення кондиціонованого середовища від культури кріоконсервованих мантійних гліоцитів, не спостерігалося підвищення рівнів креатиніну крові, які були подібними до контрольних показників. Застосування біологічно активних композицій, що містять нейротрофічні фактори, не призводить до нефротоксичних ефектів на підставі відсутності впливу на рівні сечовини крові. Кріоекстракт спінальних гангліїв і кондиціоновані середовища від культур нативних і кріоконсервованих мантійних гліоцитів впливає на підвищення рівня загального білка крові в щурів з інфравезикальною обструкцією. Більше того, кондиціоноване середовище від культури кріоконсервованих мантійних гліоцитів демонструє відсутність впливу на основні шляхи метаболізму креатиніну при обструктивній уропатії, що обумовлена інфравезикальною обструкцією. Отже, всі вищезазначені ефекти роблять можливим застосування біологічно активних композицій зі спінальних гангліїв при нирковій патології.
Существует много урологических заболеваний, которые сопровождаются инфравезикальной обструкцией. При этом развивается обструктивная уропатия, которая может приводить к почечной недостаточности с последующей инвалидизацией и гибелью больных. В настоящее время не существует методов лечения, альтернативных хроническому гемодиализу и трансплантации почки, которые способствуют структурному и функциональному восстановлению почек. Исследовали биохимические показатели крови (уровни общего белка, мочевины, креатинина) после введения биологически активных композиций, содержащих нейротрофические факторы, у самок крыс с инфравезикальной обструкцией. Экспериментальную модель получали путем наложения лигатуры на дистальный отдел мочевого тракта. В качестве биологически активных композиций использовали криоэкстракт спинальных ганглиев, кондиционированные среды от культур нативных и криоконсервированных мантийных глиоцитов, базовую среду культивирования, кортексин. Биологически активные композиции вводили животным внутрибрюшинно на протяжении 10 дней. Определяли показатели белкового и азотистого обменов. Применение всех биологически активных композиций не вызывало повышения уровней мочевины в крови. При этом криоэкстракт спинальных ганглиев и кондиционированные среды от культур нативных и криоконсервированных мантийных глиоцитов повышали уровни общего белка на 51,5, 13,3, 29,9 % соответственно по сравнению с показателями контрольных животных. Только у крыс с инфравезикальной обструкцией, которым вводилась кондиционированная среда от культуры криоконсервированных мантийных глиоцитов, не наблюдалось повышение уровней креатинина крови, показатели которого были сходными с контрольными. Использование биологически активных композиций, содержащих нейротрофические факторы, не приводит к нефротоксическим эффектам на основании отсутствия влияния на уровни мочевины крови. Криоэкстракт спинальных ганглиев и кондиционированных сред от культур нативных и криоконсервированных мантийных глиоцитов оказывает влияние на повышение уровня общего белка крови у крыс с инфравезикальной обструкцией. Более того, кондиционированная среда от культуры криоконсервированных мантийных глиоцитов демонстрирует отсутствие влияния на основные пути метаболизма креатинина при обструктивной уропатии, обусловленной инфравезикальной обструкцией. Следовательно, все вышеперечисленные эффекты делают возможным применение биологически активных композиций из спинальных ганглиев при почечной патологии.
Infravesical obstruction occurs in many urological diseases. At the same time, obstructive uropathy develops, which can lead to renal failure with subsequent disability and death of patients. Currently, treatment methods alternative to chronic hemodialysis and kidney transplantation that contribute to the structural and functional restoration of the kidneys have not been found. Biochemical parameters of the blood (levels of total protein, urea, and creatinine) were investigated in female rats with infravesical obstruction after the administration of biologically active compositions, which contain neurotrophic factors. An experimental model was obtained by applying a ligature to the distal urinary tract. Spinal ganglia cryoextract, conditioned media from native and cryopreserved cultures of satellite cells, basic culture medium, and сortexin were used as biologically active compositions. Biologically active compositions were administered to animals intraperitoneally for 10 days. The indicators of protein and nitrogen metabolism were determined. The use of all biologically active compositions did not increase blood urea levels. At the same time, spinal ganglia cryoextract and conditioned media from native and cryopreserved cultures of satellite cells increased the levels of total protein by 51.5, 13.3 and 29.9 %, respectively, compared with the indices of control animals. Only rats with infravesical obstruction, who were injected with conditioned medium from the culture of cryopreserved satellite cells, did not show an increase in blood creatinine levels, the indices of which were similar to the control ones. The introduction of biologically active compositions containing neurotrophic factors does not lead to nephrotoxic effects due to the lack of influence on blood urea levels. Spinal ganglia cryoextract and conditioned media from native and cryopreserved cultures of satellite cells have an effect on increasing the level of total blood protein in rats with infravesical obstruction. Moreover, the conditioned medium from the culture of cryopreserved satellite cells demonstrates the absence of influence on the main pathways of creatinine metabolism in obstructive uropathy due to infravesical obstruction. Therefore, all of the above effects make it possible to use biologically active compositions from the spinal ganglia in the presence of renal pathology.
обструктивна уропатія; спінальний ганглій; мантійні гліоцити; кріоекстракт; кріоконсервування; біохімічні показники крові
обструктивная уропатия; спинальный ганглий; мантийные глиоциты; криоэкстракт; криоконсервирование; биохимические показатели крови
obstructive uropathy; spinal ganglion; satellite cells; cryoextract; cryopreservation; biochemical parameters of the blood
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Zuhirman Zamzami. Blood urea and creatinine levels in obstructive uropathy patients due to benign prostate hyperplasia after transurethral resection of the prostate. Int. J. Surg. Med. 2019. 5(1). Р. 18-22. doi:10.5455/ijsm.
- Wilson D.R. Pathophysiology of obstructive nephropathy. Kidney International [Internet]. 2015 Dec 18 [cited 2020, Jan 12]. 18(3). Р. 281-292. Available from: https://doi.org/10.1038/ki.1980. 138.
- Iqbal S., Raiz I., Faiz I. Bilateral hydroureteronephrosis with a hypertrophied, trabeculated urinary bladder. Malays J. Med. Sci. 2017. 24(2). Р. 106-115. Available from: https://doi.org/ 10.21315/ mjms2017.24.2.14.
- Chevalier R.L. Pathogenesis of renal injury in obstructive uropathy. Curr. Opin Pediatr. 2006. 18(2). Р. 153-160. doi:10.1097/01.mop.0000193287.56528.a4.
- Rayner H., Thomas M., Milford D. Understanding Kidney Diseases. Cham (Switzerland): Springer International Publishing, 2016. 300 p.
- Smith D.R., Tanagho E.A., McAninch J.W., Lue T.F. Smith and Tanagho’s general urology. 18th ed. New York (USA): McGraw-Hill Medical, 2013. 758 p.
- Oka M., Sekiya S., Sakiyama R., Shimizu T., Nitta K. Hepatocyte growth factor-secreting mesothelial cell sheets suppress progressive fibrosis in a rat model of CKD. J. Am. Soc. Nephrol. 2019. 30(2). Р. 261-276. doi: 10.1681/ASN.2018050556.
- Chaabane W., Praddaude F., Buleon M. et al. Renal functional decline and glomerulotubular injury are arrested but not restored by release of unilateral ureteral obstruction (UUO). Am. J. Physiol. Ren. Physiol. 2013. 304(4). Р. 432-439. doi: 10.1152/ ajprenal.00425.2012.
- Ruiz E., Ferraris J. 25 years of live related renal transplantation in children: the Buenos Aires experience. Indian J. Urol. [Internet]. 2007 [cited 2020, Feb 17]. 23(4). Р. 443-451. Available from: http://www.indianjurol.com/text.asp?2007/23/4/443/36720.
- Papazova D.A., Oosterhuis N.R., Gremmels H., van Koppen A., Joles J.A., Verhaar M.C. Cell-based therapies for experimental chronic kidney disease: a systematic review and meta-analysis. Disease Models & Mechanisms. 2015. 8(3). Р. 281-293. doi: 10.1242/dmm.017699.
- Sugandhi N., Srinivas M., Agarwala S. et al. Effect of stem cells on renal recovery in rat model of partial unilateral upper ureteric obstruction. Pediatr Surg. Int. 2014. 30(2). Р. 233-238. doi: 10.1007/ s00383-013-3456-8.
- Asanuma H., Vanderbrink B.A., Campbell M.T. et al. Arterially delivered mesenchymal stem cells prevent obstruction-induced renal fibrosis. J. Surg. Res. 2011. 168(1). Р. 51-59. doi: 10.1016/j.jss. 2010.06.022.
- Tsui C.C., Shankland S.J., Pierchala B.A. Glial cell line-derived neurotrophic factor and its receptor ret is a novel ligand-receptor complex critical for survival response during podocyte injury. Journal of the American Society of Nephrology. 2006. 17(6). Р. 1543-1552. doi: 10.1681/asn. 2005080835.
- Verge V.M., Gratto K.A., Karchewski L.A., Richardson P.M. Neurotrophins and nerve injury in the adult. Philosophical Transactions of the Royal Society B: Biological Sciences. 1996. 351(1338). Р. 423-30. doi: 10.1098/rstb.1996.0038.
- Пат. 64381 А Україна, МПК7 А61К35/12. Спосіб отримання екстрактів ксеногенних органів. Гальченко С.Є., Шкодовська Н.Ю., Сандомирський Б.П., Грищенко В.І.; Iнститут проблем крiобiології і кріомедицини НАН України. № 2003054649; заявл. 22.05.2003; опубл. 16.02.2004. Бюл. № 2.
- Алі С., Сидоренко О., Божок Г. Вплив складу живильного середовища на морфологічні характеристики культури клітин спінальних гангліїв неонатальних поросят. Вісник Харківського національного університету імені В.Н. Каразіна. Серія «Біологія». 2018. 30(30). Р. 49-59. doi: https://doi.org/10.26565/2075-5457-2018-30-6.
- Zhang N.Z., Ma L., Zhang J.B., Chen J. Improved model for the establishment and evaluation of detrusor overactivity in female Wistar rats. Int. Braz. J. Urol. 2014. 40(3). Р. 414-422. doi: 10.1590/ S1677-5538.IBJU.2014.03.17.
- Шавловская О.А. Клиническая эффективность нейропептидов при цереброваскулярной патологии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016. 116(8). Р. 88-93. doi: 10.17116/jnevro20161168188-93.
- Горячковский А.М. Клиническая биохимия в лабораторной диагностике. Одесса: Экология, 2005. 616 с.
- Hazel S.J., Gillespie C.M., Moore R.J., Clark R.G., Jureidini K.F., Martin A.A. Enhanced body growth in uremic rats treated with IGF-I and growth hormone in combination. Kidney International. 1994. 46(1). Р. 58-68. doi: 10.1038/ki.1994.244.
- Levin R., Chichester P., Levin S., Buttyan R. Role of angiogenesis in bladder response to partial outlet obstruction. Scand J. Urol. Nephrol. Suppl. 2004. 38(215). Р. 37-47. doi: 10.1080/ 03008880410015156.
- Barnett M.W., Fisher C.E., Perona-Wright G., Davies J.A. Signalling by glial cell line-derived neurotrophic factor (GDNF) requires heparan sulphate glycosaminoglycan. J. Cell. Sci. 2002. 115(23). Р. 4495-503. doi: 10.1242/jcs.00114.
- Emeigh Hart S.G. Assessment of renal injury in vivo. J. Pharmacol. Toxicol Methods. 2005. 52(1). Р. 30-45. doi: 10.1016/j.vascn.2005.04.006.
- Asanuma H., Vanderbrink B.A., Campbell M.T. et al. Arterially delivered mesenchymal stem cells prevent obstruction-induced renal fibrosis. J. Surg. Res. 2011. 168(1). Р. 51-59. doi: 10.1016/j.jss. 2010.06.022.
- Owoade A.O., Adetulu A., Olorunnisola O.S. Hematological and biochemical changes in blood, liver and kidney tissues under the effect of tramadol treatment. J. Alcohol. Drug. Depend. 2019. 7(5). Р. 1-7.
- Tucci Junior S., Molina C.A.F., Cassini M.F., Andrade M.F. de, Lima G.J. de, Martins A.C.P. Chronic partial urethral obstruction in female rats: description of an experimental model and initial results. Acta Cirurgica Brasileira [Internet]. 2011. 26. Suppl. 2. Р. 111-114. Available from: http://www.scielo. br/pdf/acb/v26s2/a20v26s2.pdf.
- Good D.W., Thampi G. Neurotrophin-3 inhibits HCO3-absorption via a cAMP-dependent pathway in renal thick ascending limb. Am. J. Physiol. Cell. Physiol. 2001. 281(6). Р. 1804-1811. doi: 10.1152/ajpcell.2001.281.6.C1804.
- Lin S., Lian D., Liu W. et al. Daily therapy with a slow-releasing H2S donor GYY4137 enables early functional recovery and ameliorates renal injury associated with urinary obstruction. Nitric Oxide. 2018. 76. Р. 16-28. doi: 10.1016/j.niox.2018.03.002.
- Kaid F., Alabsi A.M., Alafifi N. et al. Histological, biochemical, and hematological effects of Goniothalamin on selective internal organs of male Sprague-Dawley rats. Journal of Toxicology [Internet]. 2019 [cited 2020, Feb 17]. Available from: https://doi.org/ 10.1155/2019/6493286.
- Speakman M.J., Cheng X. Management of the complications of BPH/BOO. Indian J. Urol. [Internet]. 2014 [cited 2020, Feb 17]. 30. Р. 208-213. Available from: http://www.indianjurol. com/ text.asp?2014/30/2/208/127856.
- Zhang Z.H., He J.Q., Qin W.W., Zhao Y.Y., Tan N.H. Biomarkers of obstructive nephropathy using a metabolomics approach in rat. Chem. Biol. Interact. 2018. 296. Р. 229-239, doi: https://doi.org/ 10.1016/j.cbi.2018.10.004.
- Ronco C. Contributions to Nephrology. Basel (Switzerland): Karger, 2011. 372 p. (Herrera G.A., editor. Experimental models for renal diseases: pathogenesis and diagnosis. Vol. 169).
- Orth S.R., Ritz E., Suter-Crazzolara C. Glial cell line-derived neurotrophic factor (GDNF) is expressed in the human kidney and is a growth factor for human mesangial cells. Nephrol. Dial. Transplant. 2000. 15(5). Р. 589-595. doi: 10.1093/ndt/15.5.589.

/119.jpg)