Журнал «Практическая онкология» Том 3, №1, 2020
Вернуться к номеру
Характеристика гематологічних і біохімічних показників у хворих на рак грудної залози IIВ–IIIВ стадій з пізніми променевими ускладненнями
Авторы: Гладких Ф.В., Кулініч Г.В., Севастьянова В.С.
Державна установа «Інститут медичної радіології та онкології імені С.П. Григор’єва Національної академії медичних наук України», м. Харків, Україна
Рубрики: Онкология
Разделы: Клинические исследования
Версия для печати
Мета роботи — провести порівняльний аналіз значення вихідних гематологічних і біохімічних показників хворих на рак грудної залози (РГЗ) ІІВ–ІІІВ стадій з пізніми променевими ускладненнями (ППУ) та без них. Матеріали та методи. Проведено ретроспективний аналіз 81 історії хвороби пацієнток із злоякісними новоутвореннями грудної залози (45 хворих з ППУ та 36 хворих без ППУ після променевої терапії (ПТ)), які перебували на стаціонарному лікуванні у ДУ «Інститут медичної радіології ім. С.П. Григор’єва НАМН України» за період 1994–2018 рр., лікувальна тактика в яких включала проведення ПТ. Сформовано дві групи хворих на РГЗ ІІВ–ІІІВ стадій: І (23 особи — хворі з ППУ) та ІІ (22 особи — хворі без ППУ). Результати. Характеризуючи гематологічні показники хворих на РГЗ ІІВ–ІІІВ стадій, варто зазначити, що у хворих з ППУ після ПТ відмічене зниження (р = 0,1) кількості еритроцитів на 6,7 % (3,80 ± 0,11 × 1012/л) та зниження рівня гемоглобіну (р = 0,09) на 6,1 % (114,50 ± 2,53 г/л) відносно вихідних показників. Аналіз біохімічних показників продемонстрував, що у хворих на РГЗ ІІВ–ІІІВ стадій з ППУ мали місце вищі показники загального білка (на 9,9 %, р = 0,04), білірубіну (на 6,2 %, р = 0,5), глюкози (на 9,1 %, р = 0,09) та амінотрансфераз (аланінамінотрансферази (АлАт) на 8,6 %, р = 0,4, аспартатамінотрансферази (АсАт) на 31,9 %, р = 0,005) відносно показників пацієнток контрольної групи. Оцінюючи показники системи згортання крові, слід зазначити, що у хворих на РГЗ ІІВ–ІІІВ стадій з ППУ відмічено вищий час згустка (р = 0,4) на 17,9 % та статистично вірогідно (р = 0,03) вищий на 23,3 % рівень фібриногену. Висновки. Встановлено, що у 78,30 ± 0,09 % хворих на РГЗ ІІІВ–ІІІВ з ППУ діагностовано запальні, у 47,8 ± 0,1 % хворих — фібротичні, у 13,00 ± 0,07 % хворих — гематологічні та у 4,30 ± 0,04 % — дегенеративні зміни. Виявлено, що у структурі супутніх захворювань у хворих на РГЗ ІІІВ–ІІІВ стадій найчастіше діагностуються хвороби серцево-судинної системи (78,0–84,4 %), хвороби органів травлення (33,3–44,4 %) та захворювання нервової системи (36,1–42,2 %). Показано, що з числа гематологічних показників у хворих на РГЗ ІІВ–ІІІВ стадій з ППУ був вищим вихідний рівень гематокриту (37,0 [34,8; 38,4] %) (р = 0,09) на 9,7 %, кількість лейкоцитів (5,8 [4,8; 6,5] × 109/л) була вищою (р = 0,1) на 6,1 %, а швидкість осідання еритроцитів (16 [6; 18] мм/год) була вищою (р = 0,1) на 60,0 % відносно вихідних показників хворих без ППУ. Відмічено, що з числа біохімічних показників у хворих на РГЗ ІІВ–ІІІВ стадій з ППУ мали місце вищі показники загального білка (на 9,9 %, р = 0,04), білірубіну (на 6,2 %, р = 0,5), глюкози (на 9,1 %, р = 0,09) та амінотрансфераз (АлАт на 8,6 %, р = 0,4, АсАт на 31,9 %, р = 0,005) відносно показників пацієнток без ППУ.
Цель работы — провести сравнительный анализ значения исходных гематологических и биохимических показателей больных раком молочной железы (РМЖ) ІІВ–ІІІВ стадий с поздними лучевыми осложнениями (ПЛО) и без них. Материалы и методы. Проведен ретроспективный анализ 81 истории болезни пациенток со злокачественными новообразованиями молочной железы (45 больных с ПЛО и 36 больных без ПЛО после лучевой терапии (ЛТ)), находившихся на стационарном лечении в ГУ «Институт медицинской радиологии им. С.П. Григорьева НАМН Украины» за период 1994–2018 гг., лечебная тактика у которых включала проведение ЛТ. Сформированы две группы больных РМЖ ІІВ–ІІІВ стадий: I (23 человека — больные с ПЛО) и II (22 человека — больные без ПЛО). Результаты. Характеризуя гематологические показатели больных РМЖ ІІВ–ІІІВ стадий, стоит отметить, что у больных с ПЛО после ЛТ отмечено снижение (р = 0,1) количества эритроцитов на 6,7 % (3,80 ± 0,11 × 1012/л) и снижение уровня гемоглобина (р = 0,09) на 6,1 % (114,50 ± 2,53 г/л) относительно исходных показателей. Анализ биохимических показателей продемонстрировал, что у больных РМЖ ІІВ–ІІІВ стадий с ПЛО имели место более высокие показатели общего белка (на 9,9 %, р = 0,04), билирубина (на 6,2 %, р = 0,5), глюкозы (на 9,1 %, р = 0,09) и аминотрансфераз (аланинаминотрансферазы (АлАт) на 8,6 %, р = 0,4, аспартатаминотрансферазы (АсАт) на 31,9 %, р = 0,005) относительно показателей пациенток контрольной группы. Оценивая показатели свертывающей системы крови, следует отметить, что у больных РМЖ ІІВ–ІІІВ стадий с ПЛО отмечено высшее время сгустка (р = 0,4) на 17,9 % и статистически достоверно (р = 0,03) высший на 23,3 % уровень фибриногена. Выводы. Установлено, что у 78,30 ± 0,09 % больных РМЖ ІІВ–ІІІВ стадий с ПЛО диагностированы воспалительные, у 47,8 ± 0,1 % больных — фибротические, у 13,00 ± 0,07 % больных — гематологические и у 4,30 ± 0,04 % — дегенеративные изменения. Выявлено, что в структуре сопутствующих заболеваний у больных РМЖ ІІВ–ІІІВ стадий чаще диагностируются болезни сердечно-сосудистой системы (78,0–84,4 %), болезни органов пищеварения (33,3–44,4 %) и заболевания нервной системы (36,1–42,2 %). Показано, что из числа гематологических показателей у больных РМЖ ІІВ–ІІІВ стадий с ПЛО был выше исходный уровень гематокрита (37,0 [34,8; 38,4] %) (р = 0,09) на 9,7 %, количество лейкоцитов (5,8 [4,8; 6,5] × 109/л) было выше (р = 0,1) на 6,1 %, а скорость оседания эритроцитов (16 [6, 18] мм/ч) была выше (р = 0,1) на 60,0 % относительно исходных показателей больных без ПЛО. Отмечено, что из числа биохимических показателей у больных РМЖ ІІВ–ІІІВ стадий с ПЛО имели место более высокие показатели общего белка (на 9,9 %, р = 0,04), билирубина (на 6,2 %, р = 0,5), глюкозы (на 9,1 %, р = 0,09) и аминотрансфераз (АлАт на 8,6 %, р = 0,4, АсАт на 31,9, р = 0,005) относительно показателей пациенток без ПЛО.
The aim of the work is to conduct a comparative analysis of the values of initial hematological and biochemical parameters of patients with breast cancer of stages IIB–IIB with and without late radiation complications (LRC). Materials and methods. There was performed a retrospective analysis of 81 medical histories of female patients with breast cancer (45 patients with LRC and 36 patients without LRC after radiation therapy) who received in-patient treatment at Grigoriev Institute for Medical Radiology and Oncology of the NAMN of Ukraine for the period 1994–2018, including radiation therapy. Two groups of patients with stage IIIB–IIIB breast cancer were formed: I (23 patients with LRC) and II (22 patients without LRC). Results. Characterizing the hematologic indices of patients with IIB–IIIB stages breast cancer, it should be noted that patients with LRC after radiation therapy were found to have decreased (p = 0.1) red blood cell count by 6.7 % (3.80 ± 0.11 × 1012/l) and decreased hemoglobin level (p = 0.09) by 6.1 % (of 114.50 ± 2.53 g/l) compared to baseline values. The analysis of biochemical indicators showed that patients with stage IIIB–IIIB breast cancer with LRC had higher values of total protein (by 9.9 %, p = 0.04), bilirubin (by 6.2 %, p = 0.5), glucose (by 9.1, p = 0.09) and aminotransferases (ALT by 8.6 %, p = 0.4, ASAT by 31.9, р = 0.005) compared to the values of patients in the control group. When evaluating the indicators of the blood clotting system, it should be noted that patients with stage IIIB–IIIB breast cancer with LRC had a higher clotting time (p = 0.4) by 17.9 % and a statistically significantly (p = 0.03) higher level of fibrinogen by 23.3 %. Conclusions. It was found that 78.30 ± 0.09 % of patients with IIIB–IIIB breast cancer with LRC were diagnosed with inflammatory changes, 47.8 ± 0.10 % of patients — with fibrotic, 13.00 ± 0.07 % of patients — with hematological and 4.30 ± 0.04 % — with degenerative changes. It was found that in the structure of concomitant diseases in patients with stage III–III breast cancer, cardiovascular diseases (78.0–84.4%), diseases of the digestive system (33.3–44.4 %) and nervous system (36.1–42.2 %) are most often diagnosed. It was shown that the initial level of hematocrit was higher among the hematological indicators in patients with stage IIIB–IIIB breast cancer with LRC (37.0 [34.8; 38.4] %) (p = 0.09) by 9.7 %, the content of white blood cells (5.8 [4.8; 6.5] × 109/l) was higher (p = 0.1) by 6.1 %, and ESR (16 [6; 18] mm/h) was higher (p = 0.1) by 60.0 % compared to the baseline parameters of patients without LRC. The analysis of biochemical indicators showed that patients with stage IIIB–IIIB breast cancer with LRC had higher values of total protein (by 9.9 %, p = 0.04), bilirubin (by 6.2 %, p = 0.5), glucose (by 9.1, p = 0.09) and aminotransferases (ALT by 8.6 %, p = 0.4, ASAT by 31.9, р = 0.005) compared to the values of patients without LRC.
рак грудної залози; променева терапія; пізні променеві ускладнення
рак грудной железы; лучевая терапия; поздние лучевые осложнения
breast cancer; radiation therapy; late radiation complications
Вступ
Матеріали та методи
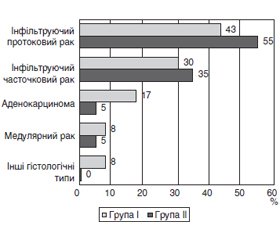
Результати та обговорення
Висновки
1. Гайсенюк Л.О., Аміразян С.А., Толкачов Ю.А. Стан кардіальної системи в онкологічних хворих у віддалений термін після променевого та комплексного лікування. Український радіологічний журнал. 2004. Т. ХІІ. Вип. 2. С. 154-157.
2. Гайсенюк Л.О., Кулініч Г.В., Мороз В.А. Клініко-рентгенологічна семіотика пізніх променевих ускладнень легень у онкологічних хворих. Український радіологічний журнал. 2003. Т. XI. Вип. 2. С. 164-166.
3. Криворотько П.В., Зернов К.Ю., Дашян Г.А., Комяхов А.В. и др. Влияние системной и лучевой терапии на осложнения при онкопластической хирургии рака молочной железы. Вопросы онкологии. 2018. Т. 64. № 3. С. 298-302.
4. Криворотько П.В., Зернов К.Ю., Дашян Г.А., Новиков С.Н., Жильцова Е.К., Комяхов А.В. и др. Место и время лучевой терапии у больных раком молочной железы после реконструктивных операций. Злокачественные опухоли. 2018. № 3. С. 22-26.
5. Лечение рака молочной железы: клинико-биологическое обоснование. Под ред. Семиглазова В.Ф., Семиглазова В.В. М.: СИМК, 2017. 272 с.
6. Рак в Україні, 2017–2018. Захворюваність, смертність, показники діяльності онкологічної служби. За ред. Колеснік О.О. К., 2019. 101 с.
7. Роздільський С.І., Гайсенюк Л.О., Мороз В.А. Діагностика та лікування ранніх променевих ускладнень. Методичні рекомендації. Харків, 2002. 25 с.
8. Савченко А.С. Непосредственные и отдаленные результаты профилактики и лечения нарушений состояния сердечно-сосудистой системы у больных раком грудной железы и сопутствующей кардиологической патологией. Проблеми медичної науки та освіти. 2007. № 4. С. 80-83.
9. Смоланка І.І., Іванкова В.С., Скляр С.Ю., Іванкова О.М. Застосування модифікаторів — шлях до підвищення ефективності лікування хворих на первинно неоперабельний рак грудної залози. Клінічна онкологія. 2012. № 6(2). С. 38-43.
10. Сорочан П.П., Громакова И.А., Сухина Е.Н., Прохач Н.Э., Громакова И.С. Роль цитокинов в развитии гематологических осложнений у больных онкологического профиля. Клиническая онкология. 2015. № 2(18). С. 34-37.
11. Топузов Э.Э., Агишев Т.Т., Божок А.А., Дашян Г.А., Садыгова С.Н., Приходько Е.В., Аршба Э.А. Клинико-морфологическая характеристика повреждений кожи и подкожно-жировой клетчатки после хирургического лечения и лучевой терапии у больных раком молочной железы (обзор литературы). Маммология. 2017. Т. 13. № 21. С. 25-33.
12. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги «Рак молочної залози» (Наказ МОЗ України від 30 червня 2015 р. № 396). Медичні аспекти здоров’я жінки. 2015. № 8(94). С. 41-74.
13. Coles C.E. Reduction of radiotherapy-induced late complications in early breast cancer: the role of intensity-modulated radiation therapy and partial breast irradiation: part II-radiotherapy strategies to reduce radiation-induced late effects. Clinical oncology. 2005. Vol. 17. № 2. P. 98-110.
14. Collette S., Collette L., Budiharto T. Predictors of the risk of fibrosis at 10 years after breast conserving therapy for early breast cancer: a study based on the EORTC Trial 22881-10882 ‘boost versus no boost. Eur. J. Cancer. 2008. Vol. 44. № 17. P. 2587-2599.
15. See M.S.F., Farhadi J. Radiation Therapy and Immediate Breast Reconstruction: Novel Approaches and Evidence Base for Radiation Effects on the Reconstructed Breast. Clinics in Plastic Surgery. 2017.
16. Zar J.H. Biostatistical analysis. 5 ed. Prentice-Hall, Englewood. 2014. 960 р.

/7_2.jpg)
/7.jpg)
/8.jpg)
/9.jpg)
/10.jpg)
/11.jpg)