Вступ
Сколіотична деформація хребта призводить до багатьох патологічних змін та впливає на основні органи та системи організму. Зміни, що відбуваються в організмі пацієнта, ставлять перед анестезіологом непрості завдання для їх компенсації. Насамперед це декомпенсація системи дихання за рестриктивним типом. Спотворення геометрії, зменшення рухомості грудної клітки та податливості легеневої паренхіми призводять до зниження життєвої ємності легень, що спричиняє збільшення роботи дихання, в результаті чого з’являється дихальна недостатність. Деформація хребта та грудної клітки призводить до компресії судин легень, легеневої гіпертензії та правошлуночкової серцевої недостатності. У пацієнтів із рестриктивними ураженнями легень спостерігається зниження форсованої життєвої ємкості легень (ФЖЄЛ), об’єму форсованого видиху за першу секунду (ОФВ1), співвідношення ОФВ1 до ФЖЄЛ та загальної ємності легень. Серед всіх цих показників ОФВ1/ФЖЄЛ є найбільш важливим у прогнозуванні тяжкості відлучення пацієнта від апарату штучної вентиляції легень (ШВЛ). До не менш важливих передопераційних предикторів подовженої ШВЛ відносять ОФВ1 та ФЖЄЛ менше 40 % від належних, нервово-м’язовий сколіоз, кут Кобба більше 75–77°, виражену легеневу гіпертензію та правошлуночкову серцеву недостатність.
Не менш небезпечні зміни відбуваються і в серцево-судинній системі. Через зміни геометрії грудної клітки, а також, нерідко, супутнє ураження міокарда спостерігається синусова тахікардія та/або порушення провідності у вигляді блокад на різних рівнях провідникової системи серця. Часто на електрокардіограмі (ЕКГ) спостерігаються зміни інтервалу ST, високий зубець R у V1 та зубець Q у лівих грудних відведеннях. У деяких пацієнтів із боку анатомії серця діагностується пролапс мітрального клапана. Тому ехокардіографія (ЕхоКГ), ЕКГ та консультація кардіолога в доопераційному періоді обов’язкові. У пацієнтів зі сколіозами внаслідок синдрому Марфана спостерігаються недостатність мітрального та/або аортального клапана, аневризми висхідного відділу аорти. У пацієнтів зі сколіозами внаслідок міодистрофії Дюшена можуть розвинутися дилатаційна кардіоміопатія, порушення провідності й аритмії (до 14 років — у третини, після 18 — практично у всіх). Тому важливо провести максимально повноцінний збір анамнезу життя та хвороби пацієнта та призначити повний спектр лабораторних та інструментальних методів обстеження (розгорнута спірометрія, рентгенографія шийного відділу хребта й органів грудної клітки, газовий склад крові, ЕКГ та ЕхоКГ, загальний аналіз крові та сечі, коагулограма, стан обміну заліза, вміст вітаміну В12 та фолієвої кислоти, біохімічний профіль), залучити до підготовки пацієнта суміжних спеціалістів (кардіолога, пульмонолога, ендокринолога, невролога).
Крім проблем, пов’язаних із патологічними змінами в організмі, існують особливості проведення самого операційного втручання, що потребує великої уваги з боку анестезіолога. По-перше, це позиціонування пацієнта на операційному столі в положенні на животі. При неправильному укладанні пацієнта відбувається компресія черевної порожнини і, відповідно, нижньої порожнистої вени, що може призвести до затрудненого відтоку крові від епідуральних вен та збільшити крововтрату. Існують ризики пошкодження рогівки ока та плечових суглобів, тому необхідно повертати голову пацієнта кожні дві години або використовувати спеціальні подушки. По-друге, це велика інтраопераційна крововтрата, що може сягати 1500–3500 мл. Вени хребта мають досить розгалужену сітку і розташовуються у вигляді сплетень впродовж усього хребта, як зовні, так і всередині, вони приймають вени з тіл хребців, спинного мозку та його оболонок. Зупинити кровотечу з цих вен та сплетень хірургу досить складно, тому максимальна кількість заходів повинна бути спрямована на запобігання кровотечі з них з урахуванням значної тривалості та травматичності операції, яка може сягати 6–7 годин, що часто призводить до тяжких інтра- та післяопераційних ускладнень. Не менш важливим фактором є величина металоконструкції, що може призвести до пошкодження центральної та периферичної нервової системи, а також те, що під час виконання деротаційного маневру часто виникає порушення серцевого ритму.
Більшість операційних втручань проводять із використанням нейрофізіологічного моніторингу (моніторинг викликаних потенціалів) або із застосуванням wake up test, що обмежує анестезіолога у використанні релаксантів та вимагає чіткого та правильного підбору доз анестетиків, щоб забезпечити достатнє знеболювання, не передозовуючи препаратами пацієнта.
Мета роботи: адаптувати періопераційний менеджмент хірургічної корекції сколіотичної деформації хребта до рекомендацій ERAS та запровадити фармакокінетичний/фармакодинамічний (ФК/ФД) підхід при дозуванні препаратів для анестезії. Спілкою ERAS® опубліковано багато протоколів для періопераційного ведення пацієнтів у різних галузях медицини. Хірургічна корекція сколіозів, на нашу думку, потребує окремо розробленого протоколу ведення таких пацієнтів, тому що сколіотичні деформації мають свої особливості як оперативного лікування, так і анестезіологічного забезпечення пацієнтів.
Матеріали та методи
У 2018–2020 роках в Обласному центрі ортопедії, травматології та вертебрології Рівненської обласної клінічної лікарні було проведено 40 планових операцій із приводу сколіотичних та інших деформацій хребта. Пацієнти були розподілені на дві групи залежно від методу дозування та введення фентанілу інтраопераційно:
— 1-ша — пацієнти, яким фентаніл вводився кожні 15–20 хв у дозі 100–200 мкг;
— 2-га — пацієнти, яким фентаніл вводився інфузійно до досягнення концентрації в місці дії — 3–6 нг/мл.
Фізичний статус пацієнтів за класифікацією ASA не перевищував другий клас. Середній індекс маси тіла був у межах 26,64 кг/м2.
Усі пацієнти отримували однакову підготовку до операції. У премедикації застосовували парацетамол, декскетопрофен, ондансетрон, дифенгідрамін, дексаметазон, атропін, транексамову кислоту. Для індукції вводили пропофол, тіопентал, фентаніл, атракурію безилат, суксаметонію йодид. Після преоксигенації проводили інтубацію трахеї в покращеному положенні, далі пацієнта перевертали на живіт та проводили специфічне укладання пацієнта для запобігання компресії черевної порожнини. Операцію проведено під загальною інгаляційною анестезією севофлураном та інфузією дексмедетомідину. Пацієнтам, яким проводили нейромоніторинг, релаксанти вводили лише для інтубації трахеї.
Здійснювали моніторинг показників артеріального, систолічного та діастолічного тиску, середнього артеріального тиску, частоти серцевих скорочень, пульсоксиметрію.
З метою знеболювання в післяопераційному періоді пацієнти планово та погодинно отримували нестероїдні протизапальні препарати (парацетамол у комбінації з декскетопрофеном), проводили тромбопрофілактику залежно від ступеня ризику.
Оцінювалась кількість введеного фентанілу за годину операції, а також фіксувався час відлучення пацієнта від апарату ШВЛ.
Розрахунок швидкості введення препаратів для анестезії проводився за допомогою програмного забезпечення iTIVA plus Anesthesia. Оцінку вірогідності відмінностей середніх величин проводили за критеріями Стьюдента та Манна — Уїтні. Рівень значущості відмінностей прийнятий за р < 0,05.
Результати та обговорення
Сколіоз є складною деформацією хребта, яка призводить до його бічного вигину та ротації, що супроводжується деформацією грудної клітки. Існують такі види сколіозів: ідіопатичний, нервово-м’язовий, вроджений, синдромний та набутий. Найбільш поширеною формою сколіозу (близько 65 %) є ідіопатична. Сколіотична деформація вражає обидві статі, підрозділяється за віком встановлення діагнозу — інфантильний, ювенільний, підлітковий та сколіоз дорослого. При розвитку нервово-м’язового (паралітичного) сколіозу знижується сила м’язів, а паралітичні та спастичні явища унеможливлюють утримання хребта в правильному положенні, що призводить до сколіотичної деформації. До основних причин виникнення нервово-м’язового (паралітичного) сколіозу належать нейропатії (верхній моторний нейрон — дитячий церебральний параліч, нижній моторний нейрон — поліомієліт, сирингомієлія) та міопатії. Найрідше зустрічається вроджений сколіоз, який спричиняється дефектами формування хребців та ребер, у половини випадків пов’язаний з іншими вродженими аномаліями (VACTERL — Vertebral, Anorectal, Cardiovascular, Tracheoesophageal, Esophageal, Renal, Limb аномалії). Синдромний сколіоз спостерігається як складова частина різних синдромів (синдром Марфана, синдром Елерса — Данлоса, Osteogenesis imperfecta, нейрофіброматоз та VACTERL-асоціації) [1–3].
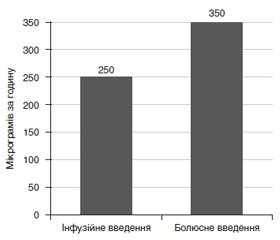
У результаті порівняння двох методів дозування та введення фентанілу отримали статистично вірогідні відмінності в кількості введеного препарату за годину операції (рис. 1). Так, при дозуванні фентанілу за цільовою концентрацією та інфузійному введенні його кількість становила 250 ± 50 мкг за годину, що значно відрізнялося від кількості введеного препарату шляхом болюсних ін’єкцій — 350 ± 50 мкг за годину.
Теж значуще відрізнялася тривалість відлучення від апарату ШВЛ (рис. 2). При введенні фентанілу інфузійно за цільовою концентрацією тривалість післяопераційної ШВЛ була в межах 14,2 ± 2,1 хв на відміну від болюсного введення, коли вона сягала 25,3 ± 6,8 хв.
На основі доступних джерел інформації ми пропонуємо наступну стратегію ведення пацієнтів, яким необхідна хірургічна корекція сколіотичної та інших деформацій хребта. Будь-який протокол ERAS складається з трьох частин — передопераційної підготовки, інтраопераційного ведення пацієнта та післяопераційної реабілітації.
На передопераційному етапі до найбільш важливих завдань анестезіолога належать підготовка пацієнта до оперативного втручання, а саме:
1. Інформування пацієнта про операцію, анестезію та реабілітацію, навчання пацієнта правильній поведінці на операційному столі та в післяопераційному періоді (переконати пацієнта в безпечності wake up test).
2. Повноцінне харчування пацієнта, ніякого голодування. Забезпечити прозору солодку рідину за 2 години до операції та тверду їжу за 6 годин.
3. Антибіотикопрофілактика за годину до розрізу шкіри та до постановки центрального венозного катетера та сечового катетера. Повторна доза антибіотиків залежно від ходу операції та її тривалості. Група антибіотиків може відрізнятися, застосовується в основному друге покоління цефалоспоринів або амоксиклав. Обробку шкіри проводити спиртовим розчином хлоргексидину.
4. Тромбопрофілактика обов’язкова залежно від ступеня ризику. Якщо пацієнт приймає пероральні антикоагулянти, перевести на підшкірне або внутрішньовенне введення антикоагулянтів, які мають короткий період дії (Bridging therapy anticoagulation) [5].
5. Ніякої премедикації седативними препаратами.
6. Ніякої механічної підготовки шлунково-кишкового тракту.
7. Відмова від алкоголю та тютюну на 4 тижні.
8. Старанна підготовка хворого до можливої масивної крововтрати. Рекомендувати призначення еритропоетину, препаратів заліза, фолієвої кислоти та вітаміну В12 до оперативного втручання. Розглянути можливість заготовки автокрові для трансфузії в час операції.
9. Ретельна оцінка стану дихальної та серцево-судинної системи.
10. Активний спосіб життя до операції, госпіталізація в день операції.
Найважливіший етап періопераційного менеджменту — це інтраопераційне ведення пацієнта. На цьому етапі необхідно забезпечити:
1. Короткодіючі анестетики із підбором дози за цільовою концентрацією для швидкого пробудження після анестезії. Препарати вибору — пропофол у комбінації з дексмедетомідином. Севофлуран не протипоказаний, але при застосуванні необхідно використовувати з паралельною інфузією дексмедетомідину для зниження МАС (для зменшення впливу севофлурану на нейрофізіологічний моніторинг).
2. Мультимодальна анестезія з парацетамолом та декскетопрофеном до операції та кожні 6 годин далі. Розглянути можливість внутрішньовенної інфузії лідокаїну в дозі 1,5–2,0 мг/кг/год. Прегабаліни до операції теж демонструють непоганий знеболюючий ефект, проте мають низку негативних наслідків та потребують високих доз [6].
3. Забезпечити мінімум два периферичні венозні доступи з катетером діаметром не менше 16–18G без рутинного використання центрального венозного катетера. Якщо все ж таки існує необхідність у постановці центрального венозного катетера, надати перевагу яремній вені під ультразвуковим контролем.
4. Короткодіючі релаксанти для інтубації. При використанні нейромоніторингу не виключене проведення анестезії без використання релаксантів для забезпечення проведення викликаних потенціалів.
5. Нормотермія. Забезпечити підігрів хворих на будь-яку маніпуляцію: до подачі в операційну, під час інтубації, впродовж всієї операції та в післяопераційному періоді. Забезпечити підігрів інфузійних розчинів. Процес зсідання крові, як і кожна біохімічна реакція, є термозалежним процесом, тому інтраопераційна гіпотермія призводить до збільшення крововтрати, периферичний спазм — до погіршення мікроциркуляції, а м’язовий тремор — до значного збільшення потреби в кисні.
6. BIS-моніторинг, інвазивне вимірювання артеріального тиску та моніторинг церебральної оксигенації, моніторинг нервово-м’язової провідности.
7. Збалансована та цільова інфузійна терапія, не перенавантажувати пацієнта рідиною [7]. Постійна та ретельна оцінка об’єму втраченої крові. При крововтраті проводити рестриктивну інфузійну терапію до зупинки кровотечі. Розпочати інфузію транексамової кислоти до оперативного втручання. Забезпечити контрольовану гіпотензію, однак не знижаючи середній артеріальний тиск нижче 70 мм рт.ст., для забезпечення адекватної перфузії життєво важливих органів. Уникати тривалої гіпотонії та, що дуже важливо, при хірургічній корекції сколіозів забезпечити нормальний артеріальний тиск чи навіть дещо підвищений під час самої корекції сколіозу та деротаційного маневру. На цьому етапі оперативного втручання необхідно запобігти ішемії спинного мозку та його корінців.
8. Проводити корекцію крововтрати збалансованими кристалоїдами. Не використовувати гіперосмолярний та фізіологічний розчин, уникати колоїдів. За наявності — використання тромбоеластографії. Розпочати гемотрансфузію при гемоглобіні 70–90 г/л. Розглянути необхідність застосування фібриногену або кріоприцепітату при фібриногені крові менше 1,5 г/л. Не забувати про призначення еритропоетину, заліза, вітамінів В, С та фолієвої кислоти у відновному періоді.
9. З урахування вихідної дихальної недостатності вкрай важливою є протективна штучна вентиляція легень. Підтримувати Driving pressure менше 12–14 см H2O впродовж усього операційного втручання. Контроль газів крові та КЛС після повороту на живіт та кожні дві години в подальшому.
10. Забезпечити правильне положення пацієнта на столі. Для зменшення внутрішньоочного тиску голова може бути піднята під кутом близько 10°. Важливо не перетискати черевну порожнину, плечі не повинні бути відведеними під кутом більше 90°.
Останній етап, проте не менш важливий, — це післяопераційне ведення пацієнта. На цьому етапі важливо:
1. За відсутності протипоказань та ускладнень під час проведення операції та анестезії необхідне раннє відлучення від апарату штучної вентиляції легень. Це легко досягається при виконанні всіх попередніх рекомендацій.
2. Профілактика нудоти та блювання.
3. Не перенавантажувати рідиною, збалансована та цільова інфузійна терапія.
4. Раннє видалення катетерів — уретрального, центрального венозного та периферичного. Розглядати кожен із них як потенційне джерело інфікування.
5. Раннє пероральне харчування, бажано в день оперативного втручання.
6. Мультимодальна анестезія. Найкращий шлях введення знеболюючих — пероральний.
7. Забезпечити ранню мобілізацію, найкраще за дві години після оперативного втручання.
8. Аудит та контроль за випискою пацієнта та розвитком ускладнень, раннє переведення на амбулаторне лікування.
У забезпеченні кінцевої мети у вигляді зменшення кількості ускладнень та ранньої виписки пацієнта зі стаціонару не останню роль відіграють дозування, швидкість та тривалість інфузії препаратів для анестезії. Ураховуючи вищесказане, ми пропонуємо запровадити використання ФК/ФД підходів для дозування деяких препаратів — фентанілу, пропофолу, дексмедетомідину. Такий підхід дозволяє оперативно та точно, згідно з парадигмами precision medicine та personalized medicine [8], вибирати режим дозування для конкретного пацієнта індивідуально та відповідно до особливостей операційного втручання та його етапу. Під час хірургічної корекції сколіотичної деформації це виключно важливо, оскільки мінімальне передозування або неправильний підбір дози анестетика ускладнить моніторинг викликаних потенціалів (нейрофізіологічний моніторинг) чи застосування wake-up-тесту.
ФК/ФД підхід поєднує два методи: фармакокінетичний — для визначення концентрації препарату в місці дії в конкретного пацієнта в будь-який момент часу і прогнозування його розвитку та фармакодинамічний — для оцінки ймовірності бажаного ефекту від розрахованої концентрації в місці дії в той же самий момент часу. Взаємодія препаратів, ефекти яких підсилюються фармакокінетично (фентаніл, наприклад, витісняє пропофол із зв’язку з білками крові) та фармакодинамічно (синергічна пригнічуюча дія опіатів та гіпнотиків на центральну нервову систему), також оцінюється кількісно та прогнозується в часі. Для анестезіологічних препаратів, що мають вузький терапевтичний проміжок, серйозні побічні дії і в яких відсутні надійні клінічні ознаки сили дії (артеріальний тиск та частота серцевих скорочень є сурогатними показниками), такий підхід є виключно важливим. На перший погляд, рішення фармакокінетичної складової просте: потрібно лише розрахувати навантажувальну дозу, абстрагувавши популяційні параметри конкретного пацієнта до якогось об’єму, і далі за допомогою інфузії чи повторних болюсних введень компенсувати кліренс (метаболізм та екскрецію) цього препарату. В дійсності анестезіолог стикається зі значно складнішою ситуацією, тому що препарати перерозподіляються до тканин та органів відповідно до їх перфузії та фізико-хімічних властивостей конкретного препарату. Здебільшого це описується тривимірною моделлю, де препарат, введений у судинне русло, перерозподіляється до добре перфузованого об’єму з невеликою ємністю й одночасно до слабоперфузованого об’єму великої ємності. Оскільки в судинному руслі діють хіба що препарати, які впливають на зсідання крові, чи вазоактивні медикаменти, існує гістерезис між введенням препарату та його дією (пік дії фентанілу — 3,6 хв, пропофолу — 2,2 хв, а ось для дексмедетомідину — 16 хв чи морфіну — 19 хв), і тому для його оцінки вводиться термін «додатковий об’єм» (або «біофаза» чи «місце дії»). Традиційний підхід до визначення концентрацій у рівноважному стані для анестезіології є неприйнятним ні за часом, ні за дозами, тому режим дозування анестезіологічних препаратів розраховується для псевдорівноважного стану, що стало можливим порівняно нещодавно, оскільки це вимагає складних фармакокінетичних розрахунків і постійної корекції режимів введення (ситуація чимось аналогічна до польоту сучасного винищувача, який є аеродинамічно нестійким і утримується в польоті завдяки безперервній корекції параметрів польоту, але це дає йому можливість за потреби швидко поміняти траєкторію польоту). Із розвитком інформаційних технологій ці розрахунки стали доступні в реальному масштабі часу безпосередньо біля пацієнта.
Зі стрімким розвитком сучасної фармакології анестезіологу стають доступні нові цікаві анестетики та їх ад’юванти. Одним із найбільш перспективних є дексмедетомідин. Проте чітке розуміння саме фармакодинаміки та фармакокінетики дозволяє чітко визначити, скільки, як довго та як швидко проводити інфузію. З одного боку, дексмедетомідин — цінний компонент анестезії для подібних операцій, що дозволяє комфортно проводити wake-up-тест, контрольовану гіпотензію, зменшити потребу в опіатах та знизити системну запальну відповідь. З іншого — дексмедетомідин ускладнює проведення моніторингу викликаних потенціалів. У дослідженні Mahmoud [11] було показано, що надійний моніторинг викликаних потенціалів забезпечувався при цільовій концентрації дексмедетомідину нижче 0,4–0,6 нг/мл. Загальноприйнятий режим дозування дексмедетомідину (1 мг/кг за 10 хвилин, в подальшому — 0,5 мкг/кг/год) дає спочатку надто великий пік концентрації як у плазмі крові, так і в місці дії (2,36 та 1,35 нг/мл), який тільки протягом години знижується до 0,7 нг/мл, що є неприйнятним для моніторингу викликаних потенціалів. Також застосування дексмедетомідину за відсутності ФК/ФД підходу значно ускладнюється тою обставиною, що даний препарат має дуже великий гістерезис. Ураховуючи всі перераховані вище обставини, ми пропонуємо використовувати дексмедетомідин у комбінації з іншими анестетиками, які вводяться паралельно (пропофол, севофлуран). Це дозволяє використати менші концентрації кожного з них, одночасно поліпшивши якість анестезії.
Середні величини цільових концентрацій згаданих препаратів, на які ми орієнтуємось та які ми використовуємо, такі:
1. Фентаніл (Shafer, 1990 [14]):
— Анальгезія — 1–2 нг/мл.
— Ларингоскопія, інтубація трахеї, розріз шкіри — 4–5 нг/мл.
— Найбільш травматичні моменти операції — 6–8 нг/мл (більше підвищувати не має сенсу, оскільки ізобола взаємодії «гіпнотик — опіат» виходить на горизонтальну ділянку).
— Відновлення самостійного дихання — менше 2 нг/л.
2. Пропофол (Eleveld, 2018 [15]; варто зазначити, що кінетика даного препарату застосовує як точку відліку власне величини BIS, що використовується версією TIVAtrainer для iOs).
— Ларингоскопія, інтубація трахеї, розріз шкіри — 2,75–3 мкг/мл (при згаданій вище цільовій концентрації фентанілу).
— Відновлення свідомості — 1,5 мкг/мл.
3. Дексмедетомідин (Hannivoort, 2015 [16]) — 0,25–0,3 нг/мл.
4. Лідокаїн (Kuipers, 2001) — 2–6 мкг/мл.
5. Транексамова кислота (Grassin-Delyle, 2018 [12]) — 75–100 мкг/мл (максимально — 150 мкг/мл).
Оцінивши на практиці низку програм для розрахунку параметрів інфузії за цільовою концентрацією, ми виділяємо з них дві, які взаємно доповнюють одна одну: iTIVA plus Anesthesia та TIVATrainer. Для практичного застосування зручніша iTIVA plus Anesthesia (чудовий алгоритм вибору темпу інфузії за цільовою концентрацією, у якому можна додатково задавати час досягнення бажаної концентрації, voice assistant, який нагадає про зміну параметрів, можливість розрахунку вікової MAC для інгаляційних анестетиків, з використанням формули Mapleson, непоганий довідник цільових концентрацій анестезіологічних препаратів). Однак TIVATrainer зручніша для попереднього підбору та оцінки сценаріїв інфузії за цільовою концентрацією. Незважаючи на величезні можливості сучасних інформаційних технологій, обсяг інформації, яку потрібно аналізувати для оперативного та безпечного вибору режиму дозування, буде доцільним доручити це окремому члену команди — аналогічно нейрофізіологу, який проводить моніторинг викликаних потенціалів. Окремо зауважимо, що сумніви відносно юридичних аспектів застосування ФК/ФД підходу з використанням незалежного програмного забезпечення не мають під собою ніяких підстав, тому що легальні аспекти, які стримують застосування ФК/ФД підходу в деяких країнах, торкаються не суті методу, а власне автоматичної зміни параметрів інфузії. У нашому варіанті остаточне рішення відносно цих змін приймає лікар, використовуючи всі вказівки фармакопеї, але додатково керуючись даними розрахунку фармакокінетичних параметрів для конкретного пацієнта в реальному масштабі часу. Слід відмітити, що відсутність сучасних опіатів в Україні значно ускладнює проведення тривалих операцій. Термінальний період напіввиведення фентанілу (478 хв — більше, ніж у морфіну) та параметр, що характеризує безпеку постійної інфузії (контекстно залежний час напіввиведення), найгірші з усіх опіатів (альфентаніл, суфентаніл, реміфентаніл, фентаніл), що використовуються інтраопераційно. Ліцензування реміфентанілу й інших сучасних опіатів в Україні значно полегшило б проведення анестезії при хірургічній корекції сколіозів та поліпшило б результати лікування.
Висновки
Розробка та імплементація протоколів ERAS для хірургічної корекції сколіотичної деформації хребта та запровадження ФК/ФД підходів при дозуванні препаратів для анестезії дозволять зменшити кількість інтра- та постопераційних ускладнень, забезпечити ранню мобілізацію пацієнта та швидке переведення його на амбулаторне лікування. Зі свого боку, адекватний періопераційний менеджмент на фоні реформування медичної галузі в Україні буде мати ще й економічно вигідний результат для медичного закладу, де отримував медичну послугу пацієнт.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/97.jpg)