Вступ
За даними різних авторів, первинні пухлини хребта становлять усього від 3,1 до 16 % від усіх пухлин скелета людини, але вони є причиною суттєвого порушення якості життя таких пацієнтів та нерідко призводять до летальних випадків у зв’язку із запізненою діагностикою та неясністю тактики хірургічного лікування [1].
Первинні пухлини хребта дуже різні за своєю морфологічною структурою, що пов’язано насамперед з їх походженням як із кісткової тканини, так і з окістя, судин, нервів, хрящової тканини, зв’язок [2].
Невеликі розміри тіла хребця і дуги, близькість нервових і судинних структур, великий ступінь осьового навантаження, що несе на собі хребет, створюють цілу низку особливостей діагностики та складності для хірургічного лікування. У зв’язку з труднощами діагностики, особливо на початкових стадіях росту пухлини, хворих лікують від інших захворювань, базуючись на симптоматичних проявах, як у разі дегенеративних захворювань хребта, із застосуванням методів консервативного та фізіофункціонального лікування. Правильний діагноз нерідко встановлюють лише тоді, коли деструктивні процеси призводять до деформації хребта, розвитку неврологічної симптоматики. На жаль, як наслідок пізнє розпізнавання пухлини ускладнює хірургічне лікування, а радикальне видалення пухлини в багатьох випадках взагалі стає неможливим [3].
Первинні пухлини хребта, як і в інших відділах скелета, розподіляються на доброякісні та злоякісні.
З доброякісних пухлин найбільш часто зустрічаються гемангіоми, потім гігантоклітинна пухлина, остеоїд-остеома та остеобластома. З первинно-злоякісних пухлин — мієломна хвороба, злоякісна лімфома кістки, рідше — остеогенна саркома, фібросаркома [4].
Говорячи про доброякісність пухлин хребта, ми маємо на увазі лише морфологічні їх особливості. Щодо клінічних проявів, більшість доброякісних пухлин перебігають зазвичай тяжко, викликаючи деструкцію хребця з наступною деформацією і розвитком неврологічної симптоматики [5].
Взагалі лікування пухлин хребта становить складну проблему. Воно залежить від характеру пухлинного процесу, локалізації, поширення та гістогенезу пухлини.
Сучасні дослідження та власний досвід вказують, що основним методом лікування при доброякісних пухлинах є саме хірургічний, а при злоякісних процесах застосовують комбіновані методи лікування: хірургічний у поєднанні з променевою та хіміотерапією [6].
З урахуванням стрімкого розвитку спінальної хірургії та великої кількості сучасних досліджень із приводу різноманітних оперативних доступів, на наш погляд, найбільш актуальними питаннями хірургічного лікування пухлин залишається онкологічний радикалізм (обсяг оперативного лікування) та тактика щодо відновлення опорної функції хребта.
Мета роботи: проаналізувати результати тактики хірургічного лікування пацієнтів з первинними пухлинами хребта з огляду на відповідні оціночні шкали.
Матеріали та методи
Проведені клінічні спостереження 43 пацієнтів із доброякісними та злоякісними первинними пухлинами і пухлиноподібними ураженнями хребта, які лікувалися у відділенні вертебрології Інституту патології хребта та суглобів ім. проф. М.І. Ситенка НАМН України.
За локалізацією ураження хворих розподілили так: шийний відділ хребта — 5 пацієнтів, грудний — 17, поперековий — 19, крижі — 2. Серед них були 22 жінки і 21 чоловік віком від 18 до 72 років.
Приводом для звернення у пацієнтів був больовий синдром, що поєднувався з компресійною радикулопатією. У 16 хворих відзначалася груба неврологічна симптоматика у вигляді парезів і паралічів.
Для діагностики ми використовували такий алгоритм обстеження пацієнтів:
I. Клінічна діагностика: загальні дані пацієнта, анамнез життя та хвороби, клінічний симптомо-комплекс.
II. Рентгенометрична діагностика: рентгенографія в різних проєкціях, КТ-томографія, ЯМР-томографія, ангіографія, сцинтиграфія.
III. Лабораторна діагностика: клінічні аналізи, біохімічні аналізи.
IV. Патоморфологічна діагностика: передопераційна біопсія, інтраопераційна біопсія, післяопераційне дослідження препарату.
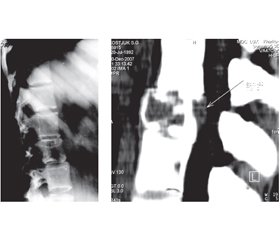
Контрастну ангіографію ми використовували в 5 пацієнтів. Даний метод дослідження дозволив нам судити про характер пухлини (судинне походження пухлини), її васкуляризацію, архітектоніку судин, взаємозв’язок із магістральними судинами і навколишніми тканинами (рис. 1).
Необхідно відзначити, що ми використовували контрастну ангіографію не тільки як діагностичний, але і як лікувальний метод. У даних хворих для зменшення інтраопераційної крововтрати ми застосовували тимчасову емболізацію судин, що живлять пухлину.
На підставі МРТ установлювався ступінь епідуральної компресії спинного мозку за 6-бальною шкалою відповідно до класифікації ESCC Bilsky [7] (рис. 2) та розташування пухлин в аксіальній проєкції (рис. 3).
Неврологічний статус визначався за шкалою ASIA (табл. 1) [8, 9].
Нестабільність хребта оцінювалась за шкалою Spine Instability Neoplastic Score (SINS) [10].
Локалізація:
— 3 бали — перехідний рівень (C0–C2, C7–T2, T11–L1, L5–S1);
— 2 бали — мобільний сегмент (C3–C6, L2–L4);
— 1 бал — полуригідний (T3–T10);
— 0 балів — ригідний (S2–S5).
Біль під час навантаження/при зміні положення:
— 3 бали — так;
— 2 бали — немає (періодично при натисканні);
— 1 бал — безболісно.
Руйнування кістки:
— 2 бали — літичне;
— 1 бал — змішане (літичне/бластичне);
— 0 балів — бластичне.
Зміни виявлені радіологічно:
— 4 бали — підвивих/нестабільність;
— 2 бали — de novo деформація (кіфоз/сколіоз);
— 0 балів — збережена кривизна.
Зниження висоти тіл хребців:
— 3 бали — > 50 % колапс;
— 2 бали — < 50 % колапс;
— 1 бал — без колапсу > 50 % тіла хребців залучено;
— 0 балів — нічого із вищеперерахованого.
Залучення задніх елементів (фасетки, ніжки або реберно-хребтові суглоби):
— 3 бали — двобічне;
— 1 бал — однобічне;
— 0 балів — нічого з перерахованого вище.
Інтерпретація:
— сума 1–6 — стабільне ураження (СУ);
— сума 7–12 — помірна нестабільність (ПН);
— сума 13–18 — виражена нестабільність (ВН).
Після ретельного клініко-лабораторного, рентгенологічного, КТ-, МРТ-обстеження далеко не завжди вдавалося встановити точний діагноз. Тоді наступним діагностичним прийомом є пункційна біопсія.
Пункційна біопсія проведена нами на різних рівнях хребта в 41 пацієнта. Ускладнень при пункційній біопсії ми не мали. Пункційну та відкриту біопсію не слід протиставляти одну одній. У 2 пацієнтів у зв’язку з наростанням неврологічної симптоматики була проведена відкрита біопсія з експрес-діагностикою матеріалу з наступним продовженням оперативного втручання.
За патоморфологічною класифікацією первинних пухлин та пухлиноподібних уражень Всесвітньої організації охорони здоров’я пацієнтів розподілили так:
А. Доброякісні — 26 пацієнтів.
1. Остеоїд-остеома та остеобластома — 10.
2. Кавернозна гемангіома — 3.
3. Гігантоклітинна пухлина — 6.
4. Хордома — 4.
5. Еозинофільна гранульома — 1.
6. Аневризмальна кісткова кіста — 2.
Б. Злоякісні — 17 пацієнтів.
1. Остеогенна саркома — 2.
2. Хондросаркома — 3.
3. Мієломна хвороба — 2.
4. Плазмоцитома — 6.
5. Фібросаркома — 3.
6. Ангіопірацетома — 1.
Розподіл пацієнтів за рівнем, поперечним розташуванням наведений у табл. 2 (бали за шкалами ASIA, Bilsky, SINS).
Тактика лікування всіх пухлин наведена в табл. 3, 4.
Хірургічне втручання з переднього доступу було виконано в 7 пацієнтів, із заднього доступу — у 23, комбінований передньозадній доступ було виконано в 13 пацієнтів, причому у 8 хворих використовувалось одноетапне хірургічне втручання, а в 5 — двохетапне.
Залежно від виду пухлини проводили максимально широку резекцію пухлини в межах здорових тканин за показаннями.
Стабілізація хребтових сегментів досягалась шляхом використання різних конструкцій. Вибір методу стабілізації та вибір конструкції ми базували на двох основних принципах: 1-й — можливість відновлення нормальних анатомічних взаємозв’язків у хребтовому сегменті, 2-й — створення надійної та жорсткої стабілізації хребта.
Клінічний випадок
Пацієнтка К., 18 років, надійшла в клініку патології хребта Інституту патології хребта та суглобів ім. М.І. Ситенка НАМН України з діагнозом «аневризмальна кісткова кіста L2-хребця».
Такий діагноз було встановлено на основі патоморфологічного висновку лікувальної установи, де пацієнтка перебувала на лікуванні до надходження в інститут, де пацієнтці було виконано пункційну біопсію.
При надходженні пацієнтка скаржилась на стійкий біль у верхньопоперековому відділі хребта, обмеження його функції.
З даних анамнезу: пацієнтка вважає себе хворою протягом 2 місяців, коли вперше виникли вищезазначені скарги.
При надходженні в інститут пацієнтці було виконано МРТ всіх відділів хребта, КТ, онкоскринінг та клініко-лабораторне дослідження.
За даними променевих методів дослідження (рентгенологічного та комп’ютерно-томографічного), визначалась крупновогнищева деструкція тіла L2-хребця з руйнуванням правої дужки й основи правого верхнього суглобового відростка. Замикальні пластинки тіла хребця збережені. Установлено попередній діагноз: літична деструкція L2-хребця, сколіотична деформація поперекового відділу хребта.
З урахуванням даних клініко-рентгенологічного обстеження пацієнтці визначене двохетапне хірургічне лікування.
I етап: відкрита біопсія, тотальна корпоректомія L2-хребця, передній міжтіловий кістковопластичний спондилодез із використанням телескопічного кейджа і передньої конструкції фірми Stryker.
II етап: видалення пухлини в ділянці дуги суглобового відростка. Задній спондилодез L1–L3 апаратом транс-педикулярної фіксації.
I етап. Положення пацієнтки на лівому боці. Проведено правосторонній передньобоковий доступ по лінії X ребра до передньоверхньої ості клубової кістки, видалення пухлини тіла хребця в межах здорових тканин, тобто проведено тотальну корпоректомію. Тканини пошарово розсічено. Розсічено діафрагму. Мобілізовано черевину і легені. Оголено передню поверхню тіл хребців. Мобілізовано судини. Виділено міжхребцеві диски L1–L2, L2–L3. У тілі L2-хребця визначається значний кістковий дефект, заповнений патологічною сіро-коричневою тканиною. Здійснено відкриту біопсію. Експрес-цитологія: діагноз: гігантоклітинна пухлина. Видалено пухлину тіла хребця в межах здорових тканин, тобто проведено тотальну корпоректомію. У міжтіловий проміжок L1–L3 установлено телескопічний кейдж фірми Stryker. По передній поверхні хребтового стовпа на рівні L1–L3 встановлено передню конструкцію виробництва Stryker. Дренування. Тканини пошарово ушиті.
Післяопераційний період стабільний, без ускладнень. На 5-ту добу пацієнтка пересувається самостійно.
II етап. На 14-ту добу після I етапу хірургічного втручання визначено показання до II етапу.
Хід операції: положення пацієнтки на животі. Проведено розріз шкіри по лінії остистих відростків L1–L3. Скелетовано задні структури хребтового стовпа. Після попереднього формування кісткових майданчиків транспедикулярно проведені гвинти в тіла L1–L3-хребців. Інтраопераційно в ділянці верхнього суглобового відростка і дуги L2-хребця визначається утворення сіро-коричневого кольору. Утворення видалено в межах здорових тканин. Монтаж транспедикулярної конструкції фірми Stryker. Дренування. Тканини пошарово ушиті.
Після патоморфологічного висновку пацієнтці встановлено остаточний діагноз: гігантоклітинна пухлина L2-хребця. Післяопераційний період стабільний, без ускладнень. Пацієнтка отримала симптоматичне лікування (антибактеріальна, протизапальна терапія і т.ін.). На 2-гу добу після операції пересувається самостійно. У післяопераційний період у пацієнтки відзначається значне зменшення інтенсивності больового синдрому. На 12-ту добу після зняття швів пацієнтку в задовільному стані виписали.
Результати лікування
Оцінку результатів хірургічного лікування пухлин хребта ми проводили за такими показниками: радикальне втручання, наявність ускладнень, динаміка неврологічних і ортопедичних порушень, наявність рецидивів пухлин і тривалість життя пацієнтів.
За даними неврологічних проявів за шкалою ASIA до лікування, із групи A 1 пацієнт залишився без змін, у групі В 5 пацієнтів із 9 перейшли до групи С, 4 залишилися без змін, у групі С 7 пацієнтів із 11 перейшли до групи D, 2 — до групи E, 2 — без змін, у групі D 8 пацієнтів із 9 залишились без змін, 1 перейшов до групи Е, у групі E всі 13 пацієнтів залишилися без неврологічних розладів.
До початку лікування за шкалою SINS було 17 пацієнтів у групі зі стабільним ураженням, 15 — із помірною нестабільністю, 10 — із вираженою нестабільністю. Стабілізувати та відновити опорну функцію хребта вдалося досягти у 23 пацієнтів із помірною та вираженою нестабільністю, у 17 пацієнтів зі стабільним ураженням змін не спостерігалось.
Радикальне видалення пухлини в межах здорових тканин, що було використано за показаннями, було досягнуто в 17 з 19 пацієнтів (табл. 3, 4), а у 24 пацієнтів провели оперативне лікування у вигляді декомпресії хребтового каналу та відновлення опорної функції хребта і часткову резекцію пухлини. У 2 випадках досягти абластичності не вдалося у зв’язку з вираженим проростанням пухлини у тверду мозкову оболонку спинного мозку в пацієнта з фібросаркомою Т12-хребця, а також у зв’язку з проростанням пухлини нижньої порожнистої вени, та в одного пацієнта розвилася масивна кровотеча, що призвело до інтраопераційної загибелі хворого. Це підтверджує необхідність вдосконалення і подальшої розробки методів радикального видалення пухлин хребта.
Після операції позитивний ефект неврологічних порушень був відзначений у всіх пацієнтів з явищами компресійної радикулопатії та із синдромом парапарезу. Загальний стан хворих після операцій покращився. Життєдіяльність пацієнтів значно підвищилася після зняття больового синдрому і поліпшення опорної функції хребта.
У 3 пацієнтів із компресійно-ішемічною мієлопатією із синдромом параплегії в неврологічному статусі в ранньому післяопераційному періоді стан залишився без динаміки.
Ускладнення, що виникли при радикальному видаленні пухлини хребта, ми розподілили на дві групи: ускладнення, що виникли під час оперативного втручання, та післяопераційні ускладнення. Із інтраопераційних ускладнень відмічалась кровотеча із судин, що живлять пухлину при видаленні ангіосаркоми С5-хребця. Застосовувалися механічні методи гемостазу: тампонада, коагуляція судин, віск, гемостатична губка; проводилось ретельне відшкодування крововтрати. У післяопераційному періоді в наших пацієнтів відзначалися затримка сечовипускання, парез кишечника, які після проведення відповідного лікування відновились.
Терміни спостереження хворих становили від 3 до 18 місяців. Прогресування захворювання після видалення пухлини зазначалося в однієї хворої з остеосаркомою L1-хребця. Рецидив пухлини, а саме хордоми L4-хребця, відзначався також в одного пацієнта, який у подальшому був вдало прооперований повторно.
Тривалість життя в наведеній групі пацієнтів буде проаналізована в подальшому. Пацієнтам за показаннями проводилася додаткова протипухлинна терапія з використанням променевих та медикаментозних методів лікування.
Висновки
1. У всіх пацієнтів із пухлинами хребта необхідно проводити ранню та повноцінну передопераційну діагностику, що включає клінічне, рентгенологічне, комп’ютерно-томографічне, магнітно-резонансне, остеосцинтиграфічне й ультразвукове обстеження, ангіографічне обстеження з можливою тимчасовою емболізацією судин, що живлять пухлину, лабораторне та патоморфологічне обстеження.
2. За даними шкал ASIA, SINS, Birsky встановлено, що оперативне втручання з метою видалення первинних пухлин хребта є виправданим, дозволяє запобігти неврологічним ускладненням, покращити існуючі неврологічні розлади, а також продовжити життя пацієнтів.
3. Хірургічне лікування пухлин хребта має включати радикальне видалення атипових тканин у межах здорових тканин, відновлення нормальних анатомічних взаємозв’язків в ураженому хребтовому сегменті та створення надійної, жорсткої стабілізації хребта.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/97.jpg)
/98.jpg)
/99.jpg)
/100.jpg)
/101.jpg)
/102.jpg)