Скорочення: ВЖТ — вісцеральна біла жирова тканина; ІМТ — індекс маси тіла; ПЖТ — підшкірна біла жирова тканина; ВЖК — вільні жирні кислоти (free fatty acids); BATF3 — АТФ-подібний фактор транскрипції 3 основної лейцинової блискавки (basic leucine zipper ATF-like transcription factor 3); BCR — клітинний рецептор В-клітин (B cell receptor); B-FO — фолікулярна В-клітина (follicular zone B cell); B-MZ — маргінальна В-клітина (marginal zone B cell); CCL2 — ліганд 2 С-С мотива (C-C motif ligand 2); MCP-1 — моноцитарний хемоатрактантний протеїн 1 (monocyte chemoattractant protein 1); cDC — конвенціональна DC (conventional dendritic cell); CLEC4C — член 4 родини C-типу лектинових доменів (C-type lectin domain family 4 member C); CMKLR1 — химерин хемокін-подібний рецептор 1 (chemerin chemokine-like receptor 1); CSF-2 — колонієстимулюючий фактор 2 (colony stimulating factor 2); DC — дендритна клітина (dendritic cells); DTR — рецептор дифтерійного токсину (diphtheria toxin receptor); DTX — дифтерійний токсин (diphtheria toxin); EGFR — рецептор епідермального фактора росту (epidermal growth factor receptor); FALC — лімфоїдний кластер, асоційований з жировою тканиною (fat-associated lymphoid clusters); FDC — фолікулярні дендритні клітини (follicular dendritic cells); FLT3LG — fms-подібний ліганд тирозинкінази 3 (fms related receptor tyrosine kinase 3 ligand); Fzd1 — рецептор 1 класу Frizzled (frizzled class receptor 1); GATA — GATA-зв’язуючий протеїн (GATA binding protein); HFD — дієта з високим вмістом жиру (high-fat diet); HMGB1 — протеїн високої рухливості групи B1 (1 high mobility group box 1); IFN — інтерферон (interferon); IL — інтерлейкін (interleukin); ILC — вроджені лімфоїдні клітини (innate lymphoid cells); iNKT — інваріантні натуральні Т-клітинні кілери (invariant natural killer T cells); IRF — інтерферон-регуляторний фактор (interferon regulatory factor); LPS — ліпополісахарид (lipopolysaccharid); LTB4 — лейкотрієн B4 (leukotriene B4); MCP-6 — протеаза 6 тучних клітин (mast cell protease 6); MHC — головний комплекс гістосумісності класу (major histocompatibility complex class); moDC — моноцитарного походження DC (monocyte-derived dendritic cell); MS — молочні плями (milky spots); Mϕ — макрофаг; NOTCH2 — протеїн 2 гомолога Notch (notch homolog protein 2); PAMP — патогенасоційовані молекулярні структури (pathogen-associated molecular patterns); pDC — плазмоцитоїдна DC (plasmacytoid dendritic cell); PPAR — рецептор, що активується пероксисомними проліфераторами (peroxisome proliferator-activated receptor); RORγt — транскрипційний фактор, пов’язаний з рецептором ретиноєвої кислоти (retinoic acid receptor-related orphan receptor γt); SIRPα — сигнально-регуляторний протеїн α (signal regulatory protein alpha); Tcf7l2 — фактор транскрипції 7, подібний фактору 2 (transcription factor 7 like 2); TGF — трансформуючий фактор росту (transforming growth factor); TLR — Toll-подібний рецептор (Toll like receptor); TNF — фактор некрозу пухлини (tumor necrosis factor); Treg-клітина — Т-регуляторна клітина; WNT10B — представник 10B родини Wnt (Wnt family member 10B).
Вступ
Згідно з даними Всесвітньої організації охорони здоров’я, протягом останніх десятиліть спостерігається постійне зростання рівня поширеності ожиріння як серед дорослого, так і серед дитячого населення всіх цивілізованих країн [18, 24, 42, 70].
Надлишкова вага й ожиріння є основними факторами ризику розвитку інсулінорезистентності, неалкогольної жирової хвороби печінки, цукрового діабету 2-го типу, артеріальної гіпертензії, серцево-судинних захворювань, раку і захворювань опорно-рухового апарату [1, 2, 21]. У розвитку метаболічних порушень і хронічних захворювань, індукованих ожирінням, ключову роль відіграє низькорівневе запалення (метазапалення) жирової тканини. Серед численних імунних клітин, що задіяні в метазапаленні, підтримання балансу прозапальної та протизапальної активності імунної системи в жировій тканині визначається здебільшого функціонуванням клітин адаптивної імунної системи [13]. Однією з перших популяцій імуноцитів адаптивної імунної системи, що активуються, є сукупність професійних антигенпрезентуючих лімфоцитів — дендритних клітин. Процесинг, презентація антигенів, каналізованість цитодиференціювання наївних Т-клітин, активація В-лімфоцитів і специфічного антитілогенезу визначає функціонування субпопуляції DC [39]. Ще донедавна В-лімфоцити розглядались виключно як антитілопродуценти, однак було продемонстровано, що B-клітини беруть участь в регуляції запальної відповіді, в тому числі й у жировій тканині [45]. З огляду на те, що отримані в останні роки дані значно розширили уявлення про спектр функціональних можливостей DC та В-лімфоцитів, даний огляд наукової літератури присвячений питанню про роль цих субпопуляцій імунних клітин у процесі метазапалення жирової тканини в розвитку ожиріння.
1. Значення дендритних клітин у розвитку метазапалення жирової тканини
1.1. Коротка характеристика дендритних клітин
Дендритні клітини функціонально пов’язують вроджений та адаптивний імунітет і є спеціалізованими клітинами, що прогресують і презентують антигени [30]. Попередники DC після вивільнення з кісткового мозку, мігруючи по кров’яному руслу, потрапляють в нелімфоїдні тканини і до активації в даних тканинах перебувають в незрілому стані. Продемонстровано, що активація DC пов’язана з їх взаємодією з BCR, образ-розпізнаючими рецепторами, цитокіновими рецепторами з антигенами, PAMP, цитокінами відповідно. Активація DC у жировій тканині значною мірою обумовлена взаємодією TLR2 і TLR4 їх цитоплазматичної мембрани з ВЖК, надлишок яких супроводжує процес ожиріння. Порушення DC супроводжується експресією костимулюючих молекул (CD86, CD80, CD40), секрецією цитокінів і хемокінів, необхідних для активації T-клітин. Однією з найважливіших стадій активації DC є підвищення експресії хемотаксичного рецептора CCR7, функціонування якого забезпечує міграцію DC через лімфатичну систему в дренуючий лімфатичний вузол. Ще до недавнього часу вважалося, що презентація антигенів DC відбувається виключно в умовах периферичних лімфатичних вузлів [39, 61]. Однак було встановлено, що первинна активація адаптивної імунної системи можлива в деяких особливих кластерах ВЖТ. Показано, що ВЖТ містить морфологічні утворення, які характеризуються високим рівнем вмісту імуноцитів [15]. Дані імунні кластери ВЖТ отримали назву «FALC» і «молочні плями» (MS — для жирової тканини сальника) (табл. 1).
/100.jpg)
Кластери FALC є атиповими острівцевими лімфоїдними тканинами, наявність яких спочатку була ідентифікована в брижовій ВЖТ миші та людини. Кластери FALC розташовані в жировій тканині слизових оболонок, середостіння, перикарда та гонад. Дані лімфоїдні кластери утворюють пермісивні мікрооточення, де активовані імуноцити проліферують в межах черевної порожнини, середостіння, перикарда. Кластери FALC можуть функціонувати подібно лімфатичним вузлам. Зокрема, встановлено, що CD11c+F4/80+клітини можуть здійснювати процесинг і презентувати антигени Т-клітинам в кластерах FALC ВЖТ [39]. На відміну від лімфатичних вузлів кластери FALC не є інкапсульованими та перебувають в безпосередньому контакті з оточуючими адипоцитами. Кількість кластерів FALC та їх розміри залежать від локалізації депо ВЖТ. Так, в фізіологічних умовах жирова тканина гонад містить всього 1–2 кластери FALC, а ВЖТ сальника може містити до 80 кластерів MS [6]. Розміри кластерів FALC варіюють від 100 до 500 мкм у діаметрі [47]. Дані кластери переважно містять CD11b+-мієлоїдні клітини, ILC2, B-1-, B-2-клітини та CD4+ T-лімфоцити. Клітини ILC2 за допомогою продукції IL-5 підтримують проліферацію клітин B-1 безпосередньо в кластерах FALC [6, 15]. Розвиток метазапалення пов’язаний зі збільшенням як розмірів, так і кількості FALC [15].
У процесі диференціювання DC особливу роль відіграють два цитокіни: FLT3LG і CSF-2. Ліганд тирозинкінази 3 FLT3LG підтримує розвиток cDC і pDC з попередників кісткового мозку [8], а CSF-2 сприяє розвитку moDC [38].
На сьогодні виділені чотири основні субпопуляції DC, які відрізняються одна від одної за фенотипом і функціональними можливостями. Серед DC розрізняють такі субтипи клітин: конвенційні DC (раніше позначались як мієлоїдні DC) — CD103+cDC1 та CD11bhicDC2; плазмоцитоїдні DC і DC моноцитарного походження (табл. 2) [20, 37].
Субпопуляції CD103+DC, CD11bhiDC та moDC представляють основні мігруючі DC, що після поглинання антигену переміщаються в T-клітинну зону регіонального лімфатичного вузла й активують наївні CD4+ і CD8+ T-клітини [37].
В жировій тканині людини присутні дві резидентні субпопуляції СDC (CD103+/CD11c+/BDCA-3+ і CD11bhi/CD11c+/BDCA-1+ ), одна субпопуляція pDC (CD11c–/BDCA2+ ) та одна субпопуляція moDC (CD11c+/CLEC4C), які відрізняються спектром цитокінів, що продукуються, та ефектами, які вони викликають [12, 31, 32].
Дендритні клітини жирової тканини характеризуються деякими фенотиповими відмінностями. Більшість DC жирової тканини (80–90 %) експресують CD11b, CD11c, продукти MHC II та костимулюючі молекули CD40 і CD80, але не експресують CD64 і рецепторну тирозинкіназу родини TAM (Tyro3, Axl і Mer) MerTK, що відрізняє їх від DC інших тканин. Приблизно 80–90 % DC жирової тканини представлені субпопуляцією CD11b+ клітин [12, 31, 32]. Stoyan Ivanov і співавт. [31] показали, що кілька CD103+cDC жирової тканини експресують XCR1 і IRF8 в поєднанні з низьким рівнем експресії гена АТФ-подібного фактора транскрипції 3 BATF3 порівняно з CD11b+cDC. Популяція CD11b+cDC жирової тканини експресує гени IRF4 та сигнально-регуляторного протеїну α SIRPα, але при низькому рівні експресії гена NOTCH2 порівняно з CD103+cDC жирової тканини.
В експериментальних моделях продемонстровано, що при ожирінні в жировій тканині збільшується кількість CD11b+CD11c+ конвенціональних DC і CD11b–CD11c+B220+ плазмоцитоїдних DC [59, 68].
Встановлено, що HFD викликає значне збільшення представництва CD11c+DC у жировій тканині (табл. 3) [7, 59]. Молекула CD11c є представником родини β2-інтегринів і використовується як маркер активації моноцитів/макрофагів та DC [54].
Значення клітин CD11c+ в розвитку ожиріння було продемонстровано на експериментальній моделі трансгенних мишей CD11c–DTR. Відомо, що DTX є двосубодиничним екзотоксином, що секретується Corynebacterium diphtheriae, зв’язується з клітинами через EGFR, який також є рецептором до дифтерійного токсину. Зв’язування DTX з DTR призводить до швидкої загибелі DTR-експресуючих клітин через блокаду синтезу протеїнів. Виснаження популяції клітин CD11c+ у трансгенних мишей CD11c–DTR супроводжується більш низьким рівнем експресії прозапальних цитокінів у жировій та м’язовій тканині і більш високим рівнем сенситивності до дії на тлі HFD-індукованого ожиріння, на відміну від мишей дикого типу [49].
Особливий інтерес викликає диференційована зміна функціонального стану DC в печінці та ВЖТ при розвитку ожиріння. Відомо, що DC, локалізовані в периферичних нелімфоїдних тканинах, є «незрілими» антиген-презентуючими клітинами і характеризуються низьким рівнем експресії CD86 та інших костимулюючих молекул. Розвиток ожиріння супроводжується підвищенням рівня експресії CD86 в DC, присутніх в тканині печінки, але не у ВЖТ. Підвищення активності експресії CD86 в клітинах CD11b–CD11c+ тканини печінки відзначається вже на третьому тижні HFD, що свідчить про прискорення фенотипового дозрівання DC у відповідь на розвиток ожиріння. Автори вважають, що матурація клітин CD11c+, зокрема CD11b–CD11c+, в тканині печінки є одним із найбільш ранніх ознак HFD-індукованої реакції імунної системи [59].
Дендритні клітини здатні поглинати жирні кислоти, що виділяються з адипоцитів, та акумулювати їх у ліпідних краплях. Вміст ліпідних крапель у їх внутрішньоклітинному просторі високоасоційований з підвищеною імуногенністю DC і більш високим рівнем продукції TNF-α [39].
1.2. Конвенціональні дендритні клітини
Конвенціональні DC жирової тканини представлені субтипами CD11b–CD103+cDC1 і CD11b+CD103–cDC2 [59]. У фізіологічному стані епідидимальна жирова тканина збагачена CD11b+cDC2, популяція яких за представництвом у структурі імуноцитів займає третє місце після Mϕ і T-клітин. При фізіологічному стані локалізовані в жировій тканині cDC2 переважно експресують гени, асоційовані з імунорегуляторним фенотипом [68].
Встановлено, що у мишей з нокаутним геном F–/– знижена кількість cDC у нелімфоїдних тканинах, і такі миші легко переносять HFD без розвитку метаболічних порушень. Автори вважають, що cDC відіграють ключову роль у регуляції системних метаболічних реакцій, індукованих ожирінням, і сприяють розвитку метазапалення жирової тканини [43, 67].
1.2.1. CDC1
У фізіологічних умовах cDC1 ВЖТ високо експресують гени рецептора WNT10B Fzd1 і фактора транскрипції Tcf7l2. Активація β-катеніну в cDC1 жирової тканини за допомогою протеїну WNT10B індукує розвиток толерогенного фенотипу cDC1 з високою продукцією протизапального цитокіну IL-10 [40].
Активація TLR2, TLR4 CD103+cDC1 індукує продукцію IL-12. При ожирінні CD103+cDC1, які продукують IL-12 та IL-18, що сприяють диференціації Th1-лімфоцитів, хоч і в невеликій кількості, але представлені в жировій тканині (рис. 1) [31].
1.2.2. CDC2
При ожирінні рекрутинг CD11b+cDC2 в жирову тканину здійснюється хемокінами, які взаємодіють з рецепторами: CCR7 і, меншою мірою, з CCR2. Активація ВЖК TLR4 cDC2 супроводжується продукцією CCL2, що рекрутує M1 Mϕ в жирову тканину [44]. Вважають, що CD11b+cDC2 жирової тканини, секретуючи IL-23, індукують Тh17-клітини [31]. Yanhong Chen і співавт. [11] встановили, що в жировій тканині мишей, які перебувають на HFD, відзначається високий рівень CD11c+F4/80loDC, і саме даний тип незрілих cDC з низьким рівнем експресії маркерів зрілості CD80 та CD86 продукує IL-6, TGF-β і IL-23, сприяючи рекрутингу й активації Th17-клітин (рис. 2).
/103.jpg)
Для мієлоїдних клітин — DC і Mϕ — жирової тканини як мишей, так і людей при розвитку ожиріння характерний високий рівень експресії CD26. Протеїн CD26 є дипептидилпептидазою-4, яка знижує активність інкретинових пептидів (глюкагоноподібного пептиду 1 и глюкозозалежного інсулінотропного поліпептиду), що сприяють зниженню рівня секреції інсуліну, у зв’язку з чим активація CD26 сприяє розвитку інсулінорезистентності, а нокаут гена CD26 запобігає виникненню інсулінорезистентності in vitro [34, 60].
Конвенціональні DC відіграють ключову роль у процесі рекрутування Mϕ у відповідь на метаболічні проблеми, індуковані HFD [59].
1.3. Плазмоцитоїдні дендритні клітини
Плазмоцитоїдні CD11c–/BDCA2+DC становлять 0,2–0,8 % від усього пулу DC людини [71]. Однак в тканині печінки, навіть у фізіологічних умовах, субпопуляція pDC становить третину всієї популяції DC. Плазмоцитоїдні DC є основними первинними продуцентами IFN-α в організмі людини [62] і відіграють ключову роль у противірусному захисті [51].
Ожиріння супроводжується підвищенням кількості pDC у жировій тканині. У мишей, які отримували HFD, приблизно втричі збільшується представництво плазмоцитоїдних DC у жировій тканині, ймовірно, за рахунок посилення їх рекрутування з периферичного русла крові [22]. Amrit Raj Ghosh і співавт. [22] вважають, що химерин адипоцитів ВЖТ взаємодіє з рецептором CMKLR1 циркулюючих у периферичному руслі крові pDC, рекрутує дані клітини в жирову тканину. Рекрутовані pDC активуються in situ комплексами «HMGB1/нуклеїнова кислота», які є лігандами рецепторів TLR9 pDC. Активовані таким чином pDC продукують IFN типу I in situ, що, у свою чергу, стимулює поляризацію Mϕ в прозапальний експресуючий фактор транскрипції IRF5 М1 Mϕ.
Акумуляція pDC сприяє підвищенню концентрації IFN I типу в жировій тканині. Представник групи протеїнів високої мобільності HMGB1, що виділяється адипоцитами на тлі ожиріння, активує TLR9 pDC у ВЖТ та індукує синтез IFN I типу. У свою чергу, IFN-β індукує синтез CCL2, і, як наслідок, підвищується рекрутинг Mϕ моноцитарного походження у ВЖТ [22].
Доведено, що IFN I типу роблять значний внесок у розвиток ожиріння і метаболічних порушень. Продемонстровано, що у мишей з нокаутним геном Ifnar–/– HFD не індукує розвиток цукрового діабету 2-го типу. Також у мишей E2-2.cre+, для яких є характерним дефіцит субпопуляції pDC, спостерігається стійкість до розвитку і метаболічних порушень. Цілком ймовірно, що відсутність рецепції Ifn-α у експериментальних тварин, які отримують HFD, перешкоджає, а надлишок активації Ifn-α-асоційованих сигнальних шляхів сприяє інфільтрації прозапальних М1 Mϕ жирової тканини і тканини печінки [27]. Так, рівень представництва pDC у жировій тканині та тканині печінки під час розвитку ожиріння корелює зі збільшенням кількості М1 Mϕ.
Прозапальні М1 Mϕ, у свою чергу, сприяють розвитку хронічного запалення ВЖТ (рис. 3).
1.4. Моноцитарні дендритні клітини
Попередниками CD11c+/CLEC4C moDC є циркулюючі Ly6Chi-моноцити. Диференціювання Ly6Chi-моноцитів в moDC обумовлено впливом CSF-2 і IL-4. Більшість запальних moDC експресують Ly6C, CD11b, CD11c і продукти MHC класу II [57]. Клітинна сукупність moDC є гетерогенною субпопуляцією, що включає групи клітин з сигнатурою CD14low CD1a– і CD14–CD1a+, які відповідають різним послідовним стадіям диференціювання даних мієлоїдних клітин. Запальні цитокіни блокують перехід клітин CD1a– в CD1a+ moDC й імпринтують фенотип CD1a–, що обумовлює дозрівання обох субпопуляцій. Незрілі CD1a– moDC мають високу інтерналізуючу здатність, тоді як зрілі CD1a+ moDC відрізняються здатністю продукувати велику кількість IL-12p70 і CCL1 [23].
Розвиток ожиріння у людей супроводжується збільшенням субпопуляції і CD1c+moDC в ПЖТ, але не у ВЖТ, і кількість цих клітин позитивно й високо корелює з ІМТ [7].
В жировій тканині moDC, ймовірно, не тільки викликають прозапальний ефект, але й регулюють активність рекрутингу Тreg-клітин. Так, Ryutaro Iwabuchi і співавт. [33] встановили, що введення екзогенних ліганда FLT3LG і фактора CSF-2 гуманізованим мишам з цукровим діабетом 2-го типу SCID/Jak3null (hNOJ)В сприяє підвищенню рівня експресії костимулюючих молекул всіх DC, а також значному збільшенню пулу дендритних клітин, що експресують CD1c та/або CD141 (CD14–CD1c+cDC1, CD14–CD141+cDC2 і CD14+moDC). Введення і FLT3LG, і CSF-2 викликає збільшення кількості Foxp3+ Тreg-клітин у жировій тканині. Причому введення CSF-2 сприяє підвищенню вмісту активованих CD45RA–Foxp3hi Treg-клітин, а введення сполуки CSF-2 з FLT3LG призводить до збільшення пулу CD45RA–Foxp3lo Treg-клітин у стані спокою. Автори вважають малоймовірним пояснення цього факту тим, що фактор CSF-2 чинить безпосередній вплив на Тreg-клітини, оскільки дані імуноцити ні в гуманізованих мишей NSG, ні в людей не експресують рецептор до CSF-2. Вважають, що DC, особливо ті, які експресують продукти МНС II класу і костимулюючі молекули (CD80 і CD86), відіграють важливу роль у регуляції диференційованого припливу Treg-клітин. Залучення супресорних CD45RA-Foxp3hiTreg-клітин обумовлено впливом CD14–CD141+cDC2, а рекрутування CD45RA-Foxp3lo не-Treg-клітин, що продукують IL-17, пов’язане з дією CD1c+moDC. Таким чином, можна вважати, що залучення cDC2 перешкоджає розвитку запалення, а рекрутування moDC сприяє підвищенню активності запального процесу (рис. 4).
/104.jpg)
2. Значення B-клітин у розвитку метазапалення жирової тканини
2.1. Коротка характеристика B-клітин
Активовані В-клітини виконують функцію презентації антигенів та утворення антитіл у розвитку імунної відповіді. Вважається, що продукування специфічних антитіл плазматичними клітинами лежить в основі набутої резистентності макроорганізму до більшості патогенних мікроорганізмів. Також активовані В-клітини відіграють важливу регуляторну роль у тонкому налаштуванні функціонування імунної системи [3, 26, 65].
Популяція B-клітин складається з B-1-, B-2-лімфоцитів. Клітини B-1-лімфоцитів беруть участь у ранній продукції імуноглобулінів після контакту з антигеном і несуть відповідальність за стабільний синтез природних протизапальних антитіл IgM, B-2-клітини синтезують автореактивні антитіла IgG, і обидві популяції беруть участь у продукції IgA в жировій тканині (табл. 4) [31].
B-1-клітини розвиваються з B-1-попередників у печінці плода та зберігаються після народження протягом усього життя як самовідновлювальна субпопуляція, клітини якої практично не вивільняються з кісткового мозку протягом постнатального періоду життя, тоді як B-2-лімфоцити розвиваються з транзиторних B-2-клітин, що походять із попередників, які протягом усього життя вивільняються в периферичне русло крові з кісткового мозку [5, 29, 53, 63].
Кількість В-клітин в жировій тканині пропорційна ступеню ожиріння, і зменшення їх представництва асоційоване з інсуліносенситивністю. При фізіологічній масі тіла B-клітини у ВЖТ становлять 10 % від популяції похідних стромальних клітин, розвиток ожиріння супроводжується збільшенням їх пулу до 20 %, причому акумуляція B-клітин відбувається до інфільтрації Mϕ [73]. У підшкірній жировій тканині людини з ожирінням CD19+ В-клітини становлять близько 4 % від популяції похідних стромальних клітин, і вони локалізуються навколо макрофагальних короноподібних структур і в периваскулярному просторі [41]. Гетерогенність розподілу в жировій тканині є характерною для всіх типів імуноцитів, але особливо показова для В-клітин. Так, кількість В-клітин і значення співвідношення В-1 : В-2 значно вищі в жировій тканині сальника, ніж в інших компартментах ВЖТ (епідидимальній, брижовій, епікардіальній, перикардіальній і периваскулярній) [47]. Молочні плями ВЖТ сальника як у людей, так і в мишей містять велику кількість B-клітин, особливо вроджених B-1-клітин [28], що постійно переміщуються в плевральну та черевну порожнини і з них — у ВЖТ сальника [72].
Згідно з думкою Prasad Srikakulapu і Coleen A. McNamara [58], популяція В-клітин жирової тканини характеризується більш високим співвідношенням клітин В-1 : В-2, ніж у тканині селезінки та кісткового мозку. B-1-клітини інгібують запалення при ожирінні за рахунок продукції природного IgM, тоді як B-2-клітини сприяють його розвитку при ожирінні за рахунок виробництва прозапальних цитокінів і синтезу IgG, регуляторні B-клітини пригнічують запальний процес в результаті синтезу IL-10.
2.2. В-1-клітини
На сьогодні виділяють декілька субпопуляцій В-1-клітин (табл. 5).
Міграція клітин B-1 у жирову тканину контролюється макрофагальним хемокіном CXCL13 [72].
/106.jpg)
Імуноглобулін-продукуючі В-1-клітини синтезують природні антитіла класу IgM проти так званих Т-незалежних антигенів, зазвичай вуглеводних або фосфоліпідних, характерних для коменсальних бактерій. Прототипом антитіл, що секретуються В-1-клітинами, є антитіла проти антигенів груп крові АВО. Природні антитіла є поліреактивними або поліспецифічними, оскільки вони можуть зв’язуватися як з мікробними антигенами, так і з автоантигенами [36]. Крім IgM, В-1-клітини продукують і поліреактивні антитіла класу IgA, що роблять свій внесок у захист слизових оболонок поряд з IgA, який секретується B-FO-лімфоцитами [46]. Природні антитіла захищають макроорганізм від антигенів (наприклад, капсульних полісахаридів), які не викликають монореактивну антитільну відповідь. Cубпопуляція В-1-клітин складається з клітин CD5+CD11b–В-1a, що високо продукують IgM, і клітин CD5–CD11b+В-1b, що низько продукують IgM [28]. Необхідно відзначити, що клітини CD5+CD11b–В-1a є довгоживучими лімфоцитами та їх втрата може бути необоротною [16].
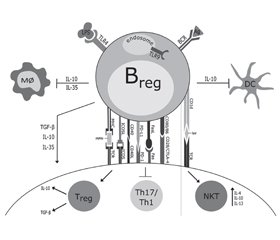
Регуляторні В-клітини (Breg-), що секретують –IL-10, чинять виражену протизапальну дію при ожирінні (рис. 5) [55].
/107.jpg)
Фенотип Breg-клітин, що продукують IL-10 ПЖТ й епідидимальної ВЖТ, був ідентифікований як CD1dloCD5–/loCD11bloCD21/CD35loCD23–/loCD25+CD69+CD72hiCD185–CD196+IgM+IgD+IL-10+, який відрізнявся від інших IL-10-продукуючих В-клітин — CD1dhiCD5+, виділених із селезінки і черевної порожнини, що експресують [48]. Дефіцит IL-10-продукуючих В-клітин супроводжується більш вираженою інфільтрацією жирової тканини мишей з ожирінням Mϕ і Т-клітинами [50]. Кількість толерогенних Вreg-клітин у жировій тканині, на відміну від B-2-клітин, значно зменшується під час розвитку ожиріння. Встановлено, що характерною особливістю Вreg-клітин у жировій тканині є їх здатність продукувати IL-10. Розвиток ожиріння супроводжується зниженням рівня продукції IL-10 Breg-клітинами жирової тканини. Специфічна делеція гена Il-10 в даних клітинах у експериментальних тварин призводила до посилення метазапалення на тлі HFD і збільшення метаболічних розладів. Адаптивний трансфер достатньої кількості IL-10-продукуючих B-клітин значно знижував продукцію прозапальних цитокінів (TNF-α, CCL2) і рівень експресії CD44 та продукції IFN-γ у Th1-клітин [48].
2.3. В-2-клітини
Cубпопуляція В2-лімфоцитів складається з маргінальних B-MZ- і фолікулярних B-FO-клітин [29].
Транзиторні B-2-клітини після індукції протеїном NOTCH2 диференціюються в B-MZ-клітини. Дані клітини експресують поліреактівний B-клітинний рецептор BCR, рецептори комплементу (CD21 і CD35) та молекулу CD1d, подібну до молекул МНС I класу. B-MZ-клітини продукують поліреактівні IgM-антитіла, що полегшують елімінацію мікроорганізмів і апоптотичних клітин [10]. Подібно В-1-клітинам, B-MZ-клітини розпізнають Т-незалежні вуглеводні, фосфоліпідні антигени, проліферують і секретують низькоафінні антитіла класу IgM. На відміну від B-1 клітин B-MZ клітини беруть участь у реакціях і на T-залежні антигени, генеруючи високоафінні антитіла класу IgG [35]. B-MZ-клітини є універсальною популяцію клітин, що швидко виробляють антитіла до T-незалежних і T-залежних антигенів [10].
Фолікулярні B-клітини розвиваються в селезінці із транзиторних B-2-клітин після BCR-опосередкованої індукції тирозинкінази Брутона і локалізуються в лімфатичних вузлах і селезінці. Ці В-клітини є конвенціональними В-лімфоцитами адаптивної імунної системи і представляють найчисленнішу субпопуляцію В-клітин. Основною функцією B-FO клітин є синтез довгоживучих високоафінних антитіл класу IgG проти Т-залежних антигенів [66].
Розрізняють два варіанти активації В-клітин: залежний і незалежний від Т-клітин. Активація B-FO клітин, залежна від Т-клітин, зазвичай відбувається в гермінальному (зародковому) центрі лімфатичного вузла. Гермінальний центр представляє собою інтенсивну кооперацію клітин: GC-, T-фолікулярних хелперних (TFH-), T-фолікулярних регуляторних (TFR-) клітин, Mϕ твітильного тіла і FDC. Стимуляція BCR антигеном викликає потребу в костимуляції, що забезпечується CD4+ TFH-клітинами. За відсутності Т-хелперної костимуляції В-клітини гинуть [52].
Необхідно підкреслити, що B-2-клітини є одними з перших імунних клітин, що накопичуються в жировій тканині у відповідь на HFD. Через 3 тижні після призначення HFD у експериментальних мишей C57BL6/J відзначається триразове збільшення кількості В-клітин в епідидимальному депо ВЖТ, в той час як кількість Т-клітин збільшується після 6 тижнів дієти, а кількість Mϕ — тільки після 12 тижнів HFD. Підвищений вміст В-клітин у ВЖТ зберігається протягом наступних 9 тижнів [19].
Рекрутування й активація клітин B-2-лімфоцитів при розвитку ожиріння у ВЖТ опосередкована взаємодією LTB4 з його рецептором LTB4R1 [73].
При HFD-індукованому ожирінні B-2-клітини накопичуються в жировій тканині мишей і сприяють активації прозапальних М1 Mϕ за рахунок синтезу специфічних, можливо, патогенних антитіл IgG [41].
В-2-клітини сприяють розвитку запалення. Глобальний дефіцит В-клітин супроводжується вкрай низьким рівнем активності HFD-індукованого запалення жирової тканини [17, 73]. У мишей з дефіцитом В-клітин (Bnull) практично не розвивається HFD-індукована інсулінорезистентність. Адоптивне перенесення мишам-реципієнтам Bnull B-2-клітин жирової тканини від мишей-донорів дикого типу підвищує рівень HFD-індукованої інсулінорезистенності [73].
У мишей з ожирінням специфічні для епідидимальної ВЖТ В-2-клітини секретують прозапальні цитокіни, такі як IL-6 та IFN-γ, регулюють активацію Т17-клітин і формують прозапальний фенотип у Mϕ. Дефіцит B-клітин у мишей, які отримували HFD, супроводжується більш низьким рівнем концентрації прозапальних цитокінів, зокрема IFN-γ, в епідидимальній ВЖТ [7, 17, 45]. Крім того, B-клітини можуть продукувати CXCL8/IL-8, рівень продукції якого корелює зі значенням ІМТ хворих з ожирінням. З огляду на те, що CXCL8/IL-8 є хемоатрактантами нейтрофілів, B-клітини, можливо, сприяють рекрутуванню нейтрофілів у ВЖТ і прогресу метаболічних розладів [56].
Циркулюючі В-клітини в осіб з ожирінням і цукровим діабетом, які страждають від ожиріння, продукують вищу кількість IL-6 та TNF-α порівняно зі здоровими людьми [74].
Таким чином, B-клітини є невід’ємним компонентом організованого метазапалення підшкірного жиру, і кожна їх субпопуляція виконує свою роль у підтримці жирової тканини і розвитку метазапалення.
У осіб з ожирінням відзначається підвищений рівень вмісту імуноглобулінів у сироватці крові, а введений екзогенний імуноглобулін у експериментальних тварин викликає метазапалення жирової тканини й інсулінорезистентність периферичних тканин [69]. Продемонстровано, що при ожирінні у мишей молекули IgG2c в епідидимальній ВЖТ локалізуються поблизу короноподібних структур жирової тканини. Вважають, що IgG відіграє істотну роль у забезпеченні як ефективного кліренсу некротичних адипоцитів, так і розвитку метазапалення [17]. Адоптивне перенесення IgG від мишей, які отримували HFD, мишам з дефіцитом B-клітин, які не отримували HFD, індукує інсулінорезистентність. Вважають, що Fc-фрагменти IgG, зв’язуючись з макрофагальними рецепторами FcγR, індукують секрецію прозапальних TNF-α, які порушують сприйняття рецепції інсуліну (рис. 6) [69].
Висновки
Дендритні та B-клітини є імуноцитами адаптивної імунної системи, що беруть участь у формуванні метазапалення жирової тканини при розвитку ожиріння. Дані більшості досліджень свідчать про те, що при прогресуванні ожиріння DC в цілому сприяють розвитку метазапалення. Ожиріння на тлі експериментального виснаження DC у жировій тканині супроводжується низьким рівнем інфільтрації прозапальними макрофагами як жирової тканини, так і тканини печінки в поєднанні з більш високим рівнем сенситивності до дії інсуліну периферичних тканин. Конвенціональні, плазмоцитоїдні та моноцитарні дендритні клітини, накопичуючись у жировій тканині, сприяють створенню прозапального мікрооточення, продукуючи прозапальні цитокіни й хемокіни, які рекрутують Th1-, Th17-клітини та ефекторні прозапальні клітини — макрофаги й нейтрофіли.
Ожиріння призводить до акумуляції В-2-клітин у жировій тканині, більш активної продукції В-клітинно-асоційованих прозапальних цитокінів і генерації IgG, що рекрутує макрофаги M1 у жирову тканину. Однак численні питання регуляції рекрутингу, активації DC і В-клітин при розвитку ожиріння залишаються нез’ясованими. Зокрема, невідомі фактори, що здійснюють рекрутинг толерогенних DC і Breg-клітин, механізми регуляції їх рекрутування в різні депо жирової тканини і можливості активації даних клітин тригери синтезу протективних антитіл класу IgM, залишаються невідомими антигени, що беруть участь в активації адаптивної імунної системи при розвитку ожиріння.
Конфлікт інтересів. Автори повідомляють про відсутність конфлікту інтересів.
Список литературы
1. Абатуров А.Е. Метаболический синдром у детей (лекция). Таврический медико-биологический вестник. 2007. Т. 10. С. 57-65.
2. Абатуров А.Е. Особенности метаболического синдрома у детей. Дитячий лікар. 2011. № 4 (11). С. 54-61.
3. Alhabbab R.Y., Nova-Lamperti E., Aravena O. et al. Regulatory B cells: Development, phenotypes, functions, and role in transplantation. Immunol. Rev. 2019. 292(1). 164-179. doi: 10.1111/imr.12800.
4. Aziz M., Holodick N.E., Rothstein T.L., Wang P. The role of B-1 cells in inflammation. Immunol. Res. 2015. 63(1–3). 153-166. doi: 10.1007/s12026-015-8708-3.
5. Baumgarth N. The double life of a B-1 cell: self-reactivity selects for protective effector functions. Nat. Rev. Immunol. 2011. 11(1). 34-46. doi: 10.1038/nri2901.
6. Bénézech C., Luu N.T., Walker J.A. et al. Inflammation-induced formation of fat-associated lymphoid clusters. Nat. Immunol. 2015. 16(8). 819-828. doi: 10.1038/ni.3215.
7. Bertola A., Ciucci T., Rousseau D. et al. Identification of adipose tissue dendritic cells correlated with obesity-associated insulin-resistance and inducing Th17 responses in mice and patients. Diabetes. 2012. 61(9). 2238-2247. doi: 10.2337/db11-1274.
8. Breton G., Lee J., Zhou Y.J. et al. Circulating precursors of human CD1c+ and CD141+ dendritic cells. J. Exp. Med. 2015. 212(3). 401-413. doi: 10.1084/jem.20141441.
9. Castañeda-Sánchez J.I., Duarte A.R.M., Domínguez-López M.L., de la Cruz-López J.J., Luna-Herrera J. B Lymphocyte as a Target of Bacterial Infections. In: Lymphocyte Updates — Cancer, Autoimmunity and Infection. InTech. 2017. doi.org/10.5772/intechopen.69346.
10. Cerutti A., Cols M., Puga I. Marginal zone B cells: virtues of innate-like antibody-producing lymphocytes. Nat. Rev. Immunol. 2013. 13(2). 118-132. doi: 10.1038/nri3383.
11. Chen Y., Tian J., Tian X. et al. Adipose tissue dendritic cells enhances inflammation by prompting the generation of Th17 cells. PLoS One. 2014. 9(3). e92450. Published 2014 Mar 18. doi: 10.1371/journal.pone.0092450.
12. Cho K.W., Zamarron B.F., Muir L.A. et al. Adipose Tissue Dendritic Cells Are Independent Contributors to Obesity-Induced Inflammation and Insulin Resistance. J. Immunol. 2016. 197(9). 3650-3661. doi: 10.4049/jimmunol.1600820.
13. Chung K.J., Nati M., Chavakis T., Chatzigeorgiou A. Innate immune cells in the adipose tissue. Rev. Endocr. Metab. Disord. 2018. 19(4). 283-292. doi: 10.1007/s11154-018-9451-6.
14. Collin M., Bigley V. Human dendritic cell subsets: an update. Immunology. 2018. 154(1). 3-20. doi: 10.1111/imm.12888.
15. Cruz-Migoni S., Caamaño J. Fat-Associated Lymphoid Clusters in Inflammation and Immunity. Front. Immunol. 2016. 7. 612. Published 2016 Dec 21. doi: 10.3389/fimmu.2016.00612.
16. Cunningham A.F., Flores-Langarica A., Bobat S. et al. B1b cells recognize protective antigens after natural infection and vaccination. Front. Immunol. 2014. 5. 535. Published 2014 Oct 31. doi: 10.3389/fimmu.2014.00535.
17. DeFuria J., Belkina A.C., Jagannathan-Bogdan M. et al. B cells promote inflammation in obesity and type 2 diabetes through regulation of T-cell function and an inflammatory cytokine profile. Proc. Natl. Acad. Sci U S A. 2013. 110(13). 5133-5138. doi: 10.1073/pnas.1215840110.
18. Di Cesare M., Sorić M., Bovet P. et al. The epidemiological burden of obesity in childhood: a worldwide epidemic requiring urgent action. BMC Med. 2019. 17(1). 212. Published 2019 Nov 25. doi: 10.1186/s12916-019-1449-8.
19. Duffaut C., Galitzky J., Lafontan M., Bouloumié A. Unexpected trafficking of immune cells within the adipose tissue during the onset of obesity. Biochem. Biophys. Res. Commun. 2009. 384(4). 482-485. doi: 10.1016/j.bbrc.2009.05.002.
20. Gardner A., de Mingo Pulido Á., Ruffell B. Dendritic Cells and Their Role in Immunotherapy. Front. Immunol. 2020. 11. 924. Published 2020 May 21. doi: 10.3389/fimmu.2020.00924.
21. Gepstein V., Weiss R. Obesity as the Main Risk Factor for Metabolic Syndrome in Children. Front. Endocrinol. (Lausanne). 2019. 10. 568. Published 2019 Aug 16. doi: 10.3389/fendo.2019.00568.
22. Ghosh A.R., Bhattacharya R., Bhattacharya S. et al. Adipose Recruitment and Activation of Plasmacytoid Dendritic Cells Fuel Metaflammation. Diabetes. 2016. 65(11). 3440-3452. doi: 10.2337/db16-0331.
23. Gogolak P., Rethi B., Szatmari I. et al. Differentiation of CD1a- and CD1a+ monocyte-derived dendritic cells is biased by lipid environment and PPARgamma. Blood. 2007. 109(2). 643-652. doi: 10.1182/blood-2006-04-016840.
24. Grobler L., Visser M., Siegfried N. Healthy Life Trajectories Initiative: Summary of the evidence base for pregnancy-related interventions to prevent overweight and obesity in children. Obes. Rev. 2019. 20 (suppl. 1). 18-30. doi: 10.1111/obr.12767.
25. Gulubova M. Myeloid and Plasmacytoid Dendritic Cells and Cancer - New Insights. Open Access Maced. J. Med. Sci. 2019. 7(19). 3324-3340. Published 2019 Oct 13. doi: 10.3889/oamjms.2019.735.
26. Häfner S.J. The many (sur)faces of B cells. Biomed. J. 2019. 42(4). 201-206. doi: 10.1016/j.bj.2019.09.001.
27. Hannibal T.D., Schmidt-Christensen A., Nilsson J., Fransén-Pettersson N., Hansen L., Holmberg D. Deficiency in plasmacytoid dendritic cells and type I interferon signalling prevents diet-induced obesity and insulin resistance in mice. Diabetologia. 2017. 60(10). 2033-2041. doi: 10.1007/s00125-017-4341-0.
28. Harmon D.B., Srikakulapu P., Kaplan J.L. et al. Protective Role for B-1b B Cells and IgM in Obesity-Associated Inflammation, Glucose Intolerance, and Insulin Resistance. Arterioscler. Thromb. Vasc. Biol. 2016. 36(4). 682-691. doi: 10.1161/ATVBAHA.116.307166.
29. Hoffman W., Lakkis F.G., Chalasani G. B Cells, Antibodies, and More. Clin. J. Am. Soc. Nephrol. 2016. 11(1). 137-154. doi: 10.2215/CJN.09430915.
30. Hoober J.K., Eggink L.L., Cote R. Stories From the Dendritic Cell Guardhouse. Front. Immunol. 2019. 10. 2880. Published 2019 Dec 11. doi: 10.3389/fimmu.2019.02880.
31. Ivanov S., Merlin J., Lee M.K.S., Murphy A.J., Guinamard R.R. Biology and function of adipose tissue macrophages, dendritic cells and B cells. Atherosclerosis. 2018. 271. 102-110. doi: 10.1016/j.atherosclerosis.2018.01.018.
32. Ivanov S., Scallan J.P., Kim K.W. et al. CCR7 and IRF4-dependent dendritic cells regulate lymphatic collecting vessel permeability. J. Clin. Invest. 2016. 126(4). 1581-1591. doi: 10.1172/JCI84518.
33. Iwabuchi R., Ikeno S., Kobayashi-Ishihara M. et al. Introduction of Human Flt3-L and GM-CSF into Humanized Mice Enhances the Reconstitution and Maturation of Myeloid Dendritic Cells and the Development of Foxp3+CD4+ T Cells. Front. Immunol. 2018. 9. 1042. Published 2018 May 28. doi: 10.3389/fimmu.2018.01042.
34. Klemann C., Wagner L., Stephan M., von Hörsten S. Cut to the chase: a review of CD26/dipeptidyl peptidase-4's (DPP4) entanglement in the immune system. Clin. Exp. Immunol. 2016. 185(1). 1-21. doi: 10.1111/cei.12781.
35. Lee S., Ko Y., Kim T.J. Homeostasis and regulation of autoreactive B cells. Cell Mol. Immunol. 2020. 17(6). 561-569. doi: 10.1038/s41423-020-0445-4.
36. Lobo P.I. Role of Natural Autoantibodies and Natural IgM Anti-Leucocyte Autoantibodies in Health and Disease. Front. Immunol. 2016. 7. 198. Published 2016 Jun 6. doi: 10.3389/fimmu.2016.00198.
37. Luo X.L., Dalod M. The quest for faithful in vitro models of human dendritic cells types. Mol. Immunol. 2020. 123. 40-59. doi: 10.1016/j.molimm.2020.04.018.
38. Lutz M.B., Strobl H., Schuler G., Romani N. GM-CSF Monocyte-Derived Cells and Langerhans Cells As Part of the Dendritic Cell Family. Front. Immunol. 2017. 8. 1388. Published 2017 Oct 23. doi: 10.3389/fimmu.2017.01388.
39. Macdougall C.E., Longhi M.P. Adipose tissue dendritic cells in steady-state. Immunology. 2019. 156(3). 228-234. doi: 10.1111/imm.13034.;
40. Macdougall C.E., Wood E.G., Loschko J. et al. Visceral Adipose Tissue Immune Homeostasis Is Regulated by the Crosstalk between Adipocytes and Dendritic Cell Subsets. Cell Metab. 2018. 27(3). 588-601.e4. doi: 10.1016/j.cmet.2018.02.007.
41. McDonnell M.E., Ganley-Leal L.M., Mehta A. et al. B lymphocytes in human subcutaneous adipose crown-like structures. Obesity (Silver Spring). 2012. 20(7). 1372-1378. doi: 10.1038/oby.2012.54.
42. McGuire S. World Health Organization. Comprehensive Implementation Plan on Maternal, Infant, and Young Child Nutrition. Geneva, Switzerland, 2014. Adv. Nutr. 2015. 6(1). 134-135. Published 2015 Jan 15. doi: 10.3945/an.114.007781.
43. McKenna H.J., Stocking K.L., Miller R.E. et al. Mice lacking flt3 ligand have deficient hematopoiesis affecting hematopoietic progenitor cells, dendritic cells, and natural killer cells. Blood. 2000. 95(11). 3489-3497.
44. McKernan K., Varghese M., Patel R., Singer K. Role of TLR4 in the induction of inflammatory changes in adipocytes and macrophages. Adipocyte. 2020. 9(1). 212-222. doi: 10.1080/21623945.2020.1760674.
45. McLaughlin T., Ackerman S.E., Shen L., Engleman E. Role of innate and adaptive immunity in obesity-associated metabolic disease. J. Clin. Invest. 2017. 127(1). 5-13. doi: 10.1172/JCI88876.
46. Meyer-Bahlburg A. B-1 cells as a source of IgA. Ann. N. Y. Acad. Sci. 2015. 1362. 122-131. doi: 10.1111/nyas.12801.
47. Moro K., Yamada T., Tanabe M. et al. Innate production of T(H)2 cytokines by adipose tissue-associated c-Kit(+)Sca-1(+) lymphoid cells. Nature. 2010. 463(7280). 540-544. doi: 10.1038/nature08636.
48. Nishimura S., Manabe I., Takaki S. et al. Adipose Natural Regulatory B Cells Negatively Control Adipose Tissue Inflammation. Cell. Metab. 2013. 18(5). 759-766. doi: 10.1016/j.cmet.2013.09.017.
49. Patsouris D., Li P.P., Thapar D., Chapman J., Olefsky J.M., Neels J.G. Ablation of CD11c-positive cells normalizes insulin sensitivity in obese insulin resistant animals. Cell. Metab. 2008. 8(4). 301-309. doi: 10.1016/j.cmet.2008.08.015.
50. Pillai S., Cariappa A. The follicular versus marginal zone B lymphocyte cell fate decision. Nat. Rev. Immunol. 2009. 9(11). 767-777. doi: 10.1038/nri2656.
51. Reizis B. Plasmacytoid Dendritic Cells: Development, Regulation, and Function. Immunity. 2019. 50(1). 37-50. doi: 10.1016/j.immuni.2018.12.027.
52. Rettig T.A., Harbin J.N., Harrington A., Dohmen L., Fleming S.D. Evasion and interactions of the humoral innate immune response in pathogen invasion, autoimmune disease, and cancer. Clin. Immunol. 2015. 160(2). 244-254. doi: 10.1016/j.clim.2015.06.012.
53. Sanz I., Wei C., Jenks S.A. et al. Challenges and Opportunities for Consistent Classification of Human B Cell and Plasma Cell Populations. Front. Immunol. 2019. 10. 2458. Published 2019 Oct 18. doi: 10.3389/fimmu.2019.02458.
54. Schittenhelm L., Hilkens C.M., Morrison V.L. β2 Integrins As Regulators of Dendritic Cell, Monocyte, and Macrophage Function. Front. Immunol. 2017. 8. 1866. Published 2017 Dec 20. doi: 10.3389/fimmu.2017.01866.
55. Shaikh S.R., Haas K.M., Beck M.A., Teague H. The effects of diet-induced obesity on B cell function. Clin. Exp. Immunol. 2015. 179(1). 90-99. doi: 10.1111/cei.12444.
56. Sharabiani M.T., Vermeulen R., Scoccianti C. et al. Immunologic profile of excessive body weight. Biomarkers. 2011. 16(3). 243-251. doi: 10.3109/1354750X.2010.547948.
57. Sprangers S., de Vries T.J., Everts V. Monocyte Heterogeneity: Consequences for Monocyte-Derived Immune Cells. J. Immunol. Res. 2016. 2016. 1475435. doi: 10.1155/2016/1475435.
58. Srikakulapu P., McNamara C.A. B Lymphocytes and Adipose Tissue Inflammation. Arterioscler. Thromb. Vasc. Biol. 2020. 40(5). 1110-1122. doi: 10.1161/ATVBAHA.119.312467.
59. Stefanovic-Racic M., Yang X, Turner M.S. et al. Dendritic cells promote macrophage infiltration and comprise a substantial proportion of obesity-associated increases in CD11c+ cells in adipose tissue and liver. Diabetes. 2012. 61(9). 2330-2339. doi: 10.2337/db11-1523.
60. Sundara Rajan S., Longhi M.P. Dendritic cells and adipose tissue. Immunology. 2016. 149(4). 353-361. doi: 10.1111/imm.12653.
61. Suzuki K. Chronic Inflammation as an Immunological Abnormality and Effectiveness of Exercise. Biomolecules. 2019. 9(6). 223. Published 2019 Jun 7. doi: 10.3390/biom9060223.
62. Swiecki M., Colonna M. The multifaceted biology of plasmacytoid dendritic cells. Nat. Rev. Immunol. 2015. 15(8). 471-485. doi: 10.1038/nri3865.
63. Tedder T.F. B10 cells: a functionally defined regulatory B cell subset. J. Immunol. 2015. 194(4). 1395-1401. doi: 10.4049/jimmunol.1401329.
64. Van de Veen W., Stanic B., Wirz O.F., Jansen K., Globinska A., Akdis M. Role of regulatory B cells in immune tolerance to allergens and beyond. J. Allergy Clin. Immunol. 2016. 138(3). 654-665. doi: 10.1016/j.jaci.2016.07.006.
65. Wang L., Fu Y., Chu Y. Regulatory B Cells. Adv. Exp. Med. Biol. 2020. 1254. 87-103. doi: 10.1007/978-981-15-3532-1_8.
66. Wang Y., Liu J., Burrows P.D., Wang J.Y. B Cell Development and Maturation. Adv. Exp. Med. Biol. 2020. 1254. 1-22. doi: 10.1007/978-981-15-3532-1_1.
67. Waskow C., Liu K., Darrasse-Jèze G. et al. The receptor tyrosine kinase Flt3 is required for dendritic cell development in peripheral lymphoid tissues. Nat. Immunol. 2008. 9(6). 676-683. doi: 10.1038/ni.1615.
68. Weinstock A., Moura Silva H., Moore K.J., Schmidt A.M., Fisher E.A. Leukocyte Heterogeneity in Adipose Tissue, Including in Obesity. Circ. Res. 2020. 126(11). 1590-1612. doi: 10.1161/CIRCRESAHA.120.316203.
69. Winer D.A., Winer S., Shen L. et al. B cells promote insulin resistance through modulation of T cells and production of pathogenic IgG antibodies. Nat. Med. 2011. 17(5). 610-617. doi: 10.1038/nm.2353.
70. World Health Organization (WHO). Global Action Plan for the Prevention and Control of NCDs 2013–2020. Geneva: WHO, 2015. http://www.who.int/nmh/events/ncd_action_plan/en/. Accessed 2 Apr 2019.
71. Xiong H., Carter R.A., Leiner I.M. et al. Distinct Contributions of Neutrophils and CCR2+ Monocytes to Pulmonary Clearance of Different Klebsiella pneumoniae Strains. Infect. Immun. 2015. 83(9). 3418-3427. doi: 10.1128/IAI.00678-15.
72. Yin C., Mohanta S.K., Srikakulapu P., Weber C., Habenicht A.J. Artery Tertiary Lymphoid Organs: Powerhouses of Atherosclerosis Immunity. Front. Immunol. 2016. 7. 387. Published 2016 Oct 10. doi: 10.3389/fimmu.2016.00387.
73. Ying W., Wollam J., Ofrecio J.M. et al. Adipose tissue B2 cells promote insulin resistance through leukotriene LTB4/LTB4R1 signaling. J. Clin. Invest. 2017. 127(3). 1019-1030. doi: 10.1172/JCI90350.
74. Zhai X., Qian G., Wang Y. et al. Elevated B Cell Activation is Associated with Type 2 Diabetes Development in Obese Subjects. Cell. Physiol. Biochem. 2016. 38(3). 1257-1266. doi: 10.1159/000443073.

/100.jpg)
/101.jpg)
/102_2.jpg)
/102.jpg)
/103.jpg)
/104.jpg)
/105.jpg)
/106.jpg)
/107.jpg)
/109.jpg)