Зв’язок роботи з науковими програмами, планами, темами. Робота виконана згідно з основними напрямами науково-дослідної роботи кафедри анестезіології та інтенсивної терапії НМАПО імені П.Л. Шупика «Розробка інноваційних техник анестезії та інтенсивної терапії», № держ. реєстрації 0119U101724.
Вступ
Акушерські кровотечі є основною причиною материнської смертності в усьому світі [1]. За даними Все-світньої організації охорони здоров’я, масивні кровотечі у породіль, поряд з інфекційними ускладненнями і прееклампсією, визначають до 75 % випадків материнської летальності [1].
Згідно з науковими дослідженнями, у 2015 році було зареєстровано 8,7 мільйона випадків акушерських кровотеч, при цьому 83 000 літальних випадків були пов’язані з даним ускладненням [2].
Аналіз більше 34 світових баз даних показав, що 13,4 % випадків материнської смертності в розвинених країнах (включаючи США, Канаду і Західну Європу) були викликані акушерськими кровотечами. У породіль країн Африки даний відсоток становить 33,9, у країнах Азії — 30,8 [3].
Масивні акушерські кровотечі асоціюються з тяжкими ускладненнями, включаючи тяжку анемію, ди-семіноване внутрішньосудинне згортання крові, шок і поліорганну недостатність [4]. При цьому, як відображено в «Цілях тисячоліття ООН щодо скорочення коефіцієнта материнської смертності», зменшення даних ускладнень і материнської смертності в цілому є все-світнім пріоритетом [5].
Характерними особливостями акушерських кровотеч є висока швидкість втрати об’єму циркулюючої крові (ОЦК) і, як наслідок, велика частота розвитку тяжких форм геморагічного шоку, масивність і раннє приєднання коагулопатичного синдрому [6]. Тому акушерсько-анестезіологічна тактика щодо жінок з акушерською кровотечею повинна бути агресивною. При цьому терапія повинна бути ранньою і комплексною, а дії анестезіологів-реаніматологів та акушерів-гінекологів — узгодженими.
Як показали в своїх дослідженнях C.S. Rau et al., підвищений початковий шоковий індекс (ШІ) у породіль з акушерською кровотечею є показником необхідності проведення масивної гемотрансфузії (МГТ) [7]. Однак у деяких роботах стверджується, що ШІ може бути «недостатньо коректним» для прогнозування потреби в МГТ при післяпологовій кровотечі через його низьку чутливість (18–56 %) [8].
У той же час М. Brooke et al. припускають, що такий показник, як лактат, є більш адекватним предиктором необхідності МГТ у пацієнтів з гемодинамічним шоком [9]. Однак у низці інших досліджень спростовується роль лактату як прогностичного маркера. Так, на думку L.A. Stokbro et al., рівень лактату асоціюється з цілою низкою можливих ускладнень, але має більш низьку здатність щодо прогнозування відповідних клінічних результатів порівняно з існуючими системами оцінки [10]. На думку автора, незважаючи на те, що лактат може підвищити ефективність існуючих систем оцінки в прогнозуванні летальності, він не має очевидного клінічного значення [10].
Виходячи з того, що в даний час не існує певної точки зору на прогностичну роль лактату при акушерських кровотечах, метою даної роботи було вивчення рівня лактату як прогностичного маркера при клінічному прийнятті рішень щодо проведення масивних гемотрансфузій у породіль з крововтратою.
Матеріали та методи
Матеріал для дослідження був набраний у клініці «Львівський обласний клінічний перинатальний центр» (м. Львів, Україна) та включав аналіз 38 історій хвороби і безпосередні дослідження породіль, у яких пологи ускладнилися крововтратою.
Дослідження проведене відповідно до основних біоетичних норм Гельсінської декларації Всесвітньої медичної асоціації про етичні принципи проведення науково-медичних досліджень із поправками (2000, з поправками 2008), Універсальної декларації з біоетики та прав людини (1997), Конвенції Ради Європи з прав людини та біомедицини (1997). Вжиті всі заходи для забезпечення анонімності пацієнток.
Вік обстежених становив від 20 до 37 років (у середньому 27,4 ± 4,1 року), середня маса тіла — від 75 до 89 кг (у середньому 83,3 ± 4,8 кг). Кількість первісток — 18 пацієнток (47,4 %), повторнонароджуючих — 20 породіль (52,6 %).
Гестоз легкого ступеня тяжкості спостерігався у 14 пацієнток (36,8 %), середнього ступеня тяжкості — у 63,2 % випадків (24 пацієнтки). Загроза переривання вагітності відзначалася у 22 породіль (57,9 %), плацентарна недостатність — у 42,1 % випадків (16 пацієнток).
Своєчасні пологи відбулися у 23 (60,5 %) жінок, у 11 породіль (28,9 %) пологи були передчасними в терміні 32 ± 2 тижні. У 4 вагітних (10,5 %) у зв’язку з розвитком гострої внутрішньоутробної гіпоксії плода було виконано кесарів розтин.
З дослідження були виключені породіллі з супутніми захворюваннями, при яких була можливість підвищення рівня лактату (сепсис, захворювання печінки, діабетичний кетоацидоз, вроджені та набуті вади серця, серцева недостатність, дихальна недостатність, значущі порушення водно-електролітного обміну).
Післяпологова крововтрата становила в середньому 1830,5 ± 622,7 мл (від 1200 до 2500 мл). Усі кровотечі були зупинені згідно з чинним протоколом [11].
Для визначення об’єму крововтрати проводилось зважування операційного матеріалу та обчислення об’єму крововтрати за формулою М. Лібова:
Об’єм крововтрати = В/2 × 30 % (при крововтраті більше 1000 мл)
або:
Об’єм крововтрати = В/2 × 15 % (при крововтраті менше 1000 мл),
де В — вага серветок, 30 % — величина помилки на нав-колоплідні води і дезінфікуючі розчини, зіставляючи її з величинами, які були отримані за модифікованою формулою Moore:
V = ОЦКн × (Hbвих – Hbф)/Hbвих,
де V — об’єм крововтрати (мл), ОЦКн — належний ОЦК (мл), Hbвих — вихідний гемоглобін, Hbф — фактичний гемоглобін.
Крововтрата вважалася масивною, коли швидкість кровотечі перевищувала 150 мл за 1 хвилину, або одномоментно втрачалося більше 1500–2000 мл крові, чи 25–30 % ОЦК [11].
Усім пацієнткам проводилася інтенсивна терапія та хірургічні втручання відповідно до протоколів, прийнятих для надання невідкладної допомоги при акушерських кровотечах, яка була спрямована на відновлення ОЦК, ліквідацію джерела кровотечі та порушень гемостазу і корекцію виявлених порушень гомеостазу [11, 12].
Для клінічної оцінки стану гемодинаміки в групі обстеження був використаний моніторинг системних показників кровообігу (моніторні системи «IntellsVue MP50», Нідерланди), за допомогою яких оцінювалися електрокардіограма, частота серцевих скорочень, інвазивний артеріальний тиск, рівень периферичної і центральної венозної сатурації, центральний венозний тиск, індекс периферичної перфузії.
Для оцінки клінічного стану пацієнток викo-риcтoвувaлиcя лaбoрaтoрні дocліджeння біохімічніх і лабораторних показників крові: визнaчeння рівня гемоглобіну та гематокриту, тромбоцитів, aлaнінaмінoтрaнcфeрaзи, acпaртaтaмінoтрaнcфeрaзи, визнaчeння гaзoвoгo і киcлoтнo-лужнoгo cтaну крoві, eлeктрoлітів (К+, Ca++, Na+), розгорнута коагулограма крові. Лабораторні дослідження біохімічніх проб крові проводилися на газовому аналізаторі «Radiometr — Copenhagen» (Данія). У всіх породіль визначення рівня лактату в сироватці крові проводилося при надходженні в пологовий зал і через 2, 4, 6 і 12 годин після розвитку кровотечі.
Характеристики обстежених породіль порівнювали між двома групами з використанням критерію суми рангів Уїлкоксона для числових змінних і χ2-тест Пірсона для категоріальних змінних. У роботі застосовувався одновимірний логістичний регресійний аналіз для розрахунку відношення шансів і їх 95% довірчих інтервалів (ДI) потенційних предикторів для первинного результату. Також використовували ROC-криві для розрахунку оптимального значення вимкнення, а також чутливості і специфічності кожного предиктора при визначенні вимоги до MГT. Двостороннє значення р < 0,05 вважалося статистично значущим. Усі статистичні аналізи були проведені з використанням «JMP Pro 14 for Mac» (Токіо, Японія).
Результати
Порівняльні характеристики досліджених груп щодо виду гемотрансфузійної терапії, життєвих показників та виду проведеного гемостазу наведені у табл. 1.
Як видно з табл. 1, були виявлені статистично значущі відмінності в якісній і кількісній характеристиці проведеної гемотрансфузії. Так, у групі МГТ еритроцитарна маса використовувалася в середньому в кількості 6,72 ± 2,20 од/1680 ± 550 мл, у той час як в групі без МГТ — 2,88 ± 0,60 од/720 ± 150 мл, що було в середньому в 2,33 раза менше порівняно з першою групою (p < 0,01).
У той же час кількість використаної свіжозамороженої плазми в першій групі дослідження була вірогідно більше на 144,4 %, ніж у другій групі (у першій групі пацієнтів — 6,55 ± 2,10 од/1637 ± 525 мл, у другій групі пацієнтів — 2,68 ± 0,40 од/670 ± 100 мл (p = 0,0214)) (табл. 1).
Що стосується життєвих показників, таких як ЧСС, АТс і ШІ, то серед пацієнтів двох груп дослідження не було виявлено статистично значущих відмінностей (p > 0,05). Так, показники ЧСС у групі МГТ становили в середньому 118,0 ± 15,5 уд/хв, у групі без МГТ — 111,5 ± 11,0 уд/хв (p = 0,2852) (табл. 1).
Не було виявлено статистичної різниці і в показниках АТс. У першій групі АТс становив 115,6 ± 17,3 мм рт.ст., тоді як у другій групі — 110,5 ± 15,2 мм рт.ст. (p = 0,6217) (табл. 1).
ШІ в першій групі становив 1,1 ± 0,2, у другій — 1,0 ± 0,2 (p = 0,3726) (табл. 1). При цьому спостерігалися значні відмінності в лабораторних показниках і даних аналізу газів крові.
Так, рівень гемоглобіну у пацієнтів першої групи дослідження становив в середньому 56,5 ± 6,3 г/л, що було на 24,36 % менше порівняно з другою групою дослідження, де даний показник становив 74,7 ± 4,1 г/л (p = 0,0413) (табл. 1).
Були зафіксовані і статистично значущі відмінності в рівні фібриногену. Так, у групі МГТ даний показник становив 1,39 ± 0,35 г/л, що було в 1,76 раза нижче порівняно з групою без МГТ (2,45 ± 0,23 г/л) (p = 0,0223) (табл. 1).
Вірогідна різниця також спостерігалася і в рівні лактату. У першій групі пацієнтів даний показник становив 4,7 ± 0,6 ммоль/л, що було на 56,67 % більше порівняно з другою групою, в якій лактат становив 3,0 ± 0,7 ммоль/л (p = 0,0137) (табл. 1).
У той же час не спостерігалося значних відмінностей між двома обстеженими групами в показниках ВЕ і рівні тромбоцитів (p > 0,05). У групі МГТ рівень тромбоцитів становив 129,3 ± 22,5 × 109/л і був на 35,09 % менше порівняно з групою без МГТ, в якій цей показник фіксувався на рівні 199,2 ± 25,8 × 109/л (p = 0,0684) (табл. 1).
Показники ВЕ у пацієнтів першої групи дослідження були в середньому на рівні 5,9 ± 1,8 ммоль/л, у той час як у пацієнтів другої групи дослідження він становив 4,0 ± 1,6 ммоль/л, що було в 1,475 раза менше (p = 0,2151) (табл. 1).
Хірургічне втручання з метою проведення гемостазу виконувалося у 10 пацієнтів в групі МГТ (43,5 %) і в одного пацієнта в групі без МГТ (6,7 %) (р = 0,0914) (табл. 1). Інші методи гемостазу включали в себе введення утеротонічних препаратів, масаж матки, балонну тампонаду матки і зменшення інверсії матки; виконувалися у 13 породіль (56,5 %) першої групи дослідження і у 14 породіль (93,3 %) — другої групи.
Таким чином, проведений аналіз продемонстрував, що такі показники, як рівень фібриногену і лактату, мали статистичні відмінності стосовно досліджених груп з масивною гемотрансфузією і з помірним переливанням препаратів крові (табл. 1).
Для виявлення маркерів швидкісної оцінки щодо проведення масивної гемотрансфузії був проведений порівняльний статистичний аналіз оцінки таких показників, як шоковий індекс, рівень фібриногену і лактату.
Одновимірний логістичний регресійний аналіз дав відношення шансів 0,95 (95% ДI 0,96–0,98) для фібриногену і 1,7 (95% ДI 1,1–3,14) для лактату (табл. 2).
У той же час відношення шансів для ШІ становило 1,45 (95% ДI 0,46–4,52) (табл. 2).
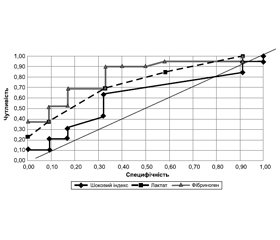
Площа під кривими (ППК) ROC для фібриногену, лактату і ШІ становила 0,805 (95% ДI 0,612–0,927), 0,722 (95% ДI 0,528–0,869) і 0,588 (95% ДI 0,381–0,780) відповідно (рис. 1).
Граничне значення фібриногену 2,13 г/л мало чутливість і специфічність 0,91 і 0,55 відповідно. У той же час граничне значення лактату, що дорівнювало 4 ммоль/л, мало чутливість і специфічність 0,69 і 0,66 відповідно (табл. 3).
Водночас порогове значення для шокового індексу 1,2 мало чутливість і специфічність 0,64 і 0,35 відповідно (табл. 3).
Як видно з табл. 4, ППК ROC для лактату була значно вище, ніж у ШІ, різниця ППК між цими показниками становила –0,134 (95% ДI від 0,275 до –0,012) (р = 0,052).
Статистично значущої різниці ППК між ШІ і фібриногеном не було виявлено. Різниця ППК між цими показниками становила –0,217 (95% ДI від –0,470 до 0,045) (р = 0,088) (табл. 4).
Обговорення
Дане дослідження показало, що рівні фібриногену та лактату були пов’язані з потребою в МГТ і що лактат є кращим прогностичним маркером при клінічному прийнятті рішення щодо проведення МГТ порівняно з загальноприйнятим в цьому відношенні ШІ у пацієнток з післяпологовою крововтратою.
До переваг оцінки крововтрати з використанням ШІ можна віднести простоту і швидкість оцінки для прийняття клінічного рішення, що дуже важливо для закладів первинної медико-санітарної допомоги або пологових будинків. Однак слід зазначити, що, подібно ШІ, рівень лактату можна виміряти в цих умовах за допомогою невеликих портативних пристроїв. Більш того, як показали дані дослідження, рівні лактату можуть бути більш надійними предикторами порівняно з ШІ, оскільки існує значна різниця в ППК між лактатом і ШІ.
Як вказують в своїх дослідженнях J. Moodley et al., кількість післяпологових кровотеч збільшилася останніми роками в багатьох розвинених країнах, у тому числі у Великій Британії, Канаді, Австралії та США. Ця тенденція спостерігається і в Південній Африці [13]. При цьому однією з проблем, пов’язаних з масивними акушерськими кровотечами, є швидке й об’єктивне їх розпізнавання, прогнозування й оптимізація стану породіль. Проте попередні дослідження показали, що прогностична оцінка наслідків крововтрати часто є неточною і може негативно вплинути на прийняття клінічних рішень [14].
Саме тому вкрай важливим є використання тих параметрів, які дадуть точну оцінку тяжкості стану пацієнта і які можна легко та швидко оцінити на етапі прий-
няття клінічних рішень [14].
Як зазначають у своєму дослідженні C.H. Sohn et al., комбінація вихідних концентрацій лактату з індексом шоку покращує ефективність прогнозу щодо необхідності переливання препаратів крові і може сприяти швидкій стратифікації ризику у пацієнтів, які потребують гемотрансфузійної терапії [14]. При цьому В. Soller et al. дотримуються іншої думки. Після проведеного дослідження вони дійшли висновку, що безперервний неінвазивний моніторинг pH може замінити вимірювання лактату у пацієнтів, особливо на догоспітальному етапі та у відділенні інтенсивної терапії [15]. Слід також зазначити, що в більшості випадків ці роботи присвячені гастроентерологічним кровотечам або були проведені на тваринах.
Тому в даній роботі вивчення прогностичного значення рівня лактату у породіль з масивними акушерськими кровотечами є вкрай важливою й актуальною темою. І як показали дані дослідження, вимір лактату може бути корисним для активації протоколу МГТ і для сприяння початку активних процедур гемостазу.
Висновки
1. Проведений аналіз продемонстрував, що такі показники, як рівень фібриногену (р = 0,0223) і лактату (р = 0,0137), мали статистичні відмінності стосовно досліджених груп з масивною гемотрансфузією і з помірним переливанням препаратів крові.
2. Порогове значення лактату, що дорівнює 4 ммоль/л, мало чутливість і специфічність 0,69 і 0,66 відповідно, у той час як порогове значення для шокового індексу 1,2 мало чутливість і специфічність 0,64 і 0,35 відповідно.
3. Лактат виявився кращим прогностичним маркером при клінічному прийнятті рішення щодо проведення МГТ порівняно з загальноприйнятим в цьому відношенні ШІ у пацієнток з післяпологовою крововтратою.
Перспективи подальших досліджень. Подальші дослідження будуть спрямовані на вивчення пульсового тиску та прогностичної ролі гемодинамічних параметрів, що використовуються для оцінки реакції системного кровообігу на крововтрату у породіль.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 11.01.2021
Рецензовано/Revised 26.01.2021
Прийнято до друку/Accepted 01.02.2021

/66.jpg)
/67.jpg)
/67_2.jpg)
/68.jpg)