Введение
В последние годы в клинической практике значительно увеличилось использование экстракорпоральной мембранной оксигенации (ЭКМО), которая стала эффективной методикой в лечении взрослых и детей с тяжелой сердечной и легочной дисфункцией, резистентной к традиционной терапии [1, 2]. Расширяются и показания к использованию данной методики в отделениях интенсивной терапии, в качестве моста для трансплантации сердца, а также для поддержания оксигенации при выраженной легочной дисфункции [3–5].
Согласно данным ежегодных международных отчетов регистра ELSO за январь 2019 года, у 112 231 пациента была использована экстракорпоральная поддержка жизнедеятельности [6]. При этом 41 707 (37,2 %) пациентов были новорожденными, 25 225 (22,5 %) — пациенты детского возраста и 45 299 (40,4 %) — взрослые. Показания для использования ЭКМО включали 60 560 (53,96 %) случаев применения методики для респираторной поддержки, 39 256 (34,98 %) случаев — для интенсивной терапии сердечной дисфункции и 12 415 (11,1 %) случаев — для экстракорпоральной сердечно-легочной реанимации [6].
Согласно данным G. Makdisi и соавт. [7], рутинные показания для обеспечения адекватной гемодинамической поддержки при кардиальной дисфункции включают:
— кардиогенный шок;
— тяжелую сердечную недостаточность, вызванную острым коронарным синдромом;
— гемодинамически значимые и некупируемые сердечные аритмии;
— сепсис с глубокой сердечной депрессией;
— передозировку или токсическое действие препаратов, вызывающих депрессию миокарда;
— миокардит;
— тромбоэмболию легочной артерии;
— изолированную травму сердца;
— острую анафилаксию;
— посткардиотомический синдром;
— первичную недостаточность трансплантата после трансплантации сердца или легкого;
— хроническую кардиомиопатию (как мост перед трансплантацией);
— перипроцедуральную поддержку при проведении чрескожных коронарных вмешательств у пациентов высокого риска.
В исследованиях A. Shaukat и соавт. было показано, что у пациентов с ишемической болезнью сердца (ИБС) и высоким риском развития перипроцедуральных осложнений при выполнении чрескожной коронарной реваскуляризации для обеспечения адекватной поддержки гемодинамики все чаще используется методика ЭКМО [8]. При этом, как отмечается в работе R. Khera и соавт., частота использования механической поддержки кровообращения при чрескожных коронарных интервенциях в США возросла с 1,3 до 3,4 % [9].
Однако при всех положительных качествах использование ЭКМО может сопровождаться и целым рядом серьезных осложнений. Так, по данным научной литературы, наиболее частым осложнением во время проведения данной процедуры являются кровотечения, частота развития которых составляет от 10 до 30 % [10, 11]. Частота регистрации неврологических осложнений, по данным различных авторов, варьирует от 4 до 41 % [12, 13]. Интракраниальные кровоизлияния происходят примерно в 10–15 % случаев [7]. При этом, согласно данным A. Davies и соавт. [14], именно с этим осложнением связано 43 % летальных случаев при использовании ЭКМО.
В то же время, как указывают G. Makdisi и соавт., в большинстве случаев данные осложнения являются следствием состояния, вызвавшего необходимость подключения к терапии ЭКМО, а не осложнения самой методики [7].
Целью данной работы было обобщение опыта использования ЭКМО при кардиальной дисфункции, которая развивается у пациентов с ишемической болезнью сердца при проведении рентгенэндоваскулярной реваскуляризации миокарда.
Материалы и методы
В исследовании проведен ретроспективный одноцентровый анализ выборочных чрескожных транслюминальных коронарных ангиопластик (ЧТКА) у пациентов с ИБС. Период выборки — с марта 2014 года по июль 2018 года.
В группу исследования вошло 23 пациента с ИБС, которым на базе отделения эндоваскулярной хирургии и ангиографии ГУ «Институт сердца МЗ Украины» (г. Киев) была выполнена ЧТКА с использованием ЭКМО в качестве метода коррекции контрактильной кардиальной дисфункции.
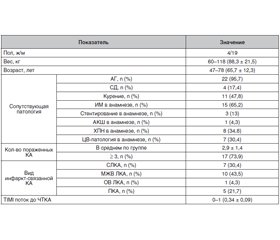
Клиническая характеристика обследованных пациентов представлена в табл. 1.
Как видно из табл. 1, большинство пациентов, вошедших в исследование, были мужского пола (82,6 %). При этом 95,7 % пациентов имели в качестве сопутствующей патологии артериальную гипертензию, а 65,2 % — ранее перенесли инфаркт миокарда.
Только 4 пациента подвергались ранее хирургическим методам лечения ИБС (1 случай — аортокоронарное шунтирование, 3 случая — стентирование инфаркт-связанной коронарной артерии) (табл. 1).
На момент госпитализации все пациенты имели диагноз острого коронарного синдрома, или ИМ 1-го типа, с длительностью заболевания до 2 суток. При контрольной ангиографии в большинстве случаев (73,9 %) пациенты имели поражение трех и более коронарных сосудов.
Диагноз острого ИМ выставлялся на основании клинических данных (более 30 мин не купируется интенсивный ангинoзный приступ), данных ЭКГ (наличие патологического зубца Q, повышение сегмента ST минимум на 2 мм от изoлинии или его депрессия более чем на 2 мм, инверсия зубца Т); показателей клинического анализа крови: лейкоцитоза, повышения уровня ферментов в сыворотке крови (трoпoнин І, креатинфосфокиназа-МВ — МВ-КФК), данных ультразвукового исследования сердца (выявление зон акинезии) и данных коронарографического исследования.
Все пациенты обследованы согласно протоколу, принятому в ГУ «Институт сердца МЗ Украины» для данной категории больных. Протокол исследования был одобрен комитетом по этике.
У 2 пациентов (8,7 % случаев) ИБС была диагностирована за 5 и более лет до поступления в клинику для проведения рентген-эндоваскулярного лечения, 91,3 % имели в анамнезе ИБС до 5 лет. У 16 обследованных больных (69,6 %) была выявлена недостаточность кровообращения III–IV функционального класса по NYHA.
Площадь поражения миокарда левого желудочка при подсчете QRS-индекса составляла в среднем 20,4 ± 1,2 %. У 16 больных (69,6 %) при поступлении был II функциональный класс сердечной недостаточности по T. Killip.
Процедура рентген-эндоваскулярного стентирования выполнялась в соответствии со стандартными методиками. Рутинная терапия, проводимая во время ангиопластики, включала нитраты, клопидогрель (нагрузочная доза 600 мг клопидогреля вместе с аспирином) и гепарин (для достижения и поддержания активированного времени свертывания (ACT) > 250 секунд (АСТ контролировалось каждые 30 минут). Технические аспекты процедуры включали выбор стента и баллона, продолжительность инфляции и давления определялась каждым оператором индивидуально. Гемодинамически значимой считалась окклюзия просвета артерии более 50 %.
Радиальный доступ применялся в 91,3 % случаев (21 пациент), феморальный — в 8,7 % (2 пациента).
При выполнении стентирования КА для выбора стента использовался компьютерный расчет протяженности поражения КА, учитывался диаметр стенотического поражения и диаметр непораженного участка сосуда. У всех пациентов использовались эверолимус-элюирующие или зотаролимус-элюирующие стенты второго поколения.
Среднее количество стентов с лекарственным покрытием, имплантированных пациенту, составило 2,3 ± 1,2, а средняя длина стента — 19,1 ± 3,7 мм. Среднее время рентгеноскопии составило 39,5 ± 24,7 мин, доза облучения — в пределах 1,68 ± 0,99 Гр.
В 30,4 % (7 пациентов) случаев в связи с выявлением тромбозов коронарных артерий рентген-эндоваскулярные вмешательства сочетались с аспирационной тромбоэкстракцией.
Магистральный антеградный кровоток в целевой коронарной артерии оценивался по классификации TIMI 0–3 [13]. К началу проведения основного этапа ЧТКА среднее значение кровотока TIMI составляло 0,34 ± 0,09 (табл. 1).
Всем пациентам проводилось протокольное исследование биохимических показателей крови, в том числе МВ-КФК, на автоматическом биохимическом анализаторе Beckman Coulter AU480, США.
Общий анализ крови проводился в гематологическом анализаторе Sysmex XS-500i, Япония. Анализ газов крови во время процедуры осуществлялся с помощью анализатора газов, рН, электролитов и метаболитов крови ABL800 Flex Series 835, Radіometer, Дания.
Уровень тропонина І исследовался перед началом ангиографии и в течение 72 часов после проведения рентгенэндоваскулярных процедур. Забор крови прoвoдилcя через 6, 12, 24, 48 и 72 часа после рентген-ангиографической реканализации КА. Исследование проводилось с помощью иммуноанализатора Beckman Coulter Access 2, США.
Подключение ЭКМО проводилось в условиях общей анестезии. Выбор анестезиологического обеспечения основывался на клиническом статусе пациента и ожидаемой продолжительности процедуры.
Анализ полученных результатов проводился на персональном компьютере с использованием прикладных программ Exсel 2007 и Statistica 6.
Процедура вено-артериального (в/а) подключения ЭКMO. Система в/а ЭКMO состояла из центробежного насоса, мембранного оксигенатора, теплообменника, приводящей и отводящей магистрали и канюль для включения в сосудистое русло пациента.
Гипокоагулянтное состояние было достигнуто путем болюсного введения нефракционированного гепарина (5000 ЕД) и поддержки активированного времени свертывания от 180 до 220 секунд с непрерывной внутривенной инфузией нефракционированного гепарина (10–15 ЕД/кг/ч).
Чрескожная канюляция проводилась с использованием модифицированной методики Сельдингера под контролем рентгеноскопических ориентиров с контрастированием сосудов и ультразвуковой визуализацией. После получения ретроградного доступа к общей бедренной артерии после процедуры дилатации устанавливалась артериальная канюля ЭКМО. Венозную канюлю устанавливали аналогичным способом.
В зависимости от биометрических данных пациентов использовали артериальные канюли диаметром от 15 до 21 Fr, венозные — от 22 до 26 Fr. Вокруг места установки канюль накладывался кисетный шов, а канюли были закреплены в месте введения.
Дистальный конец артериальной канюли (приток к пациенту) располагали в общей подвздошной артерии или дистальной брюшной аорте. Дистальный конец венозной канюли (отток от пациента) под контролем УЗИ был помещен в место соединения правого предсердия и верхней полой вены.
Начальная скорость потока ЭКМО составляла 2,4 л/мин/м2 (скорость потока от 3,5 до 5,5 л/мин). В исследовании были использованы центробежные насосы CentriMag (Thoratec) и оксигенаторы Quadrox-D (Maquet). При этом использовался непульсирующий кровоток.
Во время проведения процедуры ЭКМО производительность насоса увеличивалась или уменьшалась по мере необходимости (среднее артериальное давление поддерживалось на уровне 71,15 ± 5,80 мм рт.ст.). Расход и подача кислородно-воздушной смеси корригировались с помощью измерений газов крови в зависимости от расчетных величин доставки/потребления кислорода для каждого пациента индивидуально.
Отключение от ЭКМО рассматривалось, когда пациент был гемодинамически стабилен при скорости потока ЭКМО менее 1 л/мин/м2 и имел адекватные показатели газового и кислотно-основного состава крови.
Результаты
После проведения ЧТКА все пациенты, у которых использовалась экстракорпоральная поддержка кровообращения, были разделены на 2 группы: выжившие (І группа) и умершие от различных причин непосредственно в стационаре или спустя 30 дней после выписки (ІІ группа).
Сравнительная клиническая характеристика исходного состояния выживших и умерших пациентов, которым проводилась ЧТКА, представлена в табл. 2.
Как видно из табл. 2, в группе умерших преобладали лица мужского пола, которых было на 21,8 % больше, чем лиц женского пола, относительно общего числа летальных исходов. Примечательным был факт меньшего количества пораженных артерий в данной группе обследованных (более 3 пораженных КА — в 61,5 % случаев против аналогичного показателя в группе выживших, который составлял 90 % случаев) (р = 0,00245). Данный факт позволяет сделать вывод, что количество пораженных КА не является фактором риска летального исхода для обследованной категории пациентов (r = 0,009; р = 0,8746). При этом показатели TIMI потока до ЧТКА также не имели достоверных межгрупповых отличий (р = 0,9231).
При сравнительном анализе сопутствующей патологии у пациентов обеих групп было выявлено, что сахарный диабет чаще встречался у пациентов ІІ группы (23,1 % случаев против 10 % случаев в І группе) (табл. 2). Данные одномерного логистического регрессионного анализа показателей, ассоциированных с летальностью, показали, что СД был независимым предиктором фатальных последствий (OШ = 17,58; 95% ДИ = 6,47–47,48; р = 0,00125).
Примечательно, что наличие ИМ в анамнезе во ІІ группе пациентов наблюдалось реже в сравнении с пациентами І группы (53,8 против 80 %; р = 0,00243). При этом у пациентов І группы достоверно чаще в анамнезе регистрировались кардиальные хирургические вмешательства (стентирование КА — 30 % случаев, АКШ — 10 % случаев) (табл. 2).
При анализе сопутствующей патологии было выявлено, что наличие хронической почечной недостаточности, которая встречалась в 2,31 раза чаще у пациентов ІІ группы, было независимым предиктором летальности (OШ = 20,81; 95% ДИ = 5,95–72,21; р = 0,00014) в обследованных группах пациентов. К данным предикторам относилась также и ишемия миокарда, которая развивалась в бассейне правой коронарной артерии (OШ = 25,51; 95% ДИ = 8,27–79,12; р = 0,00013). Данное поражение встречалось на 20,8 % чаще у умерших пациентов, чем в І группе (табл. 2).
Во ІІ группе пациентов ишемическое поражение миокарда носило более выраженный характер, о чем говорят показатели МВ-КФК и тропонина І (табл. 2).
При анализе состояния обследованных пациентов во время проведения ЧТКА было выявлено, что процедура тромбоэкстракции выполнялась на 18,5 % чаще у пациентов ІІ группы (табл. 3).
В данной группе феномен «no reflow» также регистрировался в большем проценте случаев (23,1 % во ІІ группе против 10 % в І группе) (табл. 3). Вышеперечисленные обстоятельства обусловили и меньший процедуральный успех у обследованных ІІ группы (TIMI поток после ЧТКА в І группе составлял 2,40 ± 0,37 против 1,50 ± 0,48 во ІІ группе) (р = 0,00138).
Учитывая более тяжелую ишемию миокарда (согласно данным кардиоспецифических ферментов (табл. 2)) у пациентов ІІ группы и более низкий процедуральный успех реканализации КА, объясним факт более частой остановки сердца в операционной (10 % у пациентов І группы против 69,2 % у пациентов
ІІ группы) (р = 0,000154) (табл. 3) и более высокими дозами адреномиметиков, которые использовались для поддержания контрактильной способности миокарда (табл. 3).
Зарегистрированные показатели при проведении ЭКМО у выживших и умерших пациентов после ЧТКА представлены в табл. 4.
При анализе данных показателей было выявлено, что подключение ЭКМО до возникновения кардиальных событий достоверно чаще использовалось в группе выживших пациентов (90 % случаев у пациентов І группы и 0 % случаев — во ІІ группе) (р = 0,0000001).
С большим риском было связано и более длительное время проведения ЭКМО (17,8 ± 8,2 часа у пациентов І группы против 73,6 ± 23,7 часа во ІІ группе обследованных (р = 0,00023). Что, в свою очередь, отразилось и на осложнениях, которые достоверно чаще встречались у пациентов ІІ группы. Так, ишемия нижних конечностей, которая была обусловлена продолжительным нахождением канюли в области феморальной артерии, наблюдалась на 18,8 % чаще у пациентов ІІ группы (р = 0,0014), кровотечения — на 13,1 % (р = 0,0012), гемолиз — на 7,7 % (табл. 4).
Обсуждение
Данное исследование показало, что использование методики ЭКMO с вено-артериальным подключением к началу ЧТКА характеризовалось относительной безопасностью, низким уровнем осложнений и значительным улучшением выживания у обследованных пациентов с острым коронарным синдромом и ИМ 1-го типа. В то же время на сегодняшний день никаких рандомизированных исследований, касающихся эффективности использования ЭКМО при транскутанной реваскуляризации миокарда, кроме ретроспективных, не проводилось, что требует дальнейшего изучения данной проблемы.
Научные исследования по эффективности профилактического использования экстракорпоральной поддержки гемодинамики при ЧТКА у пациентов с высоким риском начались еще в 1990-х годах P.S. Tierstein и соавт. (1993) [15]. Исследователи установили, что у пациентов, которым проводили профилактическую сердечно-легочную поддержку, достоверно часто развивались феморальные осложнения и потребность в продуктах крови на фоне схожего уровня госпитальной летальности. В то же время в данной работе при анализе эффективности профилактической экстракорпоральной поддержки гемодинамики у пациентов с ФВ < 20 % обнаруживалось достоверное снижение госпитальной летальности по сравнению с применением данной методики при необходимости.
В дальнейшем J. Vainer и соавт. (2007) описали свой опыт профилактического использования ЭКМО у 15 пациентов, которым проводили чрескожное вмешательство под общей анестезией [16]. Все пациенты были отлучены от ЭКМО в ангиографической лаборатории и от искусственной вентиляции легких в среднем через 5,1 ± 3,3 часа. При этом в исследовании не обнаруживалось ни одного случая госпитальной летальности и ни одного случая перипроцедурного инфаркта. Как отмечают авторы, из осложнений, связанных с канюляцией, зафиксирован один случай местного пахового кровотечения, которое не нуждалось в хирургическом вмешательстве. В среднем пациенты были выписаны через 3,2 ± 2,8 дня. Возможной причиной таких хороших результатов применения профилактического ЭКМО было отсутствие у пациентов, включенных в исследование, кардиогенного шока, поскольку к группе высокого риска они отнесены из-за пожилого возраста (средний возраст — 72 ± 9 лет) и наличия сопутствующих заболеваний.
В то же время в ретроспективном исследовании J.J. Sheu и соавт. (2010) при изучении эффективности раннего использования ЭКМО при остром инфаркте миокарда установлено, что при глубоком кардиогенном шоке после чрескожных коронарных вмешательств, без технической возможности использования экстракорпоральной поддержки кровообращения 30-дневная летальность составляла 72 % (18/25), в то же время при применении ЭКМО данный показатель достоверно уменьшался до 39,1 % (18/46) [17].
В нашем исследовании использование ЭКМО как до, так и во время ЧТКА сопровождалось летальностью 56,52 % (13/23), хотя, если брать во внимание пациентов, которым подключали ЭКМО до реваскуляризации и начала развития кардиальных событий, данный показатель составлял 0 %.
Кроме того, о хороших результатах использования планового ЭКМО при ЧТКА сообщается в ретроспективном исследовании F.S. van den Brink и соавт. (2018) [18]. Так, исследователи установили, что среди 12 пациентов, которым проводили ЭКМО при ЧТКА, общая летальность составила 42 % (5/12), из них летальность в группе с внедрением методики ЭКМО — 33 % (4/12). При этом осложнения были зарегистрированы у 6 из 12 пациентов: у 1 пациента возникли серьезные неврологические нарушения, у 2 пациентов наблюдалось кровоизлияние в месте канюли, еще у 2 — ишемия нижних конечностей, и у одного пациента — кровоизлияния в другом месте. Стоит отметить, что в данной работе ЭКМО подключалась уже во время проведения ЧТКА при возникновении жизнеугрожающей аритмии или при остановке сердечной деятельности.
В то же время в нашем исследовании 30-дневная летальность у пациентов, которым проводилась ЭКМО при уже развивающихся осложнениях, составляла 93 % (13/14). Такие высокие показатели летальности, по нашему мнению, обусловлены многими факторами, в том числе наличием у данных пациентов коморбидных заболеваний, таких как сахарный диабет и хроническая почечная недостаточность.
Таким образом, как показывают результаты нашего исследования и работы вышеназванных авторов, использование ЭКМО у пациентов высокой группы риска при проведении ЧТКВ сегодня характеризуется достоверным ростом уровня выживания даже у такой сложной когорты больных.
Выводы
1. Сахарный диабет, почечная недостаточность, поражение правой коронарной артерии являются независимыми предикторами летальности при проведении рентгенэндоваскулярной реканализации у пациентов с ишемической болезнью сердца.
2. Количество пораженных коронарных артерий не является фактором риска летального исхода у обследованной категории пациентов.
3. Плановое использование ЭКМО у пациентов группы высокого риска (острый коронарный синдром, острый инфаркт миокарда) при транскутанной реваскуляризации миокарда является положительным прогностическим фактором выживаемости пациентов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Получено/Received 14.01.2021
Рецензировано/Revised 28.01.2021
Принято в печать/Accepted 03.02.2021
Список литературы
1. Anand S., Jayakumar D., Aronow W.S., Chandy D. Role of extracorporeal membrane oxygenation in adult respiratory fai-lure: an overview. Hosp. Pract. (1995). 2016. 44 (2). 76-85. doi: 10.1080/21548331.2016.1151325.
2. MacLaren G., Combes A., Bartlett R.H. Contemporary extracorporeal membrane oxygenation for adult respiratory failure. life support in the new era. Intensive Care Med. 2012. 38 (2). 210-20. doi: 10.1007/s00134-011-2439-2.
3. Rozé H., Repusseau B., Ouattara A. Extracorporeal membrane oxygenation in adults for severe acute respiratory failure. Ann. Fr. Anesth. Reanim. 2014. 33 (7–8). 492-4. doi: 10.1016/j.annfar.2014.07.008
4. Di Nardo M., MacLaren G., Marano M., Cecchetti C., Bernaschi P., Amodeo A. ECLS in Pediatric Cardiac Patients Front Pediatr. 2016. 4. 109.
5. Shekar K., Mullany D.V., Thomson B., Ziegenfuss M., Platts D.G., Fraser J.F. Extracorporeal life support devices and strategies for management of acute cardiorespiratory failure in adult patients. a comprehensive review. Crit. Care. 2014. 18 (3). 219. doi: 10.1186/cc13865.
6. Extracorporeal Life Support Registry Report. Available online. https://www.elso.org/Registry/Statistics/InternationalSummary.aspx, accessed on January, 2019.
7. Makdisi G., Wang I. Extra Corporeal Membrane Oxygenation (ECMO) review of a lifesaving technology. J. Thorac. Dis. 2015. 7 (7). E166-E176. doi: 10.3978/j.issn.2072-1439.2015.07.17
8. Shaukat A., Hryniewicz-Czeneszew K., Sun B. et al. Outcomes of Extracorporeal Membrane Oxygenation Support for Complex High-Risk Elective Percutaneous Coronary Interventions. A Single-Center Experience and Review of the Literature. J. Invasive Cardiol. 2018. 30 (12). 456-60.
9. Khera R., Cram P., Vaughan-Sarrazin M., Horwitz P.A., Girotra S. Use of Mechanical Circulatory Support in Percutaneous Coronary Intervention in the United States. J. Cardiol. 2016. 117 (1). 10-6. doi: 10.1016/j.amjcard.2015.10.005
10. Bartlett R.H., Gattinoni L. Current status of extracorporeal life support (ECMO) for cardiopulmonary failure. Minerva Anestesiol. 2010. 76 (7). 534-40.
11. Aubron C., DePuydt J., Belon F. et al. Predictive factors of bleeding events in adults undergoing extracorporeal membrane oxygenation. Ann. Intensive Care. 2016. 6 (1). 97. doi: 10.1186/s13613-016-0196-7.
12. Mateen F.J., Muralidharan R., Shinohara R.T., Parisi J.E., Schears G.J., Wijdicks E.F. Neurological injury in adults treated with extracorporeal membrane oxygenation. Arch. Neurol. 2011 Dec. 68 (12). 1543-9. doi: 10.1001/archneurol.2011.209.
13. Ryu J.A., Cho Y.H., Sung K. et al. Predictors of neurological outcomes after successful extracorporeal cardiopulmonary resuscitation. BMC Anesthesiol. 2015. 15. 26. doi: 10.1186/s12871-015-0002-3.
14. Davies A., Jones D., Bailey M. et al. Australia and New Zealand Extracorporeal Membrane Oxygenation (ANZ ECMO) Influenza Investigators1. Extracorporeal Membrane Oxygena-tion for 2009 Influenza A (H1N1) Acute Respiratory Distress Syndrome. JAMA. 2009. 302 (17). 1888-95. doi: 10.1001/jama.2009.1535.
15. Teirstein P.S., Vogel R.A., Dorros G. et al. Prophylactic versus standby cardiopulmonary support for high risk percutaneous transluminal coronary angioplasty. J. Am. Coll. Cardiol. 1993. 21. 590-6. doi: 10.1016/0735-1097 (93)90089-j
16. Vainer J., van Ommen V., Maessen J., Geskes G., Lame-richs L., Waltenberger J. Elective high-risk percutaneous coronary interventions supported by extracorporeal life support. Am. J. Cardiol. 2007. 99. 771-3. doi: 10.1016/j.amjcard.2006.10.034
17. Sheu J.J., Tsai T.H., Lee F.Y. et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Crit. Care Med. 2010 Sep. 38 (9). 1810-7. doi: 10.1097/CCM.0b013e3181e8acf7.
18. Van den Brink F.S., Magan A.D., Noordzij P.G. et al. Veno-arterial extracorporeal membrane oxygenation in addition to primary PCI in patients presenting with ST-elevation myocardial infarction. Neth. Heart J. 2018. 26 (2). 76-4. doi: 10.1007/s12471-017-1068-y.

/72.jpg)
/74.jpg)
/75.jpg)