Вступ
За даними ВООЗ, кількість хворих на цукровий діабет (ЦД) зросла зі 108 мільйонів у 1980 році до 422 мільйонів у 2014 році. Майже вдвічі зросла загальна поширеність ЦД серед дорослих, старших за 18 років. Поширеність ЦД зростає швидше в країнах з низьким і середнім рівнем доходу, ніж у країнах з високим рівнем доходу [1]. Поширеність ЦД в Україні збільшилася за останні 10 років наполовину й становила у 2017 році 1,2 мільйони хворих [2].
У період з 2000 року по 2016 рік спостерігалося 5-відсоткове збільшення глобальної передчасної смертності від ЦД. У 2016 році, за оцінками ВООЗ, 1,6 мільйона смертей були безпосередньо спричинені діабетом. Ще 2,2 мільйона смертей спричинені високим рівнем глюкози в крові у 2012 році. Майже половина всіх смертей, спричинених високим вмістом глюкози в крові, припадає на вік до 70 років. ВООЗ вважає, що діабет був сьомою причиною смерті у 2016 році [1].
Цукровий діабет є основною причиною сліпоти, ниркової недостатності, інфарктів, інсульту й ампутації нижніх кінцівок [1].
Серцево-судинні захворювання, зокрема ішемічна хвороба серця (ІХС), залишаються частою причиною госпіталізації хворих на ЦД. Так, за даними Центрів з контролю й профілактики захворювань у США (англ. Centers for Disease Control and Prevention, CDC), у 2020 році серед 7,8 мільйонів дорослих пацієнтів, у яких при виписці зі стаціонару одним із діагнозів був ЦД, поширеність серцево-судинної патології становила 75,5 на 1000 хворих, у тому числі ІХС була у 18,9 на 1000 пацієнтів [3].
З огляду на частий розвиток нейропатії у хворих на діабет [4, 5] існує думка, що для даної категорії пацієнтів характерна висока частота атипового перебігу гострого коронарного синдрому, але дані про це досить суперечливі [6–8].
Так, згідно з даними F.U. Rui та співавт., які обстежили 4450 пацієнтів із ЦД та інфарктом міокарда, безсимптомний перебіг спостерігався в 1,6 % хворих, що не відрізнялося від пацієнтів без діабету. Діабетики рідше скаржилися на тривалий загрудинний біль і пітливість [9, 10].
Мета: визначити особливості больового синдрому та ступінь його вираженості в пацієнтів з гострим коронарним синдромом і цукровим діабетом.
Матеріали та методи
На клінічній базі кафедри анестезіології та інтенсивної терапії НМАПО імені П.Л. Шупика у 2019–2020 роках проведено дослідження, у рамках якого проаналізовано медичні карти й результати опитування 24 пацієнтів (19 чоловіків і 5 жінок) віком 45–83 роки, госпіталізованих в ургентному порядку.
До дослідження включено пацієнтів з раніше діагностованим ЦД 2-го типу і 1-го типу та інфарктом міокарда (ІМ), яким в ургентному порядку проведено діагностичну коронарографію і стентування. Критеріями невключення досліджуваних були кардіогенний шок; тяжкі невиліковні супутні захворювання.
Дослідження виконані з дотриманням основних положень «Правил етичних принципів проведення наукових медичних досліджень за участю людини», затверджених Гельсінською декларацією (1964–2013 рр.), ICH GCP (1996 р.), Директиви ЄЕС № 609 (від 24.11.1986), наказів МОЗ України № 690 від 23.09.2009, № 944 від 14.12.2009, № 616 від 03.08.2012 р. Кожен пацієнт підписував інформовану згоду на участь у дослідженні.
Діагноз гострого ІМ виставлявся за умови появи клінічних даних про ішемію серцевого м’яза (у тому числі больового синдрому) і подальшого підвищення і/або зниження рівня кардіального тропоніну І хоча б на 1 пункт вище за 99-й перцентиль референтних значень, а також відповідності хоча б одному з таких критеріїв:
— поява клінічних симптомів міокардіальної ішемії;
— нові ішемічні зміни на ЕКГ;
— поява патологічного зубця Q;
— виявлення тромбозу коронарних артерій під час ангіографії чи автопсії.
На госпітальному етапі пацієнтам проводився стандартний набір діагностичних заходів (фізикальне обстеження, інструментальні: ЕКГ, пульсоксиметрія, неінвазивне вимірювання артеріального тиску, лабораторні: визначення маркерів пошкодження міокарду тропоніну І, МВ-КФК, загальний і біохімічний аналізи крові, визначення глюкози крові).
Лікування гострого коронарного синдрому відбувалося за стандартною програмою згідно з рекомендаціями Європейського товариства кардіологів [11] і МОЗ України [12].
Стандартне лікування передбачає:
1) медикаментозну терапію (антитромбоцитарна терапія, призначення антикоагулянтів, β-блокаторів, нітратів за показаннями);
2) оксигенотерапію за показаннями;
3) реваскуляризацію шляхом первинного черезшкірного коронарного втручання зі стентуванням коронарних артерій.
Хірургічні втручання виконувалися в умовах рутинної седації та аналгезії (рівень седації ІІ–ІІІ за Ramsey) діазепамом, і/або фентанілом, і/або морфіном.
Оцінка больового синдрому проводилася на момент госпіталізації та одразу після діагностичної коронарографії і стентування коронарних артерій за такими критеріями: візуально-аналоговою шкалою, цифровою шкалою, клінічними даними (пітливість, тремор, артеріальний тиск, пульс), біохімічними маркерами (глюкоза крові).
Візуальна аналогова шкала (ВАШ), Visual Analogue
Scale (VAS). Цей метод суб’єктивної оцінки болю полягає в тому, що пацієнта просять відзначити на неградуйованій лінії завдовжки 10 см точку, яка відповідає ступеню інтенсивності болю. Ліва межа лінії відповідає значенню «0» (відсутність болю), права — «10» (біль нестерпний). Як правило, використовується паперова, картонна або пластмасова лінійка завдовжки 10 см. Зі зворотного боку лінійки нанесені сантиметрові поділки, за якими лікар відмічає отримане значення й заносить у лист спостереження. До безумовних переваг цієї шкали відносяться її простота та зручність. При динамічній оцінці зміна інтенсивності болю вважається об’єктивною й істотною, якщо справжнє значення ВАШ відрізняється від попереднього більше ніж на 13 мм. Візуально-аналогова шкала відображає інтенсивність болю, що відчуває пацієнт на час обстеження. Інтенсивність болю пацієнт відзначає самостійно (рис. 1) [13, 14].
/89.jpg)
Цифрова оцінювальна шкала (Numerical Rating Scale, NRS). Це шкала, за якою пацієнт може оцінити свій біль від 0 (зовсім не болить) до 10 (нестерпний біль). За результатами шкали біль класифікують так [15, 16]:
— 0–3 бали — відсутність болю або слабкий біль, що мало турбує;
— 4–6 балів — біль помірний або середнього ступеня інтенсивності;
— 7–10 балів — біль сильної інтенсивності.
У досліджуваній групі чоловіків (19 осіб, 79,17 %) було більше, ніж жінок (5 осіб, 20,83 %). Вік пацієнтів варіював від 45 до 83 років. Середній вік чоловіків становив 60,47 ± 10,41 року, жінок — 64,00 ± 5,66 року. Половину хворих становили пацієнти віком 55–65 років (табл. 1).
Серед пацієнтів переважали хворі із цукровим діабетом 2-го типу (91,67 %), також були 2 пацієнти (8,33 %) із цукровим діабетом 1-го типу. Розподіл пацієнтів відображений у табл. 2.
Середня маса тіла пацієнтів становила 87,88 ± 14,11 кг (чоловіків — 89,74 ± 13,29 кг, жінок — 80,8 ± 16,47 кг); середній індекс маси тіла (ІМТ) — 29,86 ± 4,78 (чоловіків — 29,65 ± 4,4; жінок — 30,67 ± 6,57). У більшості пацієнтів у дослідженні (табл. 3) спостерігалися надлишкова маса тіла (у 37,50 % хворих) та ожиріння І ступеня (у 33,33 %).
У структурі супутньої патології при надходженні до стаціонару переважала гіпертонічна хвороба різних стадій і ступенів (87,5 %, у 12 пацієнтів). Пароксизм фібриляції передсердь був в 1 пацієнта (4,17 %).
У більшої частини пацієнтів (95,83 %) перебіг ІХС супроводжувався розвитком клінічних ознак серцевої недостатності (табл. 4), з яких у 2 (8,33 %) випадках — зі зниженням фракції викиду лівого шлуночка (ЛШ) (табл. 5).
Серед довгострокових ускладнень цукрового діабету спостерігалися поодинокі випадки діабетичної нефропатії і діабетичної полінейропатії. Чверть пацієнтів мала в анамнезі інфаркт міокарда різної локалізації, в 1 пацієнта (4,17 %) раніше було гостре порушення мозкового кровообігу.
Усім пацієнтам проводили діагностичну коронарографію і стентування інфаркт-залежної коронарної артерії. Середня тривалість втручання становила 27,27 ± 6,47 хв. Найчастіше (у 83,33 % випадків) пацієнтам імплантували 1 стент, у решті випадків (16,67 %) встановлено 2 стенти. Багатосудинні ураження зі стенозами (> 60 % просвіту судини) і/або оклюзіями кількох коронарних артерій чи їх гілок спостерігалися в 66,67 % випадків. При цьому ураження 3 гілок вінцевих артерій виявлено в 11 пацієнтів (45,83 %).
Статистичне опрацювання отриманих даних проводили з використанням програмного статистичного пакета Statistica 12 і MS Excel. Для порівняння даних використовувався критерій χ2 Пірсона і t-критерій для залежних вибірок, статистично значущими вважалися результати при p < 0,05.
Результати
Характеристика больового синдрому й скарги. Більша частина пацієнтів (87,5 %) на момент госпіталізації скаржилася на біль у грудях, решту не турбував жоден біль. Під час опитування хворі описували біль як «печіння» (29,17 %), «стискання» (29,17 %), «здавлювання» (25,0 %), «поколювання» (4,17 %). Також були скарги на тяжкість під час дихання (12,5 %), відчуття нестачі повітря (12,5 %), серцебиття (41,67 %). Появу надмірного потовиділення зауважили 16,67 % пацієнтів.
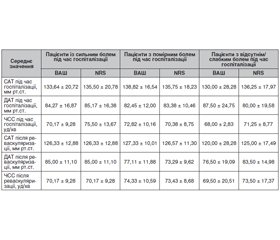
Середнє значення оцінки за ВАШ на момент госпіталізації становило 6,29 ± 1,76, після відновлення перфузії — 3,17 ± 1,49. За NRS середнє значення оцінки болю спочатку становило 6,17 ± 1,63, після реваскуляризації — 3,29 ± 1,23. Детальна характеристика суб’єктивної оцінки болю відображена в табл. 6.
Статистично значущої відмінності між результатами оцінки за ВАШ і NRS не виявлено (p > 0,1). Результати суб’єктивної оцінки больового синдрому за ВАШ і NRS свідчать, що до реваскуляризації помірний і сильний біль зустрічалися з однаковою частотою. Після проведеного лікування суттєве зниження болю відчули більше ніж половина пацієнтів (62,5 і 66,66 % за ВАШ і NRS відповідно). Та все ж значна частина хворих продовжувала скаржитися на помірний біль (від 33,34 % за NRS до 37,5 % за ВАШ).
Оцінка гемодинаміки. Під час госпіталізації середнє значення систолічного артеріального тиску (САТ) становило 135,71 ± 18,70 мм рт.ст., діастолічного (ДАТ) — 83,71 ± 14,67 мм рт.ст., частоти серцевих скорочень (ЧСС) — 73,08 ± 11,35 уд/хв. Детальну характеристику гемодинаміки подано в табл. 7. Статистично значущого коливання артеріального тиску та ЧСС до та після втручання в пацієнтів з різною інтенсивністю болю не спостерігалося (p > 0,1).
Оцінка рівня глікемії. Середнє значення рівня глікемії на момент госпіталізації становило 8,19 ± 3,45 ммоль/л (у чоловіків — 8,17 ± 3,61 ммоль/л, у жінок — 8,28 ± 3,13 ммоль/л). Глікемія понад 10,0 ммоль/л виявлена в 5 пацієнтів, що становило 20,83 % усіх хворих. Серед цієї категорії пацієнтів переважали хворі із сильним больовим синдромом (60,0 %). Гіпоглікемія не спостерігалася. У пацієнтів із сильним болем за ВАШ і NRS середній рівень глікемії був 7,85 ± 2,84 ммоль/л і 8,47 ± 3,48 ммоль/л відповідно. За відсутності або при слабкому больовому синдромі рівень глюкози крові становив у середньому 6,25 ± 0,21 ммоль/л. Статистично значущої відмінності між рівнями глікемії в пацієнтів із сильним і помірним больовим синдромом не виявлено (p > 0,1).
Детальну характеристику рівня глікемії під час госпіталізації відображено в табл. 8.
Обговорення
У нашому дослідженні серед пацієнтів чоловіків (19 осіб, 79,17 %) було більше, ніж жінок (5 осіб, 20,83 %). Вік пацієнтів варіював від 45 років до 83 років. Середній вік чоловіків становив 60,47 ± 10,41 року, жінок — 64,0 ± 5,66 року. За даними великих обсерваційних досліджень, у які було включено 21 994 пацієнтів (Китай) [18], 3367 пацієнтів (США) [19], 24 390 пацієнтів (Шотландія) [20], серед хворих із гострим коронарним синдромом і ЦД було більше жінок, осіб віком понад 60 років, із супутньою артеріальною гіпертензією.
У пацієнтів із ЦД частіше було аортокоронарне шунтування й стентування коронарних артерій в анамнезі [9]. У досліджуваних нами хворих у структурі супутньої патології при надходженні до стаціонару також переважала гіпертонічна хвороба різних стадії та ступеня (87,5 %, 12 пацієнтів). А чверть пацієнтів мала в анамнезі інфаркт міокарда різної локалізації, в 1 пацієнта (4,17 %) раніше було гостре порушення мозкового кровообігу.
Автори великого проспективного дослідження, проведеного в США, стверджують, що безсимптомний перебіг інфаркту міокарда переважав у пацієнтів із ЦД [7]. У нашому випадку частка безбольової форми становила 12,5 % від усієї досліджуваної групи. Нещодавно в Британському медичному журналі опублікували статтю, у якій автори проаналізували інтерв’ю 39 пацієнтів, госпіталізованих у лікувальні заклади Великої Британії з інфарктом міокарда та ЦД типу 1 і типу 2 [8]. Більшість пацієнтів скаржилися на біль у грудях та інші симптоми, але, за словами хворих, больові відчуття не були настільки інтенсивними, як при «справжньому серцевому нападі» [9]. Таку відмінність вчені пояснюють різним застосуванням термінів і визначень, наприклад, слід диференціювати атипові чи стерті клінічні прояви ГКС від так званого тихого або нерозпізнаного інфаркту міокарда (silent or unrecognized myocardial infarction). Адже випадок безсимтомного перебігу інфаркту міокарда може бути зареєстрований як через значний час після епізоду гострої ішемії за допомогою електрокардіографії (ЕКГ) чи магнітно-резонансної томографії (МРТ) серця, так і одразу — за умови появи ускладнень [21–23].
Згідно з визначенням Міжнародної асоціації з вивчення болю (IASP), біль — це неприємне відчуття і пов’язаний з ним або схожий на нього емоційний досвід, що виникають після ймовірного або реального пошкодження тканин [24]. Важливим аспектом цього визначення є те, що вербалізація болю — не єдиний спосіб його вираження. Тому й досі важливим для медиків залишається завдання максимально деталізувати критерії, що можуть свідчити про наявність болю і його ступінь, не обмежуючись лише суб’єктивною оцінкою пацієнта. Саме тому для оцінки болю нами було використано інші критерії.
Суб’єктивна оцінка за ВАШ і NRS є добре вивченою і невід’ємною складовою дослідження [13, 15, 16, 25, 26]. У нашому дослідженні ми не виявили вірогідної відмінності в показниках цих шкал. Також було визначено динаміку артеріального тиску й ЧСС у групах із помірним і сильним болем, які, за даними дослідників, можуть корелювати з появою ноцицептивних стимулів [25]. Але суттєвої відмінності цих показників нами не виявлено, що може бути пов’язане із застосуванням нітрогліцерину, β-блокаторів згідно зі стандартами лікування ГКС [11, 12, 27], відносно коротким інтервалом спостереження (тривалість ендоваскулярного втручання становила 27,27 ± 6,47 хв).
Для хворих на ЦД рівень глікемії є важливим показником стану організму і є визначальним для прогнозу перебігу ГКС. Так, метааналіз 15 досліджень показав, що в пацієнтів із рівнем глюкози в крові понад 180–198 мг/дл (10–12 ммоль/л) є підвищений ризик летального кінця. Однак цей аналіз 2000 року, імовірно, не передбачає впливу сучасних методів реперфузії і тромболізису. Більш релевантний звіт японського дослідження ГКС (80 % пацієнтів проводили черезшкірне коронарне втручання) демонструє лінійну залежність між моніторингом рівня глюкози в крові та смертністю в пацієнтів [28]. У нашому дослідженні глікемія понад 10,0 ммоль/л виявлена у 20,83 % хворих. Серед цієї категорії пацієнтів переважали хворі із сильним больовим синдромом (60,0 %).
Висновки
На підставі проведеного дослідження можна виділити такі особливості больового синдрому в пацієнтів з інфарктом міокарда й цукровим діабетом:
— переважання типової клінічної картини ГКС (87,5 % пацієнтів) над безбольовою формою;
— до реваскуляризації помірний і сильний біль зустрічався з однаковою частотою (статистично значущої відмінності між результатами оцінки за ВАШ і NRS не виявлено (p > 0,1));
— після проведеного лікування суттєве зниження болю відчули більше ніж половина пацієнтів;
— відсутня статистична відмінність між рівнями артеріального тиску, ЧСС і глікемії (p > 0,1) у пацієнтів із сильним і помірним больовим синдромом;
— гіперглікемія (≥ 10,0 ммоль/л) виявлена в 5 пацієнтів, що становило 20,83 % усіх хворих, серед цієї категорії пацієнтів переважали хворі із сильним больовим синдромом (60,0 %).
Відсутність відмінності між значеннями досліджуваних критеріїв болю в пацієнтів з помірним і сильним больовим синдромом за суб’єктивними шкалами оцінки може бути зумовлена розміром вибірки, низькою чутливістю критеріїв, розвитком діабетичної нейропатії, тому існує необхідність у подальшому дослідженні феномену больового синдрому в пацієнтів із ГКС і цукровим діабетом.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 16.01.2021
Рецензовано/Revised 28.01.2021
Прийнято до друку/Accepted 03.02.2021
Список литературы
1. World Health Organization. Diabetes 2020. https://www.who.int/news-room/fact-sheets/detail/diabetes.
2. МОЗ України. Всесвітній день боротьби з діабетом: що треба знати про хворобу. 2017. https://moz.gov.ua/article/health/vsesvitnij-den-borotbi-z-diabetom-scho-treba-znati-pro-hvorobu.
3. CDC. National Diabetes Statistics Report, 2020. Estimates of Diabetes and Its Burden in the United States. 2020. https://www.cdc.gov/diabetes/data/statistics-report/index.html.
4. Iqbal Z., Azmi S., Yadav R. et al. Diabetic Peripheral Neuropathy: Epidemiology, Diagnosis, and Pharmacotherapy. Clinical Therapeutics. 2018. 40(6). https://www.clinicaltherapeutics.com/article/S0149-2918(18)30140-1/fulltext.
5. Wheeler S., Singh N., Boyko E.J. The Epidemiology of Diabetic Neuropathy. In: Veves A., Malik R.A. Diabetic Neuropathy: Clinical Management. Totowa, NJ: Humana Press; 2007. Р. 7-30. https://doi.org/10.1007/978-1-59745-311-0_2.
6. Symptoms and delay times during myocardial infarction in 694 patients with and without diabetes; an explorative cross-sectional study | BMC Cardiovascular Disorders | Full Text. https://bmccardiovascdisord.biomedcentral.com/articles/10.1186/s12872-016-0282-7.
7. Canto J.G., Shlipak M.G., Rogers W.J., Malmgren J.A., Frederick P.D., Lambrew C.T. et al. Prevalence, Clinical Characteristics, and Mortality Among Patients With Myocardial Infarction Presenting Without Chest Pain. JAMA. 2000. 283(24). 3223-9.
8. Berman N., Jones M.M., Coster D.A.D. ‘Just like a normal pain’, what do people with diabetes mellitus experience when having a myocardial infarction: a qualitative study recruited from UK hospitals. BMJ Open. 2017. 7(9). https://bmjopen.bmj.com/content/7/9/e015736.
9. Галушко О.А., Болюк М.В. Небезпеки і труднощі під час діагностики інфаркту міокарда у пацієнтів з цукровим діабетом (огляд літератури та власний досвід). Медицина невідкладних станів. 2020. 16(2). 37-41.
10. Шлапак І.П., Маньковський Б.М., Галушко О.А., Кондрацька І.М. Інфузійна терапія в практиці лікаря-ендокринолога. Київ, 2016. 294 с.
11. Neumann F.-J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U. et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur. Heart J. 2019. 40(2). 87-165.
12. Уніфікований клінічний протокол екстреної, первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації «Гострий коронарний синдром з елевацією сегмента ST». МОЗ України, 2014. https://www.dec.gov.ua/wp-content/uploads/2019/11/2014_455-ykpmd_gks.pdf.
13. Huskisson E.C. Measurement of pain. Lancet. 1974. 2(7889). 1127-31.
14. Барило О.С., Фурман Р.Л. Комплексний аналіз больового синдрому в пацієнтів з переломами нижньої щелепи при використанні перпарату «Нуклео ЦМФ форте». Современная стоматология. 2014. 3. 62-7.
15. Miщук В.Р. Оцінка больового синдрому у дітей. Сучасний стан проблеми. Медицина невідкладних станів. 2016. 8. 134-9.
16. Haefeli M., Elfering A. Pain assessment. Eur. Spine J. 2006. 15(Suppl. 1). S17-24.
17. Defining Adult Overweight and Obesity | Overweight & Obesity | CDC. 2020. https://www.cdc.gov/obesity/adult/defining.html.
18. Fu R., Li S.-D., Song C.-X., Yang J.-A., Xu H.-Y., Gao X.-J. et al. Clinical significance of diabetes on symptom and patient delay among patients with acute myocardial infarction — an analysis from China Acute Myocardial Infarction (CAMI) registry. J. Geriatr. Cardiol. 2019. 16(5). 395-400.
19. Arnold S.V., Spertus J.A., Lipska K.J., Tang F., Goyal A., McGuire D.K. et al. Association between diabetes mellitus and angina after acute myocardial infarction: analysis of the TRIUMPH prospective cohort study. Eur. J. Prev. Cardiol. 2015. 22(6). 779-87.
20. Read S.H., Fischbacher C.M., Colhoun H.M., Gasevic D., Kerssens J.J., McAllister D.A. et al. Trends in incidence and case fatality of acute myocardial infarction, angina and coronary revascularisation in people with and without type 2 diabetes in Scotland between 2006 and 2015. Diabetologia. 2019. 62(3). 418-25.
21. Draman M.S., Thabit H., Kiernan T.J., O’Neill J., Sreenan S., McDermott J.H. A silent myocardial infarction in the diabetes outpatient clinic: case report and review of the literature. Endocrinol. Diabetes Metab. Case Rep. 2013. 2013. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3921998.
22. Silent Myocardial Infarction | Elsevier Enhanced Reader. https://reader.elsevier.com/reader/sd/pii/S073510971741432X? token=9EED8910E9978D6392A6CB476BC09E20731C416BA80CC7095E7264B5047205EF8B2560D153651A19121D91B58779AE57.
23. Silent myocardial ischemia and microalbuminuria in asymptomatic type-2 diabetic patients | Cochrane Library. https://www.cochranelibrary.com/central/doi/10.1002/central/CN-00727514/full?highlightAbstract=ischaemi%7Cischaemia%7Csilent%7Cmyocardial%7Cwithdrawn%7Cmyocardi%7Cischemia.
24. IASP Terminology — IASP. https://www.iasp-pain.org/Education/Content.aspx?ItemNumber=1698#Pain.
25. Cowen R., Stasiowska M.K., Laycock H., Bantel C. Assessing pain objectively: the use of physiological markers. Anaesthesia. 2015. 70(7). 828-47.
26. Tracey I., Woolf C.J., Andrews N.A. Composite Pain Biomarker Signatures for Objective Assessment and Effective Treatment. Neuron. 2019. 101(5). 783-800.
27. Cosentino F., Grant P.J., Aboyans V., Bailey C.J., Ceriello A., Delgado V. et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur. Heart J. 2020. 41(2). 255-323.
28. Hirsch I.B., O’Brien K.D. How to Best Manage Glycemia and Non-Glycemia During the Time of Acute Myocardial Infarction. Diabetes Technol. Ther. 2012. 14 (Suppl. 1). S-22-S-32.

/89.jpg)
/89_2.jpg)
/90.jpg)
/91.jpg)