Резюме
Пологи — фізіологічний процес, що супроводжується вираженим больовим синдромом. У патологічний процес можуть бути залучені фізіологічні та психологічні чинники. Підвищення концентрації катехоламінів може сприяти зниженню матково-плацентарної перфузії. Біль під час пологів може призвести до гіпервентиляції матері, що, зі свого боку, може вплинути на кислотно-основний стан плода та стан новонародженого. Тривалий больовий синдром може призвести до розвитку тяжких психологічних розладів із порушенням зв’язку між матір’ю і новонародженим. Гострий біль під час пологів може трансформуватися в хронічний у післяпологовому періоді. Найбільш ефективними є нейроаксіальні методи знеболювання пологів: епідуральна аналгезія (ЕА), комбінована спінально-епідуральна аналгезія (КСЕА) та їх модифікації. Класична ЕА справляє мінімальні небажані та побічні ефекти, але може бути пов’язана з високою частотою недостатнього рівня знеболювання. Частота неадекватних епідуральних блокад доходить до 23 %. КСЕА на відміну від ЕА має вищу якість сенсорної блокади, але вона пов’язана з більшою частотою побічних ефектів, таких як гіпотензія, виражений моторний блок, порушення частоти серцевих скорочень плода. З 2005 року в практику акушерських анестезіологів почала впроваджуватись епідуральна аналгезія з проколом твердої мозкової оболонки (Dural puncture epidural — DPE) як метод, що покликаний покращити якість класичної ЕА з мінімальними небажаними ефектами КСЕА. Дані наявних досліджень показують, що DPE потенційно покращує якість аналгезії (швидше настає знеболювання, краще покриття сакральних сегментів, нижча частота неадекватних блокад) порівняно з ЕА та менше викликає гіпотензію, порушення ритму частоти серцевих скорочень плода порівняно з КСЕА. Але в досягненні даних ефектів важливий діаметр спінальної голки. Подальші дослідження можуть бути націлені на визначення тривалості пологів, варіанта розродження та можливого впливу DPE на вегетативну регуляцію пологів та більш широке вивчення впливу данного методу на плід і новонародженого.
Childbirth is a physiological process that is accompanied by severe pain. Physiological and psychological factors may be involved in the pathological process. Increasing the concentration of catecholamines may help reduce uteroplacental perfusion. Pain during childbirth can lead to hyperventilation of the mother, which in turn can affect the acid-base status of the fetus and the state of the newborn. Prolonged pain can lead to the development of severe psychological disorders with a violation of the connection between mother and newborn. Acute pain during childbirth can transform into chronic in the postpartum period. The most effective are neuroaxial methods of analgesia: epidural analgesia, combined spinal-epidural analgesia and their modifications. Classical epidural analgesia has minimal adverse and side effects, but may be associated with a high incidence of insufficient analgesia. The frequency of inadequate epidural block reaches 23 %. Combined spinal-epidural analgesia, in contrast to epidural analgesia, has a higher quality of sensory block, but it is associated with a higher frequency of side effects such as hypotension, severe motor block, fetal arrhythmia. Since 2005, dural puncture epidural has been introduced into the practice of obstetric anesthesiologists as a method to improve the quality of classical epidural analgesia with minimal side effects of combined spinal-epidural analgesia. Data from existing studies show that dural puncture epidural potentially improves the quality of analgesia (faster onset of analgesia, better sacral coverage, lower incidence of inadequate block) compared with epidural analgesia and causes less hypotension, disorders of fetal heart rate compared with combined spinal-epidural analgesia. But the spinal needle size is important in achieving these effects. Further researches may be aimed at determining the duration of labor, the option of delivery and the possible impact of dural puncture epidural on the vegetative regulation of labor and a broader study of the impact of this method on the fetus and newborn.
Пологи — фізіологічний процес, що супроводжується вираженим больовим синдромом. Під час пологів жінка переживає одне з найсильніших больових відчуттів у житті. У патологічний процес можуть бути залучені фізіологічні та психологічні чинники, які в подальшому впливають як на тривалість, так і на інтенсивність страждань породіллі [1–3].
У першому періоді пологів біль виникає внаслідок стимуляції механорецепторів нижнього маткового сегмента та шийки матки, а також за рахунок стимуляції хеморецепторів у матці як відповіді на її скорочення.
Біль має вісцеральну природу, тому він характеризується як розлитий та тяжколокалізований. Больовий імпульс передається по тонких безмієлінових С-волокнах через матково-піхвове, аортальне, підчеревне сплетення, а потім по білих з’єднувальних гілках через сегменти T10–L1 у задні роги спинного мозку.
У другому періоді пологів змінюється тип болю, він набуває соматичного характеру внаслідок розтягування стінок піхви, м’язів тазового дна, а також спричиненого плодом тиску на промежину. Больові стимули йдуть із ділянки таза переважно по Aδ-волокнах через сегменти T10–S4, але більшу участь у больовій відповіді беруть пудендальні нерви (сегменти S2–S4) і спинномозкові нерви L1–L3 [4, 5]. Зі спинного мозку больові імпульси передаються по спіноталамічному тракту в таламус і доходять до задньої центральної звивини сенсорної зони кори головного мозку [4].
Біль під час пологів може призвести до гіпервентиляції матері з розвитком респіраторного алкалозу і зміщенням кривої дисоціації оксигемоглобіну вліво [1, 4–6], транзиторної гіпоксемії в плода [1, 5]. При активації симпатичної нервової системи відзначаються збільшення серцевого викиду і підвищення артеріального тиску. Підвищення концентрації катехоламінів може сприяти зниженню матково-плацентарної перфузії [1, 6].
Тривалий больовий синдром може призвести до розвитку тяжких психологічних розладів із порушенням зв’язку між матір’ю і новонародженим, сексуальних порушень у майбутньому, а також сприяти післяпологовій депресії матері [1, 6]. Гострий біль під час пологів може трансформуватися в хронічний в післяпологовому періоді. За даними Ю.С. Полушина та співавт., больовий синдром зберігався в 7 % жінок через 3 міс. після розродження через природні пологові шляхи, при цьому не виявлено взаємозв’язку з тривалістю пологів [7].
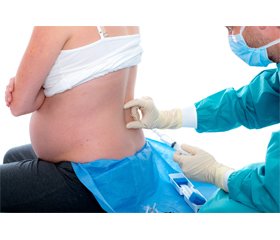
На сьогодні існує широкий арсенал методів знеболювання пологів, як медикаментозних, так і немедикаментозних. Найбільш ефективними є нейроаксіальні методи знеболювання пологів: епідуральна аналгезія (ЕА), комбінована спінально-епідуральна аналгезія (КСЕА) та їх модифікації [1, 8–11]. Нейроаксіальні методи знеболювання є найефективнішими в забезпеченні знеболювання пологів та золотим стандартом порівняно з іншими методиками [2]. Згідно з рекомендаціями ASA, ACOG та NICE, прохання жінки виконати регіонарну аналгезію є достатньою підставою для початку нейроаксіальної аналгезії [12, 13].
Епідуральна аналгезія — найчастіше використовувана методика знеболювання пологів. Останні три десятиліття зберігалася тенденція до збільшення частоти використання регіонарних методів знеболювання в акушерстві. На сьогодні частота використання епідуральної аналгезії пологів становить: у Канаді — 30–69 %, США — 78 %, Фінляндії — 67 %, Ізраїлі — 60 %, Бельгії — 68 %. Комбінована спінально-епідуральна аналгезія використовується рідше, ніж класична епідуральна, але в розвинених країнах інтерес до неї зростає і відсоток її використання доходить до 20 %. В Україні показник використання нейроаксіальних методик знеболювання пологів значно варіюється і залежить від вподобань та оснащення клініки — від 10 до 80 % [14–16].
Хоча останнім часом підходи до проведення методики, комбінації препаратів та режими введення медикаментів, що використовуються в даних методиках, еволюціонували, початок дії, якість блоку при ЕА і можливі небажані та побічні ефекти при КСЕА вимагають подальшої оптимізації. Класична ЕА справляє мінімальні небажані та побічні ефекти, але може бути пов’язана з повільним початком дії, неадекватним блоком, включаючи унілатеральний, мозаїчний блок та недостатнє покриття сакральних сегментів, моторним блоком та невдалою аналгезією з потребою в маніпуляції або перестановці катетера [17]. Частота неадекватних епідуральних блокад доходить до 23 %, тому це спонукає до подальших пошуків методики з кращим профілем ефективності [18]. КСЕА на відміну від ЕА має швидкий початок дії та вищу якість сенсорної блокади, включаючи краще покриття сакральних сегментів та меншу частоту неадекватних блокад, але вона пов’язана з більшою частотою побічних ефектів, таких як гіпотензія, можливий більш виражений моторний блок, неможливість адекватно оцінити правильність встановлення епідурального катетера, можлива побічна дія у вигляді постпункційного головного болю, свербежу та нудоти в матері. При використанні КСЕА можливі порушення серцевого ритму плода як наслідок гемодинамічних змін у матері та використання опіоїдів при ініціальній спінальній дозі [1, 10, 17, 19–21].
Із 2005 року в літературі почали з’являтися повідомлення про використання модифікованого методу знеболювання пологів — епідуральної аналгезії з проколом твердої мозкової оболонки (Dural puncture epidural — DPE), описаної N. Suzuki та співавт. у 1996 році [22, 23]. DPE — це порівняно новий метод знеболювання і фактично є модифікацією КСЕА. Відмінністю DPE від КСЕА є те, що після проколу твердої мозкової оболонки в субарахноїдальний простір не вводяться ніякі препарати, а дуральна пункція створює канал для транслокації медикаментів з епідурального простору в субарахноїдальний [1, 17]. Передумовою для впровадження даної методики в практиці акушерських анестезіологів став пошук компромісу між покращенням якості аналгезії та меншою частотою небажаних та побічних ефектів із боку як матері, так і дитини при використанні загальноприйнятих методик. Наявні дані в сучасній літературі показують неоднозначні висновки щодо використання DPE. Це може бути позв’язано з різними підходами до виконання та підтримання аналгезії.
У дослідженні J. Thomas та співавт. (2005 р.) виконували прокол твердої мозкової оболонки голкою G27 та використовували постійну інфузію розчину бупівакаїну з фентанілом і не знайшли відмінностей у частоті унілатеральних блокад, частоті потреби маніпуляцій із катетером, сакральному розподіленні сенсорної блокади, кількості використовуваного анестетика щодо двох методик знеболювання пологів ЕА та DPE [23]. Їх колеги, P. Yadav та співавт., використовуючи такий самий діаметр голки, але ропівакаїн із фентанілом як анестетик і болюси за запитом пацієнтки, отримали дещо інші результати: швидший початок дії аналгезії, нижчий показник за візуально-аналоговою шкалою на 5-й та 10-й хв та кращу загальну якість аналгезії при використанні методики DPE. При цьому не було відмінностей за групами в небажаних та побічних ефектах із боку матері та дитини [24]. S. Wilson та співавт. у своєму дослідженні використовували голку діаметром G26 та не виявили вираженої різниці між групами в адекватності аналгезії, моторному та сенсорному блоках, методах розродження, виникненні побічних ефектів [25]. Однак група, в якій використовували DPE, показала більш короткий час початку адекватної аналгезії (8 хв проти 10 хв) та меншу частоту вагінальних пологів. Використовуючи у своїх дослідженнях голку більшого діаметра (G25), дослідники отримали кращі результати при використанні DPE-методики: швидше досягнення адекватної аналгезії, кращий розподіл у межах сакральних сегментів, меншу частоту унілатеральних блокад та кращу якість аналгезії загалом [26, 27].
У дослідженні A. Chau та співавт. порівняння проводилось між трьома групами — ЕА, DPE, КСЕА та було показано, що методика епідуральної аналгезії з проколом твердої мозкової оболонки за більшістю параметрів посідає проміжну позицію між вже класичними нейроаксіальними методиками — має більшу ефективність та якість аналгезії порівняно з ЕА та водночас менше небажаних та побічних ефектів із боку матері та дитини порівняно з КСЕА [17].
Маючи дані попередніх досліджень, можна відмітити залежність результатів аналгезії від діаметра спінальної голки, що створює канал для проходження розчину анестетика з епідурального простору до спинномозкового каналу. Більший діаметр голки створює кращі передумови для перерозподілу анестетика, але, зі свого боку, теоретично збільшує можливість підвищення частоти виникнення постпункційного головного болю, хоча наявні дослідження не документують дані збільшення.
Варто відмітити певну особливість DPE-методики в допомозі ідентифікації епідурального простору: отримання ліквору через спінальну голку слугує додатковим доказом локалізації голки Туохі в епідуральному просторі, а відсутність медикації в спінальний канал дає змогу адекватно оцінити епідуральну тест-дозу [2]. E. Cappiello та співавт. визначили вищу частоту інструментальних пологів при використанні DPE, але в подальшому дані більшості досліджень не показали збільшення частоти інструментальних пологів чи оперативних розроджень [26]. Подальші дослідження можуть бути направлені на визначення тривалості пологів, варіанта розродження та можливого впливу на вегетативну регуляцію пологів.
Однак варто зазначити, що при описуванні даних методик у літературі мало приділяється уваги їх впливу на плід та новонародженого. І хоча в дослідженні A. Chau та співавт. було показано більшу частоту брадикардії та децелерацій при використанні КСЕА та не знайдено істотного збільшення порушень ритму плода при застосуванні DPE проти ЕА [17], недостатньо даних щодо впливу DPE на новонародженого, що дає змогу розширити параметри подальших досліджень.
Упровадження нового методу знеболювання пологів потребує виваженого підходу, адже є певні вимоги щодо безпеки для матері та дитини. DPE як метод знеболювання пологів не так давно почав використовуватись у практиці анестезіологів. Уже наявні дані досліджень показують кращу ефективність методу порівняно з класичною ЕА, меншу частоту невдач при аналгезії та меншу частоту небажаних і побічних ефектів на матір й дитину. Уже сьогодні епідуральна аналгезія з проколом твердої мозкової оболонки може стати корисним інструментом у ефективному подоланні пологового болю з мінімальним впливом на матір і дитину та зайняти середню позицію між вже давно використовуваними нейроаксіальними методами знеболювання пологів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 18.01.2021
Рецензовано/Revised 01.02.2021
Прийнято до друку/Accepted 05.02.2021
Список литературы
1. Шакиров Р.Т., Кинжалова С.В., Макаров Р.А. Нейроаксиальные методы обезболивания родов. Вестник анестезиологии и реаниматологии. 2018. Т. 15. № 5. С. 65-73. DOI: 10.21292/2078-5658-2018-15-5-65-73.
2. Jalal A. Nanji, Brendan Carvalho. Pain management during labor and vaginal birth. Best Practice & Research Clinical Obstetrics & Gynaecology. 2020. Vol. 67. P. 100-112.
3. Sng B.L., Kwok S.C., Sia A.T. Modern neuraxial labour analgesia. Cur. Opin. Anaesth. 2015. Vol. 28. № 3. P. 285-289.
4. Gonzalez M.N., Trehan G., Kamel I. Pain management during labor, part 1: Pathophysiology of labor pain and maternal evaluation for labor analgesia. Topics Obstetr. Gynecology. 2016. Vol. 36. № 11. P. 1-6.
5. Labor S., Maguire S. The pain of labour. Rev. Pain. 2008. Vol. 2. № 2. P. 15-19.
6. Wong C.A. Advances in labor analgesia. Intern. J. Women’s Health. 2009. Vol. 1. P. 139-154.
7. Полушин Ю.С., Коростелев Ю.М., Вартанова И.В. и др. Болевой синдром после родов и его влияние на качество жизни. Анестезиол. и реаниматол. 2015. № 2. С. 47-50.
8. Куликов А.В., Шифман Е.М. Анестезия, интенсивная терапия и реанимация в акушерстве и гинекологии. Клинические рекомендации. Протоколы лечения. 2-е изд., доп. и перераб. М.: Медицина, 2017. С. 153-168.
9. Clark V., Van de Velde M., Fernando R. (eds.). Oxford textbook of obstetric anaesthesia. Oxford UK: Oxford University press, 2016. 1072 p.
10. Committee on practice bulletins — obstetrics. ACOG Practice bulletin No. 177: Obstetric analgesia and anesthesia. Obstet. Gyneco-logy. 2017. Vol. 129. № 4. P. 73-89.
11. Kocarev M., Khalid F., Khatoon F. et al. Neuraxial labor –analgesia: a focused narrative review of the 2017 literature. Cur. Opin. Anaesth. 2018. Vol. 31. № 3. P. 251-257.
12. NICE Pathways Intrapartum care 2020; https://pathways.nice.org.uk/pathways/intrapartum-care
13. American College of Obstetricians and Gynecologists. ACOG practice bulletin no. 209: Obstetric analgesia and anesthesia. Obstetrics and Gynecology. 2019. 133(3). Р. 208-225.
14. Shatalin D., Weiniger C.F., Buchman I., Ginosar Y., Orbach-Zinger S., Ioscovich A. A 10-year update: national survey questionnaire of obstetric anesthesia units in Israel. International journal of obstetric anesthesia. 2019. 38. Р. 83-92.
15. Bos E.M., Schut M.E., de Quelerij M., Kalkman C.J., Hollmann M.W., Lirk P. Trends in practice and safety measures of epidural analgesia: Report of a national survey. Acta Anaesthesiologica Scandinavica. 2018. 62(10). Р. 1466-1472.
16. Guasch E., Brogly N., Gilsanz F. Combined spinal epidural for labour analgesia and caesarean section: indications and recommendations. Current Opinion in Anesthesiology. 2020. 33(3). Р. 284-290.
17. Chau A., Bibbo C., Huang C.C. et al. Dural puncture epidural technique improves labor analgesia quality with fewer side effects compared with epidural and combined spinal epidural techniques: a randomized clinical trial. Anesth. Analgesia. 2017. Vol. 124. № 2. P. 560-569.
18. Guasch E., Iannuccelli F., Brogly N., Gilsanz F. Failed epidural for labor: what now? Minerva Anestesiologica. 2017. 83(11). Р. 1207-1213.
19. Layera S., Bravo D., Aliste J., Tran D.Q. A systematic review of dural puncture epidural analgesia for labor. Journal of Сlinical Аnesthesia. 2019. 53. Р. 5-10.
20. Hattler J., Klimek M., Rossaint R. et al. The effect of combined spinal-epidural versus epidural analgesia in laboring women on nonreassuring fetal heart rate tracings: systematic review and meta-analysis. Anest. Analg. 2016. Vol. 123. № 4. P. 955-964.
21. Heesen M., Van de Velde M., Klöhr S. et al. Meta-analysis of the success of block following combined spinal-epidural vs epidural analgesia during labour. Anaesthesia. 2014. Vol. 69. № 1. P. 64-71.
22. Suzuki N., Koganemaru M., Onizuka S., Takasaki M. Dural puncture with a 26-gauge spinal needle affects spread of epidural anesthesia. Anesthesia & Analgesia. 1996. 82(5). Р. 1040-1042.
23. Thomas J.A., Pan P.H., Harris L.C., Owen M.D., D’Angelo R. Dural puncture with a 27-gauge Whitacre needle as part of a combined spinal-epidural technique does not improve labor epidural catheter function. Anesthesiology: The Journal of the American Society of Anesthesiologists. 2005. 103(5). Р. 1046-1051.
24. Yadav P., Kumari I., Narang A., Baser N., Bedi V., Dindor B.K. Comparison of dural puncture epidural technique versus conventional epidural technique for labor analgesia in primigravida. J. Obstet. Anaesth. Crit. Care. 2018. 8(1). Р. 24-28.
25. Wilson S.H., Wolf B.J., Bingham K.N. et al. Labor analgesia onset with dural puncture epidural versus tradicional epidural using a 26-gauge Whitacre needle and 0.125% bupivacaine bolus: a rando-mized clinical trial. Anesth. Analg. 2018. 126. Р. 545-551.
26. Cappiello E., O’Rourke N., Segal S., Tsen L.C. A randomized trial of dural puncture epidural technique compared with the standard epidural technique for labor analgesia. Anesth. Analg. 2008. 107. 1646e51.
27. Gupta D., Srirajakalisindi A., Soskin V. Dural puncture epidural analgesia is not superior to continuous labor epidural analgesia. MEJ Anesth. 2013. 22(3). Р. 309-316.