Вступ
За даними Асоціації міжнародних марафонів та пробігів на довгі дистанції, щороку у світі проводяться понад 800 марафонів [1]. При цьому, за підрахунками, тількі у США у 2014 році марафон пробігли 550 600 бігунів [2]. Зі зростанням популярності бігу дана цифра постійно збільшується у всьому світі. У той же час надмірні фізичні навантаження, у тому числі марафонський біг, несуть і вагомі ризики для здоров’я. Смертність від марафону залишається на відносно сталому рівні, хоча показники варіюють від 0,6 до 1,9 на 100 000 бігунів [3, 4]. Основними причинами смерті при цьому є серцева патологія, тепловий удар та гіпонатріємія, причому ішемічна хвороба серця є основною причиною летальних випадків в осіб старше 45 років [4].
Незначну кількість випадків смерті на марафоні становлять теплові удари або поєднання причин, які частіше спостерігаються при несприятливих зовнішніх умовах (висока температура та вологість повітря) [4]. Ми спостерігали клінічний випадок пацієнта з поєднанням теплового удару, порушення водно-електролітного балансу та рабдоміолізу, що супроводжувався високими показниками прокальцитоніну в крові.
Клінічний випадок
Молодий, тридцятирічний, практично здоровий чоловік брав участь у забігу на напівмарафонську дистанцію. Зі слів родичів відомо, що до цього він проходив інтенсивні тренування, до лікарів зі скаргами на стан здоров’я не звертався. Метеоумови під час проведення напівмарафону: сонячно, температура повітря становила +25 °С, вологість — 39–44 %. На половині дистанції спортсмен втратив свідомість, у нього розвинулись судоми.
Під час госпіталізації стан хворого тяжкий, свідомість порушена (11–12 балів за шкалою коми Глазго). Наявне психомоторне збудження, контакту не доступний, зіниці однакового розміру, фотореакція пригнічена, рухи в кінцівках та сухожилкові рефлекси збережені. Життєві показники: артеріальний тиск — 100/60 мм рт.ст., частота серцевих скорочень — 145/хв, частота дихання — 18/хв, SatO2 — 88 %, аксилярна температура — 40 °С. На ЕКГ — синусовий ритм.
На фоні порушення свідомості, після в/в введення 300 мг натрію тіопенталу, була проведена інтубація трахеї, хворий переведений на штучну вентиляцію легень (ШВЛ), разпочата інфузійна терапія.
Для виключення церебральної патології хворому була проведена спіральна комп’ютерна томографія головного мозку, що не виявила патологічних змін щільності речовини мозку, зміщення серединних структур та кісткових ушкоджень черепа. Під нормальним тиском проведена люмбальна пункція, при якій отримано 2 мл прозорого чистого ліквору, вміст білка — 0,273 г/л, плейоцитоз — 0, еритроцити — 0.
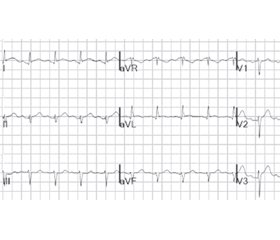
На ЕКГ реєструвалась синусова тахікардія, частота серцевих скорочень — 140/хв, вертикальне положення електричної осі серця, ознаки гіпертрофії міокарда лівого шлуночка (рис. 1). Рентгенографія органів грудної клітки патології не виявила.
При первинному огляді у відділенні температура пацієнта становила 38,0 °С, а вже через дві години збільшилась до 40,0 °С, залишаючись такою упродовж 2 годин, незважаючи на відповідні антипіретичні заходи. Відтак вона поступово зменшилась до 36,6–37,0 °С і залишалася такою практично весь період лікування. Для підтримки SpO2 на рівні 99 % виникла необхідність підвищення FiO2 до 0,5 і пікового тиску до 20 см вод.ст., що могло опосередковано свідчити про прогресування ушкодження легень у вигляді респіраторного дистрес-синдрому.
За даними лабораторних методів дослідження: Hb — 13,9 г/л, гематокрит — 42,3 %, лейкоцити — 15,5 × 109, паличкоядерні нейтрофільні гранулоцити — 30 %, токсична зернистість нейтрофілів — 90 %, мієлоцити — 2 %, метамієлоцити — 3 %, еозинофіли — 0 %, лімфоцити — 9 %, сегментоядерні нейтрофільні гранулоцити — 54 %, тромбоцити — 6 тис. Од/мкл; креатитін — 596 мкмоль/л, сечовина — 18,3 ммоль/л; загальний білірубін — 16 мкмоль/л; тропонін Т — 0,74 нг/мл (норма — менше 0,03 нг/мл, позитивний — 0,1–2,0 нг/мл).
Гази артеріальної крові: рН — 6,99, рСО2 — 49,9 мм рт.ст., рО2 — 71,2 мм рт.ст., сLac — 10,1 ммоль/л, cBase (Ecf) = –17,8 ммоль/л, сHCO3 = 10,0; К+ — 7,1 ммоль/л, Na+ — 138 ммоль/л, Cl– — 122 ммоль/л, Ca2+ — 1,13 ммоль/л; глюкоза крові — 7,8 ммоль/л. При цьому звертав на себе увагу рівень прокальцитоніну, що був підвищений у 320 разів і досягав 32,79 нг/мл (при нормі < 0,1 нг/мл).
Через 6 годин після госпіталізації стан хворого з негативною динамікою: незважаючи на проведену інфузійну терапію, розвинулась артеріальна гіпотензія — 90/60 мм рт.ст.
Протягом перебування у відділенні інтенсивної терапії пацієнт отримував лікування у вигляді інфузійної терапії збалансованими кристалоїдними розчинами в дозі близько 30 мл/кг, симпатоміметичну підтримку (норадреналін 0,1 мкг/кг/хв, добутамін 4 мкг/кг/хв), антибіотикотерапію (меропенем 3 г/добу), глюкокортикоїди (гідрокортизон 50 мг 4 рази/добу), гастропротективну терапію омепразолом, а також симптоматичну терапію.
Надалі стан пацієнта продовжував залишатися вкрай тяжким. Рівень свідомості прогресивно знижувався і характеризувався як кома ІІ ст. Проводилась ШВЛ у режимі помірної гіпервентиляції. Корекція артеріальної гіпотензії потребувала збільшення доз вазопресорів. Відмічалося зниження діурезу (олігурія): з моменту госпіталізації (за 7 годин) діурез становив 300 мл. Виник повторний епізод діареї. Відмічалось прогресування синдрому поліорганної недостатності: кома ІІ ст., рефрактерний шок (інфузія норадреналіну досягла швидкісті 1,1 мкг/кг/хв, допаміну — 14 мкг/кг/хв). Прогресувала дихальна, ниркова (анурія, гіперазотемія), печінкова недостатність із високими рівнями аланінамінотрансферази, констатовані ознаки розвитку синдрому дисемінованого внутрішньосудинного згортання (ДВЗ) крові (стадія гіпокоагуляції).
На ранок наступної доби: хворий у комі ІІ ст., гостра дихальна недостатність (пацієнт кисневозалежний, проводиться ШВЛ із FiO2 100 %), ДВЗ-синдром у стадії гіпокоагуляції, гостра серцево-судинна недостатність, гостра ниркова недостатність, гостра печінкова недостатність.
Під вечір другої доби сталася зупинка серцевої діяльності, заходи серцево-легеневої реанімації, що проводились протягом 40 хв, виявились неефективними. Констатована біологічна смерть.
Патологоанатомічно і патогістологічно були встановлені ознаки гострої коронарної недостатності, порушення реологічних властивостей крові з еритроагрегацією в просвітах судин тонкої кишки. Легені з еритростазом та сладжуванням еритроцитів у мікроциркуляторному руслі, відмішуванням формених елементів від плазми в судинах портальних трактів печінки; вогнищево-рихлі крововиливи в стромі міокарда та скелетного м’яза; фокуси рабдоміолізу скелетного м’яза. Зерниста дистрофія, фокуси некрозу епітелію звивистих канальців нирки (фокуси кортикального некрозу нирок). Катарально-десквамативний ентерит із вогнищами некрозу поверхневих прошарків слизової оболонки тонкої кишки. Периваскулярний набряк головного мозку.
Висновок патологоанатомічного експерта: констатовані зміни характерні для теплового інсульту (ТІ) навантаження з безпосередньою причиною смерті — гострою серцево-судинною недостатністю.
Обговорення
У даному клінічному випадку встановлення діагнозу «тепловий інсульт» базувалося на основі критеріїв А. Bouchama [4] та критеріїв Japanese Association for Acute Medicine [5].
Загалом ТІ — це синдром гострої терморегуляторної недостатності в умовах підвищеної температури навколишнього середовища зі збільшенням центральної (ядерної) температури вище 40 °С, який характеризується тяжкою дисфункцією центральної нервової системи (ЦНС) (наприклад, делірієм, атаксією, комою і судомами), тяжкою дегідратацією з гіпотензією й ураженням практично всіх органів і тканин, що включає рабдоміоліз, гостру ниркову недостатність, синдром дисемінованого внутрішньосудинного згортання крові, печінкову недостатність із жовтяницею і підвищенням рівня трансаміназ, ураження серця і легень, шлунково-кишкового тракту (ШКТ) і типові порушення біохімічних і фізіологічних процесів.
У США упродовж жаркого літа від теплового інсульту помирає приблизно 4 тисячі осіб [5]. Смертність та інвалідизація пацієнтів, які перенесли ТІ, напряму залежать від висоти піка температури і тривалості існування критичної гіпертермії. Якщо критична гіпертермія триває більше двох годин, то летальність може досягати 70 % [6].
Відрізняють два різновиди теплового інсульту: один пов’язаний із надмірним фізичним навантаженням в умовах підвищеної температури навколишнього середовища, а другий (класичний тепловий інсульт) — тільки з підвищеною температурою навколишнього середовища (особливо вразливими є особи похилого віку) [6].
Більшість епізодів ТІ навантаження спостерігається в молодих осіб, які виконують фізичні навантаження на сонці, особливо військовослужбовців або спортсменів (наприклад, бігуни на довгі дистанції — марафонські бігуни).
Незважаючи на те, що в разі ТІ навантаження терморегуляція не порушена, теплове ураження органів і тканин відбувається за рахунок надмірної продукції ендогенної теплової енергії в умовах зменшення тепловіддачі через високу температуру навколишнього середовища і зменшення потовиділення через зневоднення організму.
В основі патогенезу теплового інсульту навантаження лежать два основні чинники: підвищення теплопродукції (фізичне навантаження) і порушення тепловіддачі (висока температура і вологість повітря).
Під час фізичного навантаження швидкість продукції ендогенної теплової енергії коливається від 300 до 900 ккал/год. Навіть за максимальної втрати тепла з випаровуванням поту для запобігання перегріву втрати тепла з організму повинні становити від 500 до 600 ккал/год.
У разі ТІ навантаження первинне пошкодження тканин зумовлюється прямим пошкодженням клітин організму в разі аксилярної температури вище 42 °С. Температура 42 °С має назву «критичний термальний максимум». За такої температури порушується функція мітохондрій із розвитком тотального внутрішньоклітинного енергодефіциту, що, зі свого боку, призводить до порушення ферментативних реакцій, що насамперед відповідають за підтримку внутрішньоклітинного електролітного гомеостазу, і, як результат, порушується формування мембранного потенціалу і функції клітин. Даний цитотоксичний ефект надмірно підвищеної температури поширюється практично на всі органи і тканини в разі наявності всіх гіпертермічних синдромів. Дегідратація, метаболічний ацидоз, місцева гіпоксія посилюють гіпертермічні пошкодження тканин [7].
ТІ в результаті фізичного навантаження супроводжується тяжким метаболічним лактатацидозом, гіпоксією, гіперкаліємією в результаті роботи м’язів і можливого рабдоміолізу на фоні більш-менш нормального волемічного статусу [8].
Енергетичним субстратом для роботи смугастої мускулатури є розпад АТФ з утворенням АДФ і неорганічного фосфату. Ресинтез АТФ забезпечується трансфосфорилюванням АДФ із креатинфосфатом за участі ферменту креатинкінази. Даний шлях ресинтезу АТФ є надзвичайно швидким і максимально ефективним — за рахунок кожної молекули креатинфосфату утворюється одна молекула АТФ. Тому практично неможливо визначити зниження АТФ і підвищення АДФ. Деяка кількість АТФ може ресинтезуватись у результаті аденілаткіназної (міокіназної) реакції: 2АДФ = АТФ + АМФ.
За роботи помірної інтенсивності смугаста мускулатура може покривати свої енергетичні затрати за рахунок аеробного гліколізу. Однак за умов великих навантажень, коли можливість надходження кисню відстає від потреб, м’язи змушені використовувати анаеробний гліколіз, швидкість якого збільшується в сотні разів з утворенням великої кількості молочної кислоти, та її рівень може підвищуватись до 1–1,2 г/кг і вище. Зазвичай молочна кислота надходить у печінку і метаболізує до піровиноградної кислоти (ПВК) у циклі глюконеогенезу. ПВК метаболізує до ацетил-КоА, що включається в цикл трикарбонових кислот. В умовах надмірного фізичного навантаження печінка не спроможна метаболізувати весь лактат до ПВК, і тому створюються умови для розвитку декомпенсованого метаболічного лактатацидозу з розвитком гіперкаліємії за рахунок виходу калію з м’язових клітин.
На сьогодні відомо, що в спортсменів під час марафонського бігу розвиваються вищеперераховані порушення метаболізму, а також різні порушення з боку імунної системи і ШКТ. Порушення з боку ШКТ зумовлюються перерозподілом кровотоку зі зменшенням кровопостачання слизової оболонки ШКТ майже на 80 %, із розвитком ішемії кишечника, спазму ниркових судин і збільшенням кровопостачання працюючих м’язів. Ішемія кишечника призводить до підвищення проникності слизової оболонки для патогенної мікрофлори і продуктів її метаболізму, що супроводжується транслокацією патогенної грамнегативної мікрофлори в портальний, а потім у системний кровотік із розвитком септицемії і надмірної системної запальної реакції. Клінічними проявами пошкодження ШКТ під час надмірного фізичного навантаження є діарея, нудота, блювання, шлунково-кишкова кровотеча, спазм кишечника, які є результатом транслокації ендотоксину грамнегативних бактерій через слизову оболонку кишечника з пригніченням протизапальної реакції організму і продукцією ендогенних пірогенів [9–13].
У формування гіпертермії в разі надмірного фізичного навантаження, крім надлишкової продукції теплової енергії працюючими м’язами, роблять свій внесок і ендогенні пірогени. І це все відбувається на фоні лактатацидозу і гіперкаліємії.
Пригнічення імунокомпетентних клітин та їх функцій, пригнічення клітинного імунітету, транслокація ендотоксинів, пригнічення продуції антиліпополісахаридних антитіл, підвищення макрофагальної активності призводять до пошкодження м’язів, підвищення концентрації циркулюючих прозапальних і пірогенних цитокінів. У тому числі надмірне фізичне навантаження може призводити до розвитку ендотоксемії, гіпертермії та можливого теплового інсульту.
На сьогодні встановлено, що важливу роль у формуванні ТІ навантаження відіграють гіпертермія, септицемія, термічні і судинні ушкодження центральної нервової системи, серцево-судинна недостатність [7]. Існує думка, що гіпертермія запускає, а ендотоксемія формує ТІ навантаження. Ендотоксемія формує системну запальну відповідь організму, що може призвести до синдрому внутрішньосудинного згортання крові в різних органах, некрозу і смерті клітин із розвитком синдрому поліорганної недостатності [14].
Дегенерація і некроз м’язів є результатом прямої пошкоджуючої дії високої температури. Більш тяжке пошкодження м’язів зумовлюється місцевим підвищенням температури, гіпоксією, метаболічним ацидозом, тяжким рабдоміолізом зі значним підвищенням м’язових ферментів — креатинфосфокінази.
У разі теплового інсульту навантаження серцевий викид зазвичай високий і сприяє збільшенню пошкоджень. Підвищене потовиділення, що становить під час ТІ 1,5–2,0 л/год, зумовлює розвиток гіпотонічної дегідратації. Низький судинний тонус посилює клінічні прояви дегідратації. Артеріальна гіпотензія може бути результатом суттєвого зниження серцевого викиду в результаті температурно індукованих крововиливів або некрозів міокарда з розвитком серцевої недостатності. Посмертно знаходять фокальний міоцитоліз, міокардіальний некроз і геморагії в субепікардіальному, інтрамускулярному, субендокардіальному або інтравальвулярному просторах.
Пряма дія підвищеної температури на головний і спинний мозок швидко викликає смерть клітин, набряк мозку і локальні крововиливи. Це може призвести до порушень свідомості і коми (майже завжди ці зміни супроводжують всі гіпертермічні синдроми). Судоми можуть виникати вторинно після розвитку набряку мозку і геморагій. Особливо чутливі до токсичної дії високої температури клітини Пуркіньє мозочка. Тому їх пошкодження може гостро проявлятися атаксією, дизметрією, дизартрією. Ці симптоми можуть зберігатися в пацієнтів, які вижили після перенесеного теплового інсульту навантаження. Визначаються підвищена концентрація білка, ксантохромія, невеликий лімфоцитарний плейоцитоз. Ті, хто вижив після тяжкого теплового інсульту навантаження, можуть мати катаракту як результат дегідратації.
Пошкодження нирок спостерігаються майже у всіх пацієнтів із ТІ. Причини пошкодження нирок: дегідратація, артеріальна гіпотензія і рабдоміоліз. У пацієнтів із ТІ навантаження гостра ниркова недостатність розвивається в 35 % випадків (із класичним ТІ — у 5 % пацієнтів). Розвивається гострий тубулярний некроз у результаті дегідратації, пігментного навантаження й уратної нефропатії. Лабораторні зрушення включають: низьку осмолярність плазми, гіперкаліємію, гіпокальціємію, високий рівень креатинфосфокінази (більше 10 тис. ОД/л), помірну протеїнурію, наявність осаду і жирових крапель у сечі.
Можливий розвиток ішемічних виразок слизової оболонки ШКТ за рахунок прямої термотоксичної дії і гіпоперфузії слизової оболонки з розвитком кровотеч. Особливо чутлива до температурних пошкоджень печінка. Некроз гепатоцитів і холестаз досягають свого максимуму на 2–3-й день після ТІ навантаження і в 5–10 % можуть бути причиною смерті.
Вміст лейкоцитів підвищується за рахунок збільшення концентрації в крові катехоламінів і згущення крові. Часто спостерігаються анемія і геморагічний діатез, які можуть бути результатом: прямої теплової інактивації тромбоцитів і факторів згортання крові; зниження синтезу факторів згортання крові в печінці; зниження вмісту тромбоцитів і мегакаріоцитів за рахунок розвитку синдрому дисемінованого внутрішньосудинного згортання крові.
Результати стернальної пункції свідчать про селективний пригнічуючий вплив ТІ навантаження на мегакаріоцитарний росток кісткового мозку. Рівень мегакаріоцитів зменшується на 50 %, а мегакаріоцити в пацієнтів, які вижили, виглядають морфологічно неповноцінними.
Синдром дисемінованого внутрішньосудинного згортання крові виявився на 2-гу — 3-тю добу в більшості випадків гіпертермій, які закінчилися смертю, і запускається згортанням крові після пошкодження ендотеліоцитів, які дуже чутливі до надлишкового тепла. У результаті синдрому внутрішньосудинного згортання крові одночасно пошкоджуються серце, центральна нервова система, легені, ШКТ, печінка, нирки.
В тяжких випадках розвивається гіпоглікемія, що призводить до метаболічного виснаження організму. У разі середньої тяжкості можуть спостерігатись гіперглікемія і підвищення рівня кортизолу. Незважаючи на те, що під час гістологічного дослідження наднирників часто реєструються перикортикальні крововиливи, у пацієнтів, які вижили, спостерігається мінімальна адреналова дисфункція. Рівні соматотропного гормона й альдостерону різко підвищуються в разі тяжкого ТІ навантаження для збереження об’єму циркулюючої крові.
Гіпертермія викликає швидкі порушення обміну калію, натрію, фосфору і кальцію. У разі ТІ навантаження за рахунок потовиділення можливі суттєві втрати організмом калію з розвитком гіпокаліємії і гіпокалійгістії. Однак у разі суттєвого пошкодження клітин може спостерігатись вкрай висока гіперкаліємія. У разі наявності рабдоміолізу рівень фосфору може знижуватись нижче 1 мг/дл. Рівень кальцію може знижуватись на 2-гу — 3-тю добу після пошкодження клітин за рахунок внутрішньоклітинного накопичення.
У хворих із тяжкими пошкодженнями тканин на 2–3-й тиждень може спостерігатись рикошетна гіперкальціємія за рахунок підвищення концентрації паратиреоїдного гормона.
Пряме температурне пошкодження ендотелію судин легень може призвести до розвитку гострого респіраторного дистрес-синдрому. У результаті цього, а також у результаті пошкодження міокарда може розвинутись набряк легень. Підвищена потреба в кисні і метаболічний ацидоз часто викликають респіраторний алкалоз. Однак більш характерним для ТІ навантаження є метаболічний ацидоз.
ТІ легко діагностується за допомогою збору анамнезу й огляду пацієнта, а діагноз остаточно встановлюється після реєстрації температури в прямій кишці вище 40 °С. Додаткові діагностичні критерії, що варто враховувати, включають тяжкі порушення свідомості або кому і високі рівні в крові креатинфосфокінази.
Первинна терапія насамперед повинна включати:
— зовнішнє охолодження і пригнічення термогенезу. Методи охолодження передбачають переміщення потерпілого в тінь на холодну поверхню, роздягання, обливання шкіри водою з температурою 15 °С, охолодження за допомогою вентилятора або транспортування потерпілого на відкритому транспорті. Методи зовнішнього охолодження вважаються досить ефективними. Якщо температура тіла знижується швидко, то летальність може бути знижена до 11 % [15]. До ускладнень гіпертермії в результаті ТІ навантаження належать: аритмії, метаболічний ацидоз, серцева недостатність;
— суправентрикулярна тахікардія зазвичай не потребує лікування, тому що є адаптаційною реакцією, направленою на відновлення нормальної температури і метаболізму;
— препарати дигіталісу повинні бути виключені в пацієнтів із ТІ навантаження, тому що збільшують ймовірність розвитку критичної гіперкаліємії;
— артеріальна гіпотензія повинна лікуватись спочатку інфузією ізотонічного розчину натрію хлориду, а за потреби — ізопротеренолом (бета-адреноміметиком);
— допамінергічні й альфа-адренергічні агоністи не повинні використовуватись, тому що вони викликають периферичну вазоконстрикцію і, таким чином, зменшують тепловіддачу;
— поповнення судинного об’єму декстранами протипоказане, оскільки останні справляють антикоагулянтний ефект;
— бажано гемодинаміку контролювати інвазивними методами. У пацієнтів із ТІ швидко розвивається зниження тонусу периферичних судин, що зумовлене дегідратацією, порушеннями функцій серця, із високим ризиком розвитку застійної серцевої недостатності і ниркової недостатності;
— судоми, які часто спостерігаються в пацієнтів із ТІ, успішно лікуються діазепамом;
— необхідно контролювати газовий склад крові. Підвищення температури тіла на 1 °С вище 37 °С супроводжується підвищенням парціального напруження кисню на 7,2 %, рСО2 — на 4,4 % і зниженням рН на 0,015. Тому хворим показана інгаляція 100% кисню;
— для корекції метаболічного ацидозу може бути використана інфузія бікарбонату натрію в початковій дозі 30 г (приблизно 700 мл 4,2% розчину натрію бікарбонату).
Лікування ускладнень гіпертермії передбачає такі заходи:
— хворі, які перебувають у коматозному стані, повинні бути інтубовані для профілактики аспірації. Для контролю сечовиділення необхідно катетеризувати сечовий міхур. Пацієнтам рутинно вводиться 1–2 мг/кг розчину маніту впродовж 15–20 хвилин із метою стимуляції діурезу і лікування набряку мозку. Продовжують стимуляцію діурезу дрібними дозами фуросеміду;
— у всіх пацієнтів із гіпертермією повинен моніторуватися рівень калію. У разі гіперкаліємії застосовують полістеролсульфонати;
— середня і тяжка печінкова недостатність є звичайною ознакою ТІ і в комбінації з нирковою недостатністю може обмежувати застосування лікувальних препаратів;
— для запобігання шлунково-кишковій кровотечі показане застосування Н2-блокаторів;
— синдром дисемінованого внутрішньосудинного згортання крові підвищує летальність, тому вміст тромбоцитів і коагулограма повинні ретельно конт-ролюватися;
— рутинне застосування глюкокортикоїдів й антибіотиків не рекомендується.
Таким чином, у даному клінічному випадку основним пусковим моментом розвитку критичного термінального стану пацієнта слід вважати надмірне фізичне навантаження в умовах високої температури повітря навколишнього середовища, що призвело до необоротних критичних розладів метаболізму та подальшої смерті.
Отримано/Received 10.01.2021
Рецензовано/Revised 20.01.2021
Прийнято до друку/Accepted 01.02.2021

/132.jpg)