Журнал «Здоровье ребенка» Том 16, №6, 2021
Вернуться к номеру
Сучасний досвід застосування амінокислотних сумішей у дітей
Авторы: Няньковський С.Л., Няньковська О.С., Яцула М.С., Городиловська М.І.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
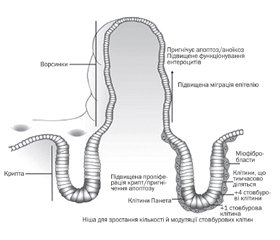
Амінокислотні суміші подібні до більшості інших сумішей, за винятком однієї важливої відмінності. Замість того, щоб містити цільний або розщеплений білок коров’ячого молока, вони містять вільні амінокислоти. Розмір цих окремих амінокислот невеликий, тому вони не розпізнаються імунною системою як алергени і не провокують алергічну реакцію в дітей з алергією на білок коров’ячого молока. Згідно з дослідженнями, амінокислотні суміші добре переносяться та забезпечують адекватний ріст як у здорових немовлят, так і в дітей з алергією на білок коров’ячого молока. Cиндром короткої кишки — це розлад, що характеризується діареєю, порушенням всмоктування, порушеннями обміну рідини й електролітів і, зрештою, мальнутрицією і зазвичай викликається масивною резекцією тонкої кишки. Незважаючи на те, що його причини різноманітні, лікування має однакову основу: парентеральне та раннє ентеральне харчування. Останнє залишається важливим і контрольованим фактором прогнозу даного захворювання. Пряма трофічна дія поживних речовин і стимуляція шлунково-кишкової секреції та гормональних факторів посилює кишкову адаптацію. Амінокислотні суміші сприяють швидкому відлученню від парентерального харчування та переходу на повне ентеральне. Крім того, дослідження показують, що вони знижують запальний процес у кишечнику (рівень фекального кальпротектину).
Amino acid-based formulas (AAFs) are similar to most other infant kinds of milk except for one important difference. Instead of containing whole or broken down cow’s milk protein, they contain amino acids. These individual amino acids are so small that they are not recognised by the immune system as allergens and do not provoke any allergic reaction in children with cow’s milk allergy. In recent studies, AAFs were well tolerated and supported growth in otherwise healthy infants without cow’s milk protein allergy, and in those with cow’s milk protein allergy. Short bowel syndrome, a disorder characterized by diarrhea, malabsorption, fluid and electrolyte disturbances, and eventually malnutrition, is usually caused by massive intestinal resection. Even though the causes of short bowel syndrome are diverse, the management has identical pillars: parenteral nutrition and early enteral nutrition. Enteral nutrition remains an important and controllable factor. The direct trophic effect of nutrients and stimulation of gastrointestinal secretions and hormonal factors enhances intestinal adaptation. AAFs promote rapid weaning of parenteral nutrition after the introduction of an elemental formula. Besides, studies show that they reduce intestinal inflammation (the level of fecal calprotectin).
білок коров’ячого молока; алергія на білок коров’ячого молока; харчова алергія; синдром короткої кишки; мальабсорбція; амінокислотна суміш
cow’s milk protein; allergy to cow’s milk protein; food allergy; short bowel syndrome; malabsorption; amino acid-based formula
Особливості ведення дітей з анафілаксією
Особливості ведення дітей із синдромом короткої кишки
- Levin M.E., Blackhurst D.M., Kirstein F. [et al.]. Residual allergenicity of amino acid-based and extensively hydrolysed cow's milk formulas. SAMJ. 2017. Vol. 107. http://dx.doi.org/10.7196/samj.2017.v107i9.12137.
- World Health Organisation: Global surveillance, prevention, and control of chronic respiratory diseases: a comprehensive approach. 2007. http://www.who.int/gard/publications/GARD%20Book%202007.pdf.
- Fiocchi A., Brozek J., Schunemann H. [et al.]. World Allergy organization (WAO) diagnosis and rationale for action against Cow’s milk allergy (DRACMA) guidelines. World Allergy Organ. J. 2010. Vol. 3 (4). P. 57-161. doi: 10.1097/WOX.0b013e3181defeb9.
- Venter C., Pereira B., Voigt K. [et al.]. Prevalence and cumulative incidence of food hypersensitivity in the first 3 years of life. Allergy. 2008. Vol. 63 (3). P. 354-359.
- Rona R.J., Keil T., Summers C. [et al.]. The prevalence of food allergy: a meta-analysis. J. Allergy Clin. Immunol. 2007. 120 (3). 638-646. doi: 10.1016/j.jaci.2007.05.026.
- Levin M.E., Gray C.L., Goddard E. [et al.], for the South African Food Allergy Working Group (SAFAWG). South African food allergy consensus document. S. Afr. Med. J. 2015. Vol. 105(1). P. 62-65.
- Abrams E.M., Kim H., Gerdts, J., Protudjer J.L.P. Milk allergy most burdensome in multi-food allergic children. Pediatr. Allergy Immunol. 2020. Vol. 31. P. 827-834.
- Meyer R., Godwin H., Dziubak R. [et al.]. The impact on qua–lity of life on families of children on an elimination diet for Non-immunoglobulin E mediated gastrointestinal food allergies. World Allergy Organ. J. 2017. Vol. 10. P. 8.
- Schoemaker A.A., Sprikkelman A.B., Grimshaw K.E. [et al.]. Incidence and natural history of challenge-proven cow’s milk allergy in European children — EuroPrevall birth cohort. Allergy. 2015. Vol. 70. P. 963-972.
- Luyt D., Ball H., Makwana N. [et al.]. BSACI guideline for the diagnosis and management of cow’s milk allergy. Clin. Exp. Allergy. 2014. Vol. 44. P. 642-672.
- Koletzko S., Niggemann B., Arato A. [et al.]. Diagnostic Approach and Management of Cow’s-Milk Protein Allergy in Infants and Children: Espghan gi committee practical guidelines. J. Pediatr. Gastroenterol. Nutr. 2012. Vol. 55. P. 221-229.
- Meyer R., Groetch M., Venter C. When Should Infants with Cow’s Milk Protein Allergy Use an Amino Acid Formula? A Practical Guide. J. Allergy Clin. Immunol. Prac. 2018. Vol. 6. P. 383-399.
- https://neocatevillage.com.au/info/cows-milk-allergy/what-are-the-types-of-infant-formula/
- Burks W., Jones S.M., Berseth C.L. [et al.]. Hypoallergeni–city and effects on growth and tolerance of a new amino acid-based formula with docosahexaenoic acid and arachidonic acid. J. Pediatr. 2008. Vol. 153. P. 266-271.
- Hoffman K.M., Sampson H.A. Serum specific-IgE antibodies to peptides detected in a casein hydrolysate formula. Pediatr. Allergy Immunol. 1997. Vol. 8. P. 185-189.
- De Boissieu D., Dupont C. Allergy to extensively hydrolyzed cow's milk proteins in infants: safety and duration of amino acid-based formula. J. Pediatr. 2002. Vol. 141. P. 271-273.
- Isolauri E., Sutas Y., Makinen-Kiljunen S. [et al.]. Efficacy and safety of hydrolyzed cow milk and amino acid-derived formulas in infants with cow milk allergy. J. Pediatr. 1995. Vol. 127. P. 550-557.
- Nowak-Wegrzyn A., Czerkies L.A., Collins B. [et al.]. Evaluation of hypoallergenicity of a new, amino acid-based formula. Clin. Pediatr. (Phila). 2015. Vol. 54. P. 264-272.
- Hill D.J., Murch S.H., Rafferty K. et al. The efficacy of amino acid-based formulas in relieving the symptoms of cow's milk allergy: a systematic review. Clin. Exp. Allergy. 2007. Vol. 37. P. 808-822.
- Arvola T., Moilanen E., Vuento R. [et al.]. Weaning to hypoallergenic formula improves gut barrier function in breast-fed infants with atopic eczema. J. Pediatr. Gastroenterol. Nutr. 2004. Vol. 38. P. 92-96.
- Vanderhoof J., Moore N., de Boissieu D. Evaluation of an Amino Acid-Based Formula in Infants Not Responding to Extensively Hydrolyzed Protein Formula. J. Pediatr. Gastroenterol. Nutr. 2016. Vol. 63(5). P. 531-533.
- Niggemann B., Binder C., Dupont C. [et al.]. Prospective, controlled, multi-center study on the effect of an amino-acid-based formula in infants with cow’s milk allergy/intolerance and atopic dermatitis. Pediatr. Allergy Immunol. 2001. Vol. 12. P. 78-82.
- Dupont C., Kalach N., Soulaines P. [et al.]. Safety of a new amino acid formula in infants allergic to cow’s milk and intolerant to hydrolysates. J. Pediatr. Gastroenterol. Nutr. 2015. Vol. 61. P. 456-463.
- Sicherer S.H., Noone S.A., Koerner C.B. [et al.]. Hypoallergenicity and efficacy of an amino acid-based formula in children with cow's milk and multiple food hypersensitivities. J. Pediatr. 2001. Vol. 138. P. 688-693.
- Dupont C., Kalach N., Soulaines P. [et al.]. A thickened amino-acid formula in infants with cow’s milk allergy failing to respond to protein hydrolysate formulas: a randomized double-blind trial. Paediatr Drugs. 2014. Vol. 16. P. 513-522.
- Von Berg A., Koletzko S., Grubl A. [et al.]. The effect of hydrolyzed cow's milk formula for allergy prevention in the first year of life: the German infant nutritional intervention study, a randomized double-blind trial. J. Allergy Clin. Immunol. 2003. Vol. 111 (3). P. 533-534. doi: 10.1067/mai.2003.101.
- National Institute for Health and Clinical Excellence: Diagnosis and assessment of food allergy in children and young people in primary care and community settings. London, 2011. http://www.nice.org.uk/CG116. 2011.
- Boyce J.A., Assa’ad A., Burks A.W. [et al.]. Guidelines for the diagnosis and management of food allergy in the United States: report of the NIAID-sponsored expert panel. J. Allergy Clin Immunol. 2010. Vol. 126. P. S1-S58.
- Allen K.J., Davidson G.P., Day A.S. [et al.]. Management of cow’s milk protein allergy in infants and young children: an expert panel perspective. J. Paediatr. Child Health. 2009. Vol. 45 (9). P. 481-486. doi: 10.1111/j.1440-1754.2009.01546.x.
- Bhatia J., Greer F. Use of soy protein-based formulas in infant feeding. Pediatrics. 2008. Vol. 121 (5). P. 1062-1068. doi: 10.1542/peds.2008-0564.
- Vandenplas Y., Koletzko S., Isolauri E. [et al.]. Guidelines for the diagnosis and management of cow's milk protein allergy in infants. Arch. Dis. Child. 2007. Vol. 92 (10). P. 902-908. doi: 10.1136/adc.2006.110999.
- Venter C., Brown T., Shah N. [et al.]. Diagnosis and management of non-IgE-mediated cow’s milk allergy in infancy — a UK primary care practical guide. Clinical and Translational Allergy. 2013. Vol. 3. https://ctajournal.biomedcentral.com/articles/10.1186/2045-7022-3-23
- Barrera E.L., Ramirez-Farias C., Marriag B.J. Nutritional Management of Cow’s Milk Allergy in Infants: A Comparison of –DRACMA, ESPGHAN, and AAP Guidelines. The Open Nutrition Journal. 2021. Vol. 15. https://benthamopen.com/FULLTEXT/TONUTRJ-15-1
- Jones H.E. Amino Acid-based Formula affects the gastrointestinal cytokine milieu of children with non-IgE mediated Cow’s Milk Allergy. FAAM. 2014.
- Warner B.W., Vanderhoof J.A., Reyes J.D. What’s new in the management of short gut syndrome in children. JACS. 2000. Vol. 190 (6). P. 725-736.
- Wessel J.J. Short bowel syndrome. In: Groh-Wargo S., Thompson M., Hovasi-Cox J. (ed.). Nutritional Care of High Risk Newborns. Chicago, IL. Precept Press, 2000. P. 469-487.
- Vanderhoof J.A. Short bowel syndrome. In: Walker W.A., Watkins J.B. (ed.). Nutrition in Pediatrics: Basic Science and Clinical Applications. Hamilton. B.C. Decker Inc., 1997. P. 609-618.
- Serrano M.S., Schmidt-Sommerfeld E. Nutrition support of infants with short bowel syndrome. Nutrition. 2002. Vol. 18 (11–12). P. 966-970.
- Johnson M.D. Management of short bowel syndrome — A review. Support Line. 2000. Vol. 22 (6). P. 11-23.
- Price P.T. Necrotizing enterocolitis. In: Groh-Wargo S., Thompson M., Hovasi-Cox J. (ed.). Nutritional Care of High Risk Newborns. Chicago, IL. Precept Press, 2000. P. 425-438.
- DiBaise J.K., Young R.J., Vanderhoof J.A. Intestinal rehabilitation and the short bowel syndrome: part 2. American Journal of Gastroenterology. 2004. Vol. 99 (9). P. 1823-1832.
- Gupte G.L., Beath S.V., Kelly D.A. [et al.]. Current issues in the management of intestinal failure. Archives of Disease in Childhood. 2006. Vol. 91(3). P. 259-264.
- Playford R.J., Macdonald C.E., Johnson W.S. Colostrum and milk-derived peptide growth factors for the treatment of gastrointestinal disorders. American Journal of Clinical Nutrition. 2000. Vol. 72 (1). P. 5-14.
- De Greef E., Mahler T., Janssen A. [et al.]. The Influence of Neocate in Paediatric Short Bowel Syndrome on PN Weaning. J. Nutr. Metab. 2010. 2010. 297575. doi: 10.1155/2010/297575.
- Buchman A.L. The clinical management of short bowel syndrome: steps to avoid parenteral nutrition. Nutrition. 1997. Vol. 13. P. 907-913.
- Rubin D.C., Levin M.S. Mechanisms of intestinal adaptation. Elsevier. 2016. Vol. 30. P. 237-248.
- Chan M.F., Klein S. Short bowel syndrome. In: Rombeau J.L., Rolandoeli R.H., Kersy R. (ed.). Clinical Nutrition and Enteral Tube Feeding. Philadelphia, PA. WB Saunders Co, 1996. P. 575-587.
- Vanderhoof J.A., Grandjean C.J., Kaufman S.S. [et al.]. Effect of high percentage medium-chain triglyceride diet on mucosal adaptation following massive bowel resection in rats. JPEN. 1984. Vol. 8. P. 685-689.
- Vanderhoof J.A., Blackwood D.A., Mohammadpour H., Park J.H. Effect of dietary menhaden oil on normal growth and development and on ameliorating mucosal injury in the rat. AJCN. 1991. Vol. 54 (2). P. 346-350.
- Bines J., Francis D., Hill D. Reducing parenteral requirement in children with short bowel syndrome: impact of an amino acid-based complete infant formula. J. Pediatr. Gastroenterol. Nutr. 1998. Vol. 26 (2). P. 123-128. doi: 10.1097/00005176-199802000-00001.
- Hyo-Jeong Jang, Jae Hyun Park, Chun Soo Kim [et al.]. Amino Acid-Based Formula in Premature Infants with Feeding Intolerance: Comparison of Fecal Calprotectin Level. Pediatr Gastroenterol Hepatol. Nutr. 2018. Vol. 21 (3). P. 189-195.
- Наказ МОЗ України від 05.05.2021 № 870 «Про затвердження Уніфікованого клінічного протоколу вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Ентеральне харчування недоношених немовлят».

/27.jpg)
/29.jpg)