Вступ
Сучасні дослiдження демонструють зростання поширеності порушень якісного та кількісного складу харчування, збільшення частоти гострої та хронiчної соматичної патології, а також епізодів синдрому дезадаптацiї, вроджених вад розвитку [1]. Невід’ємною частиною фізичного та нервово-психічного розвитку дитини є її раціональне харчування. Воно є критично важливим для здоров’я, працездатностi, опірності органiзму до впливу факторiв довкiлля [1, 2].
Збалансоване та відповідне потребам дитини в енергії та базових нутрієнтах харчування у цих обставинах забезпечує повну реалізацію генетичного потенціалу організму дитини, її фізіологічний нервово-психічний розвиток, формування імунологічної реактивності [2–5]. На противагу цьому неадекватне харчування (як незбалансоване, так і надмірне) справляє величезний негативний вплив на всі аспекти формування дитячого організму, про що свідчить значна кількість доказів [5–7]. Регулярне використання пестицидів, гербіцидів і мінеральних добрив утруднює засвоєння з ґрунту мікроелементів рослинами [8]. Внаслідок цього у харчуванні зростає частка рафінованих і висококалорійних, проте бідних вітамінами та мінералами продуктів [9]. Недостатнє або невідповідне потребам організму дитини нутритивне забезпечення у дошкільному віці обумовлює сповільнення фізичного та нервово-психічного розвитку [2, 3, 7]. Нутрієнти мають критичне значення для проліферації клітин, синтезу ДНК, метаболізму гормонів та нейромедіаторів, експересії генів і є невід’ємними складовими ферментних систем у мозку [10, 11]. Кілька груп дослідників встановили, що харчовий раціон сучасних дітей є загалом незбалансованим та таким, що містить надлишок калорій і білків. Разом із тим уміст мікроелементів і вітамінів у ньому виявився недостатнім [3, 12].
Дефіцит заліза є одним із найпоширеніших нутритивних дефіцитів як у країнах, що розвиваються, так і в розвинутих країнах (табл. 1) [11, 13]. Залізо бере участь у забезпеченні мітотичної активності Т-клітин, контролі за диференціацією клітин, що здійснюється за рахунок достатнього надходження заліза через трансферинові рецептори, повноцінному фагоцитозі, підтриманні високої активності NK-клітин, підтриманні бактерицидної здатності сироватки, експресії поверхневих антигенів ІІ класу головного комплексу гістосумісності на Т-лімфоцитах та інших імунокомпетентних клітинах [14, 15]. Залізо впливає також на стан гуморального імунітету. Воно виступає есенціальним елементом для мітохондрій, відіграє ключову роль у реакціях перенесення електронів, що генерують АТФ під час аеробного обміну речовин [2]. Залізо має критичне значення для синтезу жирних кислот, необхідних для мієлінізації нервових волокон, та нейромедіаторів (серотонін, дофамін, адреналін та норадреналін). Залізо є складовою цитохрому P-450, задіяного в детоксикації широкого спектра ксенобіотиків [2].
/41.jpg)
Одним із найважливіших мікроелементів в організмі людини є кальцій (табл. 1) [13]. Кальцій забезпечує цілісність кісткової системи, яка виступає в ролі депо, де він перебуває у динамічній рівновазі з кальцієм кровоносної системи, а також буфера для підтримки стабільного рівня його циркуляції в організмі. Окрім участі у формуванні кісток, дентину й емалі зубів, кальцій виконує низку інших фізіологічно важливих функцій [16]. До них належать: участь у процесах скорочення м’язів, регуляція трансмембранного потенціалу клітини, нервової та нервово-м’язової провідності, участь у процесі згортання крові та контроль всіх реакцій каскаду гемокоагуляції, зменшення проникності стінок судин, забезпечення кислотно-лужної рівноваги організму, активація цілої низки ферментів і гормонів деяких ендокринних залоз, потенціювання дії вазопресину, протизапальна, десенсибілізуюча дія, забезпечення опірності організму до зовнішніх впливів та інфекційних чинників, формування короткотривалої пам’яті та здібностей до навчання, активація апоптозу та транскрипційного апарату клітин [16].
У дітей із неврологічною патологією поширеність дефіциту магнію (табл. 1) [13], як свідчать результати досліджень, може досягати 67,9 % [17]. Магній є одним із чинників регуляції стану клітинної мембрани; бере участь у трансмембранному перенесенні іонів кальцію (Ca2+) і натрію (Na+) та в метаболічних реакціях утворення, накопичення, перенесення й утилізації енергії, вільних радикалів і продуктів їх окиснення [17]; задіяний у передачі генетичної інформації [17]. Магній знижує тривожність і дратівливість, забезпечує регуляцію метаболізму кардіоміоцитів, пригнічує виділення катехоламінів та альдостерону під час стресових реакцій організму, реалізуючи таким чином свій гіпотензивний ефект [17].
Дефіцит магнію призводить до зниження вмісту нейтрофілів і моноцитів у крові, пришвидшення інволюції тимуса, пригнічення активності В- і Т-клітин та гуморальної відповіді, посилення чутливості організму до інфекційного процесу [17]. Магній — антагоніст кальцію, що бере участь в обміні білків, жирів і вуглеводів, знижує вміст ацетилхоліну в нервовій тканині, задіяний у процесах в мітохондріях клітин та розслабленні гладких м’язів, у регуляції нейрохімічної передачі та м’язової збудливості. Магній тримає під контролем баланс внутрішньоклітинного калію, є кофактором численних ферментативних реакцій, не допускає проходження іонів кальцію через пресинаптичну мембрану, підвищує осмотичний тиск у просвіті кишечника, прискорює його перистальтику, знижує агрегацію тромбоцитів, нормалізує артеріальний тиск [8, 17]. Магній сприяє збереженню фізіологічного рівня кальцію в кістковій тканині та його постійному оновленню в кістці, запобігає втраті кальцію. Тривалий дефіцит магнію на тлі гіподинамії та недостатності кальцію є важливою передумовою формування сколіозу й остеохондрозу хребта. Магній є одним із основних елементів, що підтримує процеси збудження/гальмування в рівновазі [18].
Психомоторний розвиток дитини є складним процесом, якому притаманні певний алгоритм і асинхронність дозрівання окремих функцій, їх якісні перетворення в певні вікові періоди [19]. Діти з неврологічними порушеннями порівняно зі здоровими однолітками мали вірогідно більший ризик гірших наслідків для здоров’я внаслідок впливу на них несприятливих соціально-економічних факторів, особливо на фоні сімейних негараздів [20].
Діти з порушеннями психомоторного розвитку на тлі різноманітної соматичної патології стають особливо вразливими до дефіциту нутритивного забезпечення, що зумовлено особливостями їх харчування і призводить до суттєвого ускладнення їх реабілітації. Однією з таких нозологій, частота якої за останні роки суттєво збільшилась, є розлади аутистичного спектра (РАС).
РАС — це група порушень розвитку нервової системи, що характеризуються загальними симптомами, пов’язаними з порушеннями соціальної взаємодії, комунікації та поведінки (стереотипність, обмеженість дій та інтересів) [21–23]. Клінічні прояви РАС є численними та різноманітними: порушення комунікації, що утруднюють, а інколи й унеможливлюють процес навчання, порушення мовленнєвого розвитку, неправильне вживання особових займенників, порушення вимовлення звуків і граматичної будови речень, сенсорна гіперсенситивність, гіперселективність, симультанність, труднощі сприйняття явищ, що розгортаються в часі, нерівномірність розвитку психічних функцій [24–26]. Часто спостерігаються стереотипії, що спричиняють аутостимуляцію [24–26]. Недавні дослідження в Азії, Європі та Північній Америці демонструють, що середня поширеність РАС становить 1 % [27]. В Україні захворюваність на РАС з 2006 року постійно зростає. Кількість пацієнтів із РАС, які перебували на обліку, зросла з 662 осіб у 2005 році до 7491 пацієнта на кінець 2017 року [27].
Виникнення РАС пов’язують із віком батьків дитини понад 30 років, зачаттям дитини шляхом екстракорпорального запліднення, лікування жінок протягом року перед настанням вагітності та під час другого та/або третього триместру вагітності антидепресантами (зокрема, інгібіторами зворотного захвату серотоніну) та вальпроатами, впливом несприятливих акушерських чинників, а також шкідливих інфекційних і неінфекційних факторів під час вагітності та пологів [27–31]. Порушення обміну мікроелементів є поширеним явищем, що часто виникає в пацієнтів із РАС. За даними Г.І. Слищук і співавт., обстеженим пацієнтам був притаманний суттєвий дисбаланс есенціальних елементів — зниження вмісту цинку і зростання концентрації міді в організмі. Внаслідок цього змінюється їх природне співвідношення, необхідне для нормального функціонування ферментних систем організму [32]. Найчастішою причиною проблем із нутритивним забезпеченням дітей із РАС макро- та мікроелементами є різноманітні порушення режиму їх харчування. До причин цього можна віднести свідому або мимовільну відмову від тих чи інших продуктів харчування, специфічні дієти (безказеїнова, безглютенова тощо), вплив лікарських препаратів (їх здатність впливати на засвоюваність організмом певних мікроелементів) [32].
За даними Ю.В. Пакулової-Троцької та С.Л. Няньковського, об’єм їжі, яку споживали діти із РАС, відповідав віковим нормам. Водночас її якісний склад не відповідав рекомендаціям для даного віку. Визначався виражений дефіцит тваринних білків, тоді як жири та вуглеводи були у надлишку. Також у більшості обстежених дослідниками дітей із РАС спостерігалась низька калорійність їжі [33].
За останні роки спостерігається прогресивне збільшення кількості дітей з ознаками затримки психомовленнєвого розвитку (ЗПМР). Цій проблемі притаманні ознаки незрілості емоційно-вольової сфери [34]. Порушення розумового розвитку при ЗПМР включають порушення мовлення, недостатність словникового запасу, труднощі розуміння звукової структури слова та неможливість її запам’ятовування, нерозуміння простих інструкцій, нестійкість уваги. Діти із ЗПМР мають труднощі з її концентрацією та фрагментарність сприйняття подразників. У них діагностують порушення зорової, слухової та слухомовленнєвої пам’яті, а також розлади словесно-логічного мислення [34].
Ще однією патологічною нозологією, що призводить до порушень психомоторного розвитку в дітей, є синдром дефіциту уваги з гіперактивністю (СДУГ). СДУГ займає провідні позиції у структурі порушень психомоторного розвитку в дітей. Його поширеність серед дитячого населення у світі коливається від 3 до 8 % [35]. Етіологія СДУГ є складною і включає взаємний вплив генетичних чинників і факторів довкілля. До факторів ризику виникнення СДУГ належать: передчасне народження, низька вага при народженні, затримка внутрішньоутробного розвитку плода, паління матері під час вагітності, вживання медикаментів [36].
Клінічна симптоматика СДУГ включає нездатність дитини утримувати увагу на дрібних деталях, часті помилки через неуважність і необережність, нездатність дитини дотримуватися інструкцій і фокусуватися на заняттях та ігровій діяльності, уникання дитиною завдань, що потребують розумових зусиль [25, 37], часте і легке відволікання дитини на сторонні подразники, забудькуватість, балакучість, ігнорування соціальних обмежень [25, 37].
Значно поширеним через труднощі з об’єктивізацією та відсутність явних клінічних ознак ураження ЦНС є термін «мінімальна мозкова дисфункція» (ММД) [38]. Зростання поширеності ММД серед дитячого населення зумовило збільшення кількості наукових досліджень, присвячених розробленню ефективних і безпечних підходів до корекції мінімальної мозкової дисфункції і СДУГ та їх реабілітації. Частота ММД серед дитячої популяції становить від 2 до 20 %, а за іншими даними — від 10–30 до 50 % [38]. До основних скарг батьків пацієнтів належать порушення поведінки, розгальмованість, підвищена збудливість, імпульсивність, знижений самоконтроль, агресивні прояви щодо однолітків і батьків, порушення уваги, проблеми з її концентрацією, гіперактивність. Серед етіологічних факторів ММД чільне місце належить анте- і перинатальним ураженням центральної нервової системи, а також асоційованим із цим порушенням дозрівання структур головного мозку [38].
Мета дослідження: оцінити стан макро- та мікроелементного забезпечення дітей дошкільного віку з порушеннями психомоторного розвитку, встановивши наявність у них дефіциту макро- та мікроелементів, виявити зв’язок між рівнями макро- та мікроелементів у сироватці крові пацієнтів і наявними в дітей порушеннями психомоторного розвитку.
Матеріали та методи
Проаналізовано результати біохімічного дослідження сироватки крові з визначенням рівнів загального кальцію, магнію та заліза в 30 дітей дошкільного віку (3–7 років; середній вік — 4,10 ± 0,22 року) — пацієнтів неврологічного відділення КНП «Міська дитяча клінічна лікарня м. Львова» та вихованців навчально-розвивального Монтессорі-центру «Сонячний промінчик» з порушеннями психомоторного розвитку (23 хлопчики (76,67 %) та 7 дівчаток (23,33 %)). Забір зразків крові для дослідження проводився на базі неврологічного відділення КНП «Міська дитяча клінічна лікарня м. Львова», дослідження зразків проводилося у Центральній науково-дослідній лабораторії та лабораторії промислової токсикології ЛНМУ імені Данила Галицького, в лабораторних центрах «Сінево», «Ескулаб» та лабораторному центрі клініки «Біокурс». Статистична обробка включала розрахунки з використанням кореляційного та параметричного аналізу. Кореляційний аналіз включав визначення коефіцієнта рангової кореляції Спірмена з визначенням сили та напрямку кореляції для виявлення зв’язку між рівнями макро- та мікроелементів у сироватці крові дітей і наявними в них порушеннями психомоторного розвитку. Вірогідність коефіцієнта рангової кореляції оцінювалася за допомогою розрахунку середньої похибки рангового коефіцієнта кореляції та визначенням критерію вірогідності (t-критерій Стьюдента). Для проведення обрахунків проведено рангування низки отриманих значень рівнів макро- та мікроелементів у сироватці крові за порядком зростання їх значень. Обстежені діти були ранговані за особливостями перебігу в них неврологічної патології (за наявністю в дітей із ЗПМР ознак затримки психомовленнєвого розвитку, затримки психічного розвитку, затримки мовленнєвого розвитку; за наявністю в дітей із РАС порушень мовлення або відсутності мовленнєвих порушень; за наявністю в дітей із СДУГ порушень мовлення або відсутності таких порушень; за наявністю в дітей ознак ММД), згодом визначались відхилення значень рядів та сума їх відхилень, піднесених до квадрату. Отримані значення застосовувались для визначення рангового коефіцієнта кореляції, його середньої похибки та критерію вірогідності (t-критерію Стьюдента) з урахуванням числа ступенів свободи варіаційних рядів для кожного з макро- та мікроелементів. Середні величини подані у вигляді M ± m, де М — середнє значення показника, m — стандартна похибка середнього; n — обсяг аналізованої групи. Для статистичної обробки використана комп’ютерна програма «Біостат». Відмінності між групами пацієнтів вважалися вірогідними при р < 0,05. Дослідження було виконано відповідно до принципів Гельсінської декларації. Протокол дослідження був затверджений Комісією з питань етики наукових досліджень, експериментальних розробок і наукових творів ЛНМУ імені Данила Галицького. На проведення дослідження було отримано інформовану згоду батьків дітей (або їхніх опікунів).
Результати
У дітей проводилося визначення рівнів заліза, загального кальцію та магнію у сироватці крові. В обстежуваній групі спостерігалися такі порушення психомоторного розвитку (рис. 1): затримка психомовленнєвого розвитку — у 16 дітей (53,33 %), із них хлопчиків — 14 (87,5 %), дівчаток — 2 (12,5 %); розлади аутистичного спектра — у 6 дітей (20 %), із них хлопчиків — 4 (66,67 %), дівчаток — 2 (33,33 %); мінімальна мозкова дисфункція — у 4 дітей (13,33 %), із них хлопчиків — 3 (75 %) та одна дівчинка (25 %); синдром дефіциту уваги з гіперактивністю — у 4 дітей (13,33 %), із них хлопчиків — 2 (50 %) та 2 дівчинки (50 %). При дослідженні сироватки крові практично в усіх обстежених був виявлений дефіцит мікро- та макроелементів: у 28 дітей — дефіцит загального кальцію (93,33 %), у 19 дітей — дефіцит магнію (63,33 %), у 6 дітей — дефіцит заліза (20 %). При цьому у 3 дітей (10 %) спостерігався дефіцит усіх досліджуваних елементів, а в однієї дитини (3,33 %) дефіцит досліджуваних елементів був відсутній.
Найпоширенішим дефіцитом у групі дітей із ЗПМР був поєднаний дефіцит загального кальцію та магнію (рис. 2) — у 8 дітей (50 %); у 2 (12,5 %) дітей із цієї групи спостерігався дефіцит всіх трьох мікро- і макроелементів; у 3 дітей (18,75 %) — дефіцит загального кальцію; у 2 дітей спостерігався відповідно дефіцит заліза і поєднаний дефіцит загального кальцію та заліза (по 6,25 % кожен). Ще в однієї дитини (6,25 %) дефіцит досліджуваних мікро- і макроелементів був відсутній.
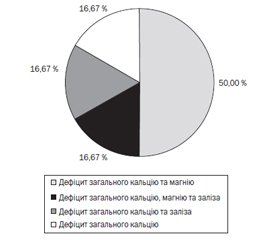
Переважним дефіцитом у дітей із РАС виявився поєднаний дефіцит загального кальцію та магнію, що спостерігався у половині випадків (рис. 3) — у 3 дітей (50 %); у 3 дітей виявлено відповідно дефіцит всіх трьох макро- та мікроелементів, поєднаний дефіцит загального кальцію та заліза і дефіцит загального кальцію (по 16,67 % в кожному випадку).
У групі дітей із ММД у половині випадків спостерігалися поєднаний дефіцит загального кальцію та магнію і дефіцит загального кальцію (по 2 (50 %) в кожному випадку).
Домінуючим дефіцитом у дітей із СДУГ був поєднаний дефіцит загального кальцію та магнію — 3 дітей (75 %), також спостерігався дефіцит загального кальцію — 1 дитина (25 %). Варто також зазначити, що в цієї дитини рівень магнію знаходився на нижніх значеннях норми.
Середній рівень загального кальцію у крові дітей віком 3–5 років становив 1,45 ± 0,11 ммоль/л; у крові дітей віком 6–7 років — 1,42 ± 0,40 ммоль/л; середній рівень загального кальцію у крові хлопчиків — 1,50 ± 0,11 ммоль/л; середній рівень загального кальцію у крові дівчаток — 1,28 ± 0,13 ммоль/л. Середній рівень загального кальцію у крові дітей, в яких спостерігався його знижений вміст, становив 1,38 ± 0,09 ммоль/л.
Середній рівень магнію у крові дітей віком 3–5 років становив 0,67 ± 0,03 ммоль/л; у крові дітей віком 6–7 років — 0,58 ± 0,07 ммоль/л; середній рівень магнію у крові хлопчиків — 0,65 ± 0,04 ммоль/л; середній рівень магнію у крові дівчаток — 0,72 ± 0,04 ммоль/л. Середній рівень магнію у крові дітей, в яких спостерігався його знижений вміст, становив 0,59 ± 0,02 ммоль/л.
Середній рівень заліза у крові дітей віком 3–5 років становив 12,51 ± 0,89 мкмоль/л; у крові дітей віком 6–7 років — 15,43 ± 2,27 мкмоль/л; середній рівень заліза у крові хлопчиків — 12,82 ± 1,06 мкмоль/л; середній рівень заліза у крові дівчаток — 11,46 ± 2,01 мкмоль/л. Середній рівень заліза у крові дітей, в яких спостерігався його знижений вміст, становив 7,91 ± 0,34 мкмоль/л.
При визначенні наявності кореляційного зв’язку між рівнем загального кальцію у сироватці крові дітей і неврологічними порушеннями було встановлено наявність зворотного кореляційного зв’язку середньої сили між рівнем загального кальцію у сироватці крові та наявністю порушень психомоторного розвитку в дітей, даний кореляційний зв’язок є вірогідним (p < 0,01). Кореляційний зв’язок між рівнем магнію у сироватці крові та наявністю порушень психомоторного розвитку в дітей був прямим, слабкої сили, невірогідним (p > 0,05). Водночас було встановлено наявність зворотного кореляційного зв’язку середньої сили між рівнем магнію в сироватці крові та наявністю в дітей синдрому гіперзбудливості, даний кореляційний зв’язок є вірогідним (p < 0,01). Було встановлено наявність зворотного кореляційного зв’язку слабкої сили між рівнем сироваткового заліза у крові дітей і наявністю порушень психомоторного розвитку, даний кореляційний зв’язок не є вірогідним (p > 0,05). Отриманий результат не дозволяє зробити висновок щодо вірогідності обчисленого рангового коефіцієнта кореляції. У цьому випадку доцільним є використання більшої кількості спостережень.
Обговорення
Залізо, кальцій і магній є критично важливими для життєдіяльності людини макро- та мікроелементами, дефіцит яких призводить до виникнення порушень у діяльності органів і систем людського організму, а також перебігу більшості біохімічних процесів у ньому. Порушення мієлінізації нервових волокон і нервово-м’язової провідності, спричинені дефіцитом заліза та загального кальцію, на фоні зниження концентрації заліза у ЦНС призводять до погіршення клінічного перебігу неврологічної патології в дітей дошкільного віку, погіршення їх когнітивних функцій, втрати раніше набутих навичок, виникнення додаткових проблем у навчанні, зокрема через зниження пам’яті, здатності концентрувати та утримувати увагу [3, 9–11, 21–23]. Дефіцит загального кальцію та магнію у крові дітей із порушеннями психомоторного розвитку призводить до порушень нервово-м’язової провідності та скоротливості м’язів (в тому числі гладкої мускулатури внутрішніх органів), зниження їх енергетичного забезпечення, відображаючись клінічно у наростанні симптоматики моторних порушень, розладах функцій шлунково-кишкового тракту, жовчовивідних шляхів, сечовидільної системи та утруднюючи повсякденну навчальну та ігрову діяльність дітей, а також засвоєння ними навичок самообслуговування [3, 9–11, 21–23].
Отримані нами результати є ще одним підтвердженням даних інших досліджень про тісний взаємозв’язок між рівнями кальцію та магнію в організмі людини, зокрема інформації про необхідність нормального рівня магнію для підтримки адекватної концентрації кальцію та запобігання його втраті організмом [16–18]. Низька концентрація магнію в організмі дітей із порушеннями психомоторного розвитку, виявлена в процесі дослідження, клінічно маніфестує порушенням рівноваги між процесами збудження та гальмування в організмі, персистуванням у дітей проявів гіперзбудливості, дратівливості, негативізму, постійного відчуття неспокою та підвищеної тривожності, розладами сну, що призводить до суттєвого порушення якості життя цієї категорії пацієнтів та їх родин, проблем із навчанням і соціальною взаємодією [18].
Наше дослідження виявило наявність негативного впливу на стан дітей дошкільного віку з порушеннями психомоторного розвитку дефіцитів макро- та мікроелементів, зокрема загального кальцію, заліза та магнію, що проявляється в погіршенні клінічної симптоматики основного захворювання та негативному впливі на якість життя дітей та їх родин, проблемах із навчанням та соціальною взаємодією. Не викликає сумніву, однак, потреба у проведенні подальших досліджень із залученням більшого числа учасників для підвищення вірогідності отриманих даних (зокрема, щодо кореляції між неврологічною патологією та рівнем заліза у крові обстежених), попри об’єктивні труднощі та обмеження, що існують на сьогодні через пандемію SARS-CoV-2 та пов’язані з цим обмежувальні заходи.
Висновки
1. У крові практично всіх обстежених дітей дошкільного віку із порушеннями психомоторного розвитку виявлено дефіцит макро- та мікроелементів, а саме загального кальцію, магнію та заліза.
2. Дефіцит макро- та мікроелементів (загального кальцію, магнію, заліза) в організмі дітей дошкільного віку з порушеннями психомоторного розвитку проявляється у погіршенні клінічної симптоматики основного захворювання та негативному впливі на якість життя дітей та їх родин, проблемах із навчанням та соціальною взаємодією. Серед обстежених дітей переважав дефіцит загального кальцію та магнію, що підтверджує дані багатьох досліджень. Найпоширенішим дефіцитом практично в усіх підгрупах обстежених дітей виявився поєднаний дефіцит загального кальцію та магнію. Лише в підгрупі ММД у 50 % випадків спостерігався поєднаний дефіцит загального кальцію та магнію, а ще у 50 % — ізольований дефіцит загального кальцію.
3. Було встановлено наявність вірогідного зворотного кореляційного зв’язку середньої сили між рівнем загального кальцію в сироватці крові та наявністю порушень психомоторного розвитку в дітей. Під час проведення дослідження було виявлено слабкий прямий невірогідний кореляційний зв’язок між рівнем магнію в сироватці крові та наявністю порушень психомоторного розвитку в дітей. Водночас виявлено вірогідний зворотний кореляційний зв’язок середньої сили між рівнем магнію в сироватці крові та наявністю в дітей синдрому гіперзбудливості, що також корелює з літературними даними. Між рівнем сироваткового заліза у крові дітей і наявністю порушень психомоторного розвитку вдалося верифікувати зворотний кореляційний зв’язок слабкої сили. Однак цим даним поки що бракує вірогідності через порівняно невелику кількість обстежених.
4. Не викликає сумніву потреба у проведенні подальших досліджень із залученням більшого числа учасників для підвищення вірогідності отриманих даних.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про внесок кожного автора: Няньковський С.Л. — концепція і дизайн дослідження, редагування тексту статті; Пишник А.І. — збирання й обробка матеріалів, аналіз отриманих даних, написання тексту; Куксенко О.В. — збирання й обробка матеріалів; Грушка О.І. — проведення біохімічного дослідження зразків крові.
Отримано/Received 11.09.2021
Рецензовано/Revised 28.09.2021
Прийнято до друку/Accepted 04.10.2021
Список литературы
1. Няньковський С.Л., Пасічнюк І.П. Оцінка нутритивного статусу школярів 1–11-х класів міста Львова. Здоровье ребенка. 2016. № 6(74). С. 45-49. doi: 10.22141/2224-0551.6.74.2016.82130.
2. Nutrition and the developing brain. Hall Moran V., Lowe N.M., eds. Oakville: CRC Press, 2016. 265 p.
3. Шадрін О.Г., Гайдучик Г.А. Проблемні питання харчування дітей раннього віку та шляхи їх вирішення. Современная педиатрия. 2016. № 3(75). С. 110-114. doi: 10.15574/SP.2016.75.110.
4. Wachs T.D., Georgieff M., Cusick S., McEwen B.S. Issues in the timing of integrated early interventions: contributions from nutrition, neuroscience, and psychological research. Ann. N. Y. Acad. Sci. 2014. № 1308 (1). P. 89-106. doi: 10.1111/nyas.12314. PMID: 24354763. PMCID: PMC4075015.
5. De Onis M. Child growth and development. Nutrition and health in a developing world. 3d ed. De Pee S., Taren D., Bloem M.W., eds. New York: Humana Press, Cham, 2017. 828 p.
6. Bhutta Z.A., Guerrant R.L., Nelson C.A. Neurodevelopment, nutrition, and inflammation: the evolving global child health landscape. Pediatrics. 2017. № 139(suppl. 1). S12-22. doi: 10.1542/peds.2016-2828D.
7. Prado E.L., Dewey K.G. Nutrition and brain development in early life. Nutrition Reviews. 2014. № 72(4). P. 267-284. doi: 10.1111/nure.12102.
8. Бережной В.В. Влияние витаминно-минерального обеспечения на рост и развитие детей. Современные способы коррекции витаминодефицитов. Современная педиатрия. 2018. № 3(91). С. 133-137.
9. Маменко М.Є. Використання комплексів мікронутрієнтів у педіатрії: користь та потенційні ризики. Современная педиатрия. 2016. № 2(74). С. 15-21. doi: 10.15574/SP.2016.74.15.
10. Schipper A.L. Dietary lipid quality, environment and the developing brain. Groningen: Rijksuniversiteit Groningen, 2018. 250 p.
11. Nyaradi A., Li J., Hickling S., Foster J., Oddy W.H. The role of nutrition in children’s neurocognitive development, from pregnancy through childhood. Front. Hum. Neurosci. 2013. № 7(97). P. 1-16. doi: 10.3389/fnhum.2013.00097. PMCID: PMC3607807. PMID: 23532379.
12. Няньковський С.Л., Шадрін О.Г., Знаменська Т.К., Бекетова Г.В., Івахненко О.С., Яцула М.С. Щодо впровадження концепції «Харчування нового життя. 1000 днів» в Україні. Здоровье ребенка. 2014. № 5(56). С. 73-77.
13. Про затвердження Норм фізіологічних потреб населення України в основних харчових речовинах і енергії: Наказ Міністерства охорони здоров’я України від 02.10.2017 № 1073.
14. Банадига Н.В., Рогальська Я.В., Рогальський І.О. Вплив залізодефіцитної анемії у дітей на формування системного імунітету. Современная педиатрия. 2014. № 3(59). С. 40-43. doi: 10.15574/SP.2014.59.40.
15. Марушко Ю.В. Мікроелементи та стан імунітету у дітей. Актуальна інфектологія. 2013. № 1(1). С. 49-52.
16. Білко Т.М. Значення кальцію в метаболічних процесах організму та шляхи подолання його дефіциту. Журнал української медичної еліти. Антиейджинг. 2013. № 3(33). С. 30-34.
17. Марушко Ю.В., Гищак Т.В. Магній та його значення для дитячого організму. Дитячий лікар. 2013. № 1(22). С. 9-13.
18. Марушко Ю.В., Гищак Т.В. Обґрунтування використання препаратів магнію в педіатричній практиці (огляд літератури). Современная педиатрия. 2016. № 6(78). С. 27-32. doi: 10.15574/SP.2016.78.27.
19. Сімко А.В. Особливості діагностики та корекції психомоторного розвитку дошкільників з інтелектуальними порушеннями на заняттях фізичного виховання. Актуальні проблеми корекційної освіти. 2018. № 12. С. 234-245. doi: 10.32626 /2413-2578.2018-12.234-245
20. Emerson E., Brigham P. Exposure of children with developmental delay to social determinants of poor health: cross-sectional case record review study. Child Care Health Dev. 2015. № 41(2). P. 249-257. doi: 10.1111/cch.12144. PMID: 24797435.
21. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації «Розлади аутистичного спектра (розлади загального розвитку)»: Наказ Міністерства охорони здоров’я України від 15.06.2015 № 341.
22. Марценковський І.А., Марценковська І.І. Розлади аутистичного спектра: фактори ризику, особливості діагностики й терапії. Міжнародний неврологічний журнал. 2018. № 4(98). С. 75-83. doi: 10.22141/2224-0713.4.98.2018.139429.
23. Sharma S.R., Gonda X., Tarazi F. Autism Spectrum Disorder: Classification, diagnosis and therapy. Pharmacol. Ther. 2018. № 190. P. 91-104. doi: 10.1016/j.pharmthera.2018.05.007. PMID: 29763648.
24. Кирилова Л.Г., Мірошников О.О., Грабовенська І.О. Розлади аутистичного спектра як ранні порушення нейророзвитку в дітей. Журнал неврології ім. Б.М. Маньковського. 2017. № 5(1). С. 71-78.
25. De Rubeis S., Buxbaum J.D. Genetics and genomics of autism spectrum disorder: embracing complexity. Hum. Mol. Genet. 2015. № 24(R1). R. 24-31. doi: 10.1093/hmg/ddv273. PMID: 26188008. –PMCID: PMC4675826.
26. Гальчин К.С. Особливості клінічних проявів атипового аутизму у дітей. Вісник морфології. 2015. Т. 21. № 1. С. 141-145.
27. Гречанина Ю.В., Белецкая С.В. Литературный обзор по аутизму. Клінічна генетика і перинатальна діагностика. 2013. № 1. С. 119-145.
28. Синопсис діагностичних критеріїв DSM-V та протоколів NICE для діагностики та лікування основних психічних розладів у дітей та підлітків: Пер. з англ.; упор. та наук. ред. Л. Підлісецька. Серія «Психологія. Психіатрія. Психотерапія». Львів: Видавництво Українського католицького університету, 2014. 112 с.
29. Cassimos D.C., Syriopoulou-Delli C.K., Tripsianis G.I., Tsikoulas I. Perinatal and parental risk factors in an epidemiological study of children with autism spectrum disorder. International Journal of Developmental Disabilities. 2015. Vol. 62. № 2. P. 108-116. doi: 10.1179/2047387715y.0000000004.
30. Boukhris T., Sheehy O., Mottron L., Berard A. Antidepressant use during pregnancy and the risk of autism spectrum disorder in children. JAMA Pediatr. 2016. № 170(2). P. 117-124. doi: 10.1001/jamapediatrics.2015.3356. PMID: 26660917.
31. Пыхтеева Е.Г., Большой Д.В. Токсичные и эссенциальные микроэлементы в биосубстратах детей при заболеваниях аутистического спектра: обзор литературы и данные собственных исследований. Актуальные проблемы транспортной медицины. 2015. № 2(40). С. 14-22.
32. Слищук Г.И., Пыхтеева Е.Г., Большой Д.В., Борисова О.В., Бахчеван Е.Л., Шафран Л.М. К вопросу о диагностике расстройств аутистического спектра у детей в Одесской области. Актуальные проблемы транспортной медицины. 2017. № 2(48). С. 10-17.
33. Пакулова-Троцька Ю.В., Няньковський С.Л. Проблеми соматичної патології у дітей з розладами аутистичного спектру. Здоровье ребенка. 2016. № 1(69). С. 63-67.
34. Померанцева Т.І., Скоробагатова О.В. Характеристика клініко-нейропсихологічного поліморфізму дітей з затримкою психомовного розвитку. Сучасні підходи до діагностики та лікування захворювань нервової системи у дітей: матеріали наук.-практ. конф. Український вісник психоневрології (м. Харків, 19–20 вер. 2020 р.). Харків, 2020. Т. 27. № 3. С. 102.
35. Masi L., Gignac M. ADHD and comorbid disorders in childhood psychiatric problems, medical problems, learning disorders and developmental coordination disorder. Clinical Psychiatry. 2015. Vol. 1. № 1, 5. P. 1-9. doi: 10.21767/2471-9854.100005.
36. Instanes J.T., Halmoy A., Engeland A., Haavik J., Furu K., Klungsoyr K. Attention-deficit/hyperactivity disorder in offspring of mothers with inflammatory and immune system diseases. Biol. Psychiatry. 2017. № 81(5). P. 452-459. doi: 10.1016/j.biopsych.2015.11.024. PMID: 26809250.
37. Маменко М.Е. Синдром дефицита внимания и гиперактивности у детей: современные взгляды на этиологию, патогенез, подходы к корекции. Здоровье ребенка. 2015. № 5(56). С. 7-13.
38. Танцура Л.М., Пилипець О.Ю., Третьяков Д.В., Трембовецька О.В. Механізми формування, підходи до ранньої діагностики та корекції мінімальної мозкової дисфункції у дітей. Медичний форум. 2016. № 7(07). С. 177-181.
/45.jpg)

/41.jpg)
/44.jpg)