Журнал «Медицина неотложных состояний» Том 17, №8, 2021
Вернуться к номеру
Порушення натрієвого балансу у хворих з ураженням гіпоталамо-гіпофізарної ділянки при черепно-мозковій травмі
Авторы: Ільчишин О.Я., Підгірний Я.М.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
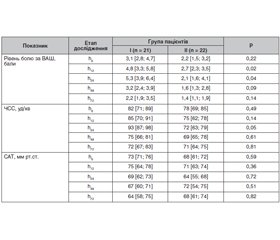
Актуальність. Черепно-мозкова травма (ЧМТ) до цього часу залишається провідною причиною смерті людей працездатного віку. В Україні частота ЧМТ щорічно становить у різних регіонах від 2,3 до 6 випадків (у середньому 4–4,2) на 1000 населення. Пацієнти з первинним ураженням головного мозку і гіпоталамо-гіпофізарної системи становлять групу ризику з розвитку набряку головного мозку через виникнення у них порушення водно-електролітної рівноваги та відповідно порушення рівноваги осмолярності між клітинним та позаклітинним простором. Порушення водно-електролітного балансу як наслідок ураження гіпоталамо-гіпофізарної системи при ЧМТ в літературі висвітлено недостатньо. Мало вивчені особливості функціонування центральних та периферичних ланцюжків ендокринної системи залежно від локалізації, характеру і тяжкості травми. Недостатньо вивчене питання про діагностичні та прогностичні цінності різних показників волемічного статусу у хворих із ЧМТ. Мета: вивчити види дизнатріємії у хворих з ізольованою ЧМТ і ураженням гіпоталамо-гіпофізарної ділянки головного мозку; вияснити вплив виду порушення натрієвого балансу на летальність у хворих із ЧМТ та ураженням гіпоталамо-гіпофізарної ділянки головного мозку. Матеріали та методи. Нами було обстежено 74 пацієнтів (чоловіків/жінок = 60/14) із вогнищевим забоєм головного мозку й ураженням гіпоталамічної ділянки. Серед 74 хворих з ізольованою ЧМТ і ураженням гіпоталамо-гіпофізарної ділянки головного мозку в 47 хворих було діагностовано гіповолемію, що поєднувалась з гіпонатріємією. У 15 хворих було виявлено гіпернатріємію з гіперволемією. Моніторинг внутрішньочерепного тиску здійснювали за допомогою поліфункціонального монітора (Monitor Model BSM-3562 (Nihon Konden Corporation, Японія, 2018)) із лінією для інвазивного вимірювання тиску. Постійне неінвазивне вимірювання оксигенації тканин органів (rSO2) проводили на моніторі Somanetics Invos Oximeter Cerebral/Somatik (Covidien, Mansfield, MA, США, 2020). В усіх хворих визначали рівень електролітів плазми крові. Висновки. У хворих із ЧМТ і ураженням гіпоталамо-гіпофізарної системи виникають різнонаправлені зміни водно-натрієвого балансу, що вимагають диференційованого підходу до їх лікування. Зважаючи на невелику кількість спостережень, ми не наважуємося пов’язувати вид дизнатріємії у хворих із ЧМТ і ураженням гіпоталамо-гіпофізарної ділянки головного мозку з летальністю. Вважаємо за доцільне продовжувати дослідження в цьому напрямку.
Background. Traumatic brain injury (TBI) still remains the leading cause of death in people of working age. In Ukraine, the frequency of TBI varies from 2.3 to 6 cases (average of 4–4.2) per 1,000 population annually depending on the regions. Patients with primary damage to the brain and hypothalamic-pituitary system are at risk of developing cerebral edema due to the water-electrolyte imbalance and, accordingly, osmolar imbalance between cellular and extracellular spaces. Water-electrolyte imbalance as a result of damage to the hypothalamic-pituitary system in traumatic brain injury is not described enough in the literature. The functioning of the central and peripheral links of the endocrine system depending on the location, nature and severity of injury is examined not enough. The question of diagnostic and prognostic values of various indicators of volume status in patients with trauma is also underinvestigated. The purpose of this study was to examine the types of disorders of sodium balance in patients with isolated TBI and hypothalamic-pituitary lesions; to clarify the influence of sodium imbalance type on mortality in patients with TBI and hypothalamic-pituitary lesions. Material and methods. We examined 74 patients (men/women = 60/14) with focal cerebral contusion and lesions of the hypothalamic region. Forty-seven of them were diagnosed with hypovolemia combined with hyponatremia. Hypernatremia with hypervolemia was found in 15 patients. Intracranial pressure monitoring was performed using a multifunction monitor (BSM-3562, Japan, 2018, Nihon Kohden Corporation) with a line for invasive pressure measurement. Continuous non-invasive measurement of organ tissue oxygenation (rSO2) was carried out using Somanetics Invos Oximeter Cerebral/Somatic monitor (Covidien, Mansfield, MA, USA, 2020). Plasma electrolytes were evaluated in all patients. Conclusions. Patients with TBI and hypothalamic-pituitary lesion have different types of water-sodium imbalance, which demand the differentiated approach to their treatment. Given the small number of observations, we do not dare to link the type of sodium imbalance with lethality in patients with brain trauma and hypothalamic-pituitary lesions. We consider this requires further researches.
черепно-мозкова травма; ушкодження діенцефальної ділянки головного мозку; рідинний статус пацієнта; інтенсивна терапія
traumatic brain injury; diencephalic injury; volume status of a patient; intensive care
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Педаченко Є.Г., Каджая Н.В., Шлапак І.П., Пилипенко М.М., Лісянський М.С., Чепкий Л.П. та ін. Сучасні принципи діагностики та лікування хворих із невідкладною нейрохірургічною патологією (черепно-мозкова травма). Методичні рекомендації. Київ, 2005. 48 с.
- Савин И.А., Горячев А.С. Водно-электролитные нарушения в нейрореанимации. Москва: НИИ нейрохирургии им. акад. Н.Н. Бурденко, 2015. 274 с.
- Зозуля І.С., Боброва В.І., Рощин Г.Г. Медицина невідкладних станів. Екстрена (швидка) медична допомога: підручник / за ред. І.С. Зозулі. 3-тє видання, переробл. та доповн. Київ: ВСВ «Медицина», 2017. 960 с.
- Шевага В.М., Нетлюх А.М., Паєнок А.В., Задорожна Б.В. Нейрохірургія: підручник. 2-ге вид. Львів: ПП «Кварт», 2016. 206 с.
- Шкробот С.І., Салій З.В., Бударна О.Ю. Топічна діагностика патології нервової системи. Алгоритми діагностичного пошуку. Тернопіль: Укрмедкнига, 2018. 156 с.
- Яворська Н.П. Топічна діагностика в неврології. Львів: ЛНМУ, 2015. 254 с.
- Триумфов А.В. Топическая диагностика заболеваний нервной системы. 18-е изд. М.: МЕДпресс-информ, 2014. 264 с.
- Трошин В.Д., Погодина Т.Г. Неотложная неврология: рук-во. 3-е изд., перераб. и доп. М.: Медицинское информационное агентство, 2016. 584 с.
- Поліщук М.Є., Галушко О.А., Гуменюк М.І., Тріщинська М.А. Інфузійна терапія в неврології і нейрохірургії. К.: Книга-плюс, 2020. 256 с.
- Савин И.А., Фокин М.С., Любнин А.Ю. Рекомендации по интенсивной терапии у пациентов с нейрохирургической патологией (пособие для врачей). М.: ООО «ИПК «Индиго», 2006. 225 с.
- Крылов В.В. Нейрореаниматология: практическое руководство. М.: ГЭОТАР-Медиа, 2017. 176 с. (Серия «Библиотека врача-специалиста») ISBN 978-5-9704-4369-9. Режим доступу: http://www.rosmedlib.ru/book/ ISBN9785970443699.html
- Власов О.О. Сучасний досвід проведення церебральної оксиметрії в неонатології: літературний огляд. КП «Дніпропетровська обласна дитяча клінічна лікарня».
- Taylor C.A., Bell J.M., Breiding M.J., Xu L. Traumatic Brain Injury-Related Emergency Department Visits, Hospitalizations, and Deaths — United States, 2007 and 2013. Morbidity and mortality weekly report. Surveillance summaries (Washington, D.C.: 2002). 2017. 66(9). 1-16. https://doi.org/10.15585/mmwr.ss6609al
- Probst C., Pape H.C., Hildebrand F., Regel C., Mahlke L., Giannoudis P., Krettek C., Grotz M.R. 30 yers of polytrauma care: An analysis of the change in strategies and results of 4849 cases treated ata single institution. Injury. 2009. 40(1). 77-83. https://doi.org/10.1016/j.injury. 2008.10.004
- Banerjee M., Bouillon B., Shafizadeh S., Paffrath T., Lefering R., Wafaisade A., German Trauma Registry Group. Epidemiology of extremity injuries in multiple trauma patients. Injury. 2013. 44(8). 1015-1021. https://doi.org/10.1016/j.injury.2012.12.007
- Advanced Trauma Life Support (ATLS) of the American College of Surgeons (ACS), Committee on Trauma. 10th Edition. 2018. 2-420.
- Teasdale G., Jennet B. Assessment of coma and impaired consciousness. A practical scale. Lancet (London, England). 1974. 2(7872). 81-84. https://doi.org/10.101/s0140-6736(74)91639-0
- Rogatkin D.A. Fizicheskie osnovy opticheskoj oksimetrii [Physical foundations of optical oximetry]. Med. Fizika-Medical Physics. 2012. 2. 97-114. Retrieved from https:// www.elibrary.ru/item.asp?id=17797306
- McCormick P.W., Stewart M., Goetting M.G., Dujovny M., Lewis G., Ausman J.I. Noninvasive cerebral optical spectroscopy for monitoring cerebral oxygen delivery and hemodynamics. Crit. Care Med. 1991. 19(1). 89-97. doi: 10.1097/ 00003246-199101000-00020.
- Sood B.G., McLaughlin K., Cortez J. Near-infrared spectroscopy: Applications in neonates. Seminars in Fetal and Neonatal Medicine. 2015. 20(3). 164-172. doi: 10.1016/ j.siny.2015.03.008.

/68.jpg)