Резюме
Описаний клінічний випадок 12-річної дитини з остеосаркомою лівої малогомілкової кістки, Т1N0M0G3, яка отримувала лікування високодозовим метотрексатом 12 г/м2. Внаслідок затримки елімінації метотрексату в дівчинки розвинулась гостра печінкова недостатність. У пацієнтки рівень АЛТ підвищувався до 4790 Од/л, АСТ — до 4320 Од/л, що свідчить про загрозливе для життя гостре ураження печінки. При цьому не відмічалися коагулопатія, значне підвищення рівня білірубіну та печінкова енцефалопатія. Повній картині гострої печінкової недостатності вдалося запобігти завдяки своєчасному застосуванню еферентної терапії. Пацієнтка отримувала внутрішньовенну гідратаційну терапію та олужнення сечі в об’ємі 3000 мл/м2/добу розчинами 5% глюкози в комбінації з 20 ммоль NaHCO3/л та 20 ммоль розчину KCl/л. При цьому діурез пацієнтки становив більше ніж 600 мл/м2/6 годин. Крім того, застосовувалась антидотна терапія кальцію фолінатом. У даному випадку ми використали тривалу вено-венозну гемодіафільтрацію апаратом Prismaflex. Після першого проведеного сеансу, що тривав протягом 78 годин, відмічалось повторне зростання концентрації метотрексату в крові та збільшення рівнів АЛТ, АСТ, що свідчить про великий об’єм розподілу метотрексату та потребу в тривалій терапії екстракорпоральними методами. Тому сеанс тривалої вено-венозної гемодіафільтрації був продовжений. Після ще 78 годин проведення тривалої вено-венозної гемодіафільтрації відмічались відсутність повторного зростання показників рівня метотрексату в крові та нормалізація рівнів трансаміназ та загального білірубіну. Додатково в пацієнтки були досліджені рівень гомоцистеїну на предмет гіпергомоцистеїнемії, а також 4 гени, які також визначають схильність до гіпергомоцистеїнемії, — метилентетрагідрофолат редуктаза MTHFR C677T, A1298C, метіонін синтетаза MTRR та MTR. Підвищений рівень гомоцистеїну, а також гетерозиготність даних генів свідчать про сповільнення виведення метотрексату або про повну затримку його виведення. У даному випадку результати даних досліджень були негативними. Висновки. Даний клінічний випадок свідчить про ефективність застосування тривалої вено-венозної гемодіафільтрації в комбінації з внутрішньовенною гідратацією, олужненням сечі та антидотною терапією при токсичному впливі на печінку високодозового метотрексату на тлі уповільненої екскреції.
The article considers a clinical case of a 12-year-old child with osteosarcoma of the left tibia, T1N0M0G3, treated with high-dose methotrexate 12 g/m2. As a result of delayed elimination of methotrexate, the patient developed acute liver failure. The ALT level increased to 4790 U/L, AST — to 4320 U/L, which indicates life-threatening acute liver damage. There was no coagulopathy, significant increase in bilirubin, and hepatic encephalopathy. The timely use of efferent therapy allowed avoiding the complete course of acute liver failure. The patient received intravenous hydration therapy and urine alkalinization with 3000 ml/m2/day of 5% glucose in combination with 20 μmol NaHCO3/L and 20 μmol KCl/L. The urine output was more than 600 ml/m2/6 hours. Additionally, antidote therapy with calcium folinate was administered. In this case, we used continuous venous-venous hemodiafiltration using Prismaflex. After the first session, which lasted for 78 hours, there was a re-increase in serum methotrexate concentration and ALT, AST levels, which indicates a large volume of distribution of methotrexate and the need for long-term extracorporeal therapy. Therefore, the second session of continuous venous-venous hemodiafiltration was provided. After the second session, there was no re-increase in methotrexate level in the blood and the transaminases and total bilirubin returned to normal levels. Additionally, the patient was tested for homocysteine levels for hyperhomocysteinemia, as well as 4 genes that also determine the predisposition to hyperhomocysteinemia — methylenetetrahydrofolate reductase gene MTHFR C677T, A1298C, methionine synthase MTRR, and MTR. The presence of elevated levels of homocysteine, as well as heterozygosity of these genes, indicate a slow excretion of methotrexate or a complete delay in its excretion. Our patient presented the negative results of these tests. Conclusions. This clinical case indicates the effectiveness of continuous venous-venous hemodiafiltration in combination with intravenous hydration, urine alkalinization, and antidote therapy in the treatment of hepatotoxicity of high-dose methotrexate on the background of delayed excretion.
Вступ
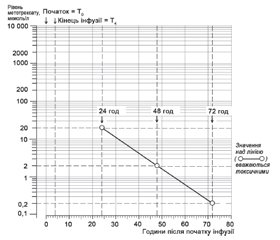
Метотрексат — це антагоніст фолієвої кислоти, що застосовується в лікуванні багатьох хвороб, таких як онкологічні хвороби, артрити різної етіології, псоріаз, запальні захворювання кишечника, системний червоний вовчак, та після трансплантації органів [1]. Метотрексат у високих дозах використовується для лікування остеосаркоми в поєднанні з цисплатином, доксорубіцином та іфосфамідом. Високі дози метотрексату зазвичай вводять впродовж 4–6 годин для отримання пікових значень > 1,000 моль/л, які вважаються достатніми для позитивних ефектів лікування. Під час введення метотрексату у високих дозах пацієнти повинні отримувати агресивну терапію, що включає внутрішньовенну гідратацію та олужнення сечі для запобігання побічним ефектам. Високий рівень метотрексату в крові зазвичай добре переноситься протягом короткого періоду. Однак токсичність може виникнути після постійного впливу високих або низьких рівнів метотрексату. Тому терапію лейковорином (відновлена форма фолієвої кислоти) зазвичай вводять внутрішньовенно через 24 години після початку лікування метотрексатом, поки концентрація метотрексату в сироватці крові не знизиться до 0,05 мкмоль/л. Пацієнти мають високий ризик розвитку токсичності, якщо концентрація метотрексату в крові ≥ 10, ≥ 1 або ≥ 0,1 мкмоль/л через 24, 48 та 72 години після введення відповідно. Основними токсичними ефектами метотрексату є пригнічення функціонування кісткового мозку, мукозит ротової порожнини, підвищення рівня печінкових ферментів та гостре ураження нирок. Ретельний моніторинг концентрацій метотрексату в плазмі може дати змогу своєчасно розпізнати затримку його виведення та запобігти розвитку токсичності [2]. Метотрексат метаболізується в печінці і виводиться нирками. Незважаючи на це, гостре ушкодження нирок розвивається у 2–12 % пацієнтів, що призводить до затримки виведення препарату та підвищення рівня метотрексату в крові [1, 3].
Клінічний випадок
Нижче наводимо власний клінічний випадок дитини з діагнозом: остеосаркома лівої малогомілкової кістки. Стан після біопсії Т1N0M0G3. Стадія 2А. Локальна форма. Стан після хіміотерапії. Гепатотоксичність 4-ї ст. Порушення екскреції метотрексату. Дівчинка А., 12 років, надійшла у відділення анестезіології та інтенсивної терапії Західноукраїнського спеціалізованого дитячого медичного центру у зв’язку з розвитком токсичної дії метотрексату внаслідок лікування основного захворювання високодозовим метотрексатом 12 г/м2 та затримкою його виведення з організму, що спричинило розвиток гострої печінкової недостатності.
З анамнезу: первинними скаргами дитини були біль та обмеження рухів у лівій гомілці, із приводу чого була консультована ортопедом-травматологом. Проведене КТ-обстеження лівого гомілковостопного суглоба з контрастуванням: у нижній третині малогомілкової кістки на рівні метафіза без поширення на зону росту візуалізується деструктивний процес зі спікулоподібними контурами та вираженим м’якотканинним компонентом розміром 19 × 17 мм, протяжністю до 32 мм. Кортикальний шар зруйнований, гетерогенної структури. Проведена КТ органів грудної порожнини з контрастуванням: картина характерна для одиноких вогнищ по ходу міжчасткової плеври в правій легені. Проведене МРТ-обстеження з контрастуванням гомілковостопного та підтаранного суглобів: на рівні н/3 діафізу та метаепіфіза малогомілкової кістки субперіо-стально по передньолатеральній поверхні візуалізується неправильної форми негомогенне солідне утворення з нерівним контуром, розміром 20 × 20 × 37 мм. При довенному контрастуванні утворення підсилено накопичує контраст по периферії. Патогістологічне дослідження: морфологія процесу відповідає хондробластичній остеосаркомі.
У лікуванні запропоноване проведення шести блоків ад’ювантної хіміотерапії згідно з міжнародним протоколом (SSG XIV. A Scandinavian treatment research protocol for extremity localized high-grade osteosarcoma) [4] та затвердженим локальним протоколом із наступною оцінкою доцільності вторинного оперативного втручання. Метою лікування є запобігання повторному росту пухлини та метастазуванню. Проведений перший блок високодозового метотрексату 12 г/м2. Здійснення хіміотерапії ускладнилось токсичністю 3–4-го ступеня. Екскреція метотрексату сповільнена. У контрольній точці визначили рівень метотрексату в крові через 24 години з початку інфузії — рівень становить 92,026 мкмоль/л, що в 4,5 раза перевищує очікуваний показник (рис. 1).
/97.jpg)
На момент надходження у відділення анестезії та інтенсивної терапії стан дитини тяжкий. Перебувала у свідомості. Шкіра чиста, блідо-рожева, із субіктеричним відтінком. Дихальна система: дихання самостійне, адекватне. Аускультативно над легенями жорстке дихання, симетричне, частота дихання — 18/хв, SpO2 — 98 %. Серцево-судинна система: тони серця гучні, ритмічні. Гемодинаміка компенсована, частота серцевих скорочень — 80/хв, артеріальний тиск — 110/80 мм рт.ст. Травна система: живіт м’який, перистальтика вислуховується. Наявні скарги на біль у гіпогастрії справа, інтенсивність болю — 2–3 бали за візуально-аналоговою шкалою.
Динаміка рівня метотрексату на етапах лікування наведена на рис. 1, динаміка рівня АЛТ та АСТ у крові — на рис. 2. Лабораторні показники на початок терапії високодозовим метотрексатом були в межах норми. Через 24 години після проведення інфузії метотрексату спостерігалось значне зростання рівня трансаміназ та загального білірубіну — 33,0 мкмоль/л (1-й етап лікування).
/98.jpg)
Окрім антидотної терапії кальцію фолінатом, внутрішньовенної гідратаційної терапії й олужнення сечі, методом вибору щодо виведення метотрексату з крові є екстракорпоральні методи детоксикації. Ми обрали проведення вено-венозної гемодіафільтрації апаратом Prismaflex. Для здійснення даної терапії пацієнтці було встановлено двопросвітний центральний венозний катетер у праву стегнову вену, оскільки у правій яремній вені знаходився венозний PORT-катетер. На 2-му етапі лікування розпочато: в/в введення кальцію фолінату в дозуванні 40 мг кожні 3 години (корекція дозування залежала від динаміки зниження рівня метотрексату), в/в гідратаційна терапія в об’ємі 4500 мл на добу та олужнення сечі за допомогою в/в інфузії розчину NaHCO3 4% (дозування коригувалось для досягнення рН сечі > 7,0). На фоні даного лікування не спостерігалось динаміки щодо зниження показників трансаміназ, що свідчить про потребу приєднання екстракорпоральних методів лікування. На 3-му етапі лікування пацієнтки розпочалось проведення вено-венозної гемодіафільтрації (28 годин після інфузії метотрексату) апаратом Prismaflex. Стан дитини стабільний. Через 3 години проведення еферентної терапії рівень метотрексату в крові становив 45,936 мкмоль/л. 4-й етап (за 24 години від початку проведення вено-венозної гемодіафільтрації) характеризувався стабільним станом пацієнтки. Параклінічно спостерігається зниження рівня трансаміназ та метотрексату, загальний білірубін — 42,2 мкмоль/л. Через 48 годин після початку еферентної терапії (5-й етап) спостерігалась подальше зниження рівнів трансаміназ та рівня метотрексату, загальний білірубін — 28,2 мкмоль/л. Протягом 72 годин від початку проведення вено-венозної гемодіафільтрації сеанс було в плановому порядку припинено. Вирішено відтермінувати проведення наступного сеансу до визначення рівня трансаміназ та метотрексату в крові. На 6-му етапі лікування (через 8 годин від закінчення першого сеансу еферентної терапії) з урахуванням зростання показників трансаміназ, білірубіну та метотрексату в крові вирішено продовжити проведення вено-венозної гемодіафільтрації. 7-й етап лікування тривав протягом 24 годин від початку проведення другого сеансу еферентної терапії та характеризувався поступовим зниженням основних параклінічних показників. Через 48 години від початку проведення другого сеансу еферентної терапії (8-й етап) стан пацієнтки стабільний та наявна подальша позитивна динаміка в лабораторних показниках. На 9-му етапі (через 72 години від початку проведення другого сеансу еферентної терапії) стан пацієнтки залишається стабільним. У плановому порядку припинено проведення сеансу вено-венозної гемодіафільтрації. Вирішено відтермінувати проведення наступного сеансу еферентної терапії до визначення динаміки лабораторних показників. Протягом наступних трьох діб після завершення проведення терапії апаратом Prismaflex (10-й та 11-й етапи лікування) стан пацієнтки з позитивною динамікою. Клінічно спостерігається покращення загального стану, апетиту та фізичної активності, а також відмічається динаміка щодо нормалізації параклінічних показників. У подальшому пацієнтка була переведена в хірургічне відділення для продовження подальшої планової хіміотерапії, що виключала використання метотрексату.
/98_2.jpg)
Обговорення
Терапія високодозовим метотрексатом вважається одним із найбільш ефективних методів хіміотерапії при лікуванні остеосарком, оскільки він діє під час S-фази клітинного циклу і конкурентно інгібує фермент дигідрофолатредуктазу, запобігаючи таким чином відновленню дигідрофолату до тетрагідрофолату, що є необхідним для синтезу ДНК та реплікації клітин. Активно проліферуючі тканини, такі як злоякісні новоутворення, кістковий мозок, фетальні клітини, слизова оболонка ротової порожнини і кишечника, клітини сечового міхура, зазвичай більш чутливі до метотрексату. Оскільки проліферація злоякісних тканин швидша за нормальну, метотрексат може порушувати їх розвиток, не завдаючи необоротної шкоди здоровим тканинам [1, 5]. Незважаючи на це, метотрексат є дуже цитотоксичним і має численні потенційні несприятливі ускладнення, включаючи мукозит та мієлосупресію, а також токсичність для нирок та печінки. Після введення 90 % метотрексату виводиться із сечею у незміненому вигляді протягом 48 годин. Виявлено два метаболіти метотрексату: 7-гідроксиметотрексат (7-ОН-МТХ) та 2,4-діаміно-N10-метилптероєву кислоту (DAMPA). Приблизно 10 % метотрексату перетворюється в 7-ОН-МТХ печінковою альдегідоксидазою. Згідно з дослідженнями та публікаціями, найбільш поширеним ускладненням при терапії високодозовим метотрексатом є гостре ураження нирок (2–12 %) [5, 6]. Для лікування гострого ушкодження нирок на тлі введення високих доз та затримки елімінації метотрексату останнім часом успішно застосовується рекомбінантний бактеріальний ензим — глюкарпідаза [6]. Проте інформації про розвиток гострої печінкової недостатності при даній терапії остеосарком дуже мало. У дослідженні M.R. Wilson et al. [3] при застосуванні високодозової терапії метотрексатом для лікування лімфоми гостре ушкодження нирок виникало в 5 % пацієнтів, гостре ушкодження печінки — у 2 % пацієнтів та мукозити та нейтропенічна гарячка — у 7 % пацієнтів. В описаному нами випадку проявів гострого ураження нирок у пацієнтки не відмічалось, проте було виявлене швидке та критичне прогресування гострої печінкової недостатності. При оцінці тяжкості ураження печінки на тлі гепатотоксичності метотрексату застосовують такі критерії: легкий ступінь — при підвищенні рівня трансаміназ у 1–2,5 раза від верхньої межі норми; середньої тяжкості — у 2,5–5 разів; тяжкий ступінь — у 5–20 разів, та загрозливим для життя називають при рівні трансаміназ більше ніж у 20 разів від верхньої межі референтних значень [5]. У нашому випадку рівень АЛТ підвищувався до 4790 Од/л, що в 106 разів вище від верхнього референтного значення (45 Од/л); АСТ — до 4320 Од/л, що в 102 рази вище від верхнього референтного значення (45 Од/л). Тобто спостерігалося загрозливе для життя гостре ураження печінки, хоча і при цьому не було коагулопатії, значного підвищення рівня білірубіну та печінкової енцефалопатії. Повній картині гострої печінкової недостатності вдалося запобігти завдяки своєчасному застосуванню еферентної терапії.
Згідно з протоколом (SSG XIV. A Scandinavian treatment research protocol for extremity localized high-grade osteosarcoma) [4], пацієнтка отримувала внутрішньовенну гідратаційну терапію й олужнення сечі в об’ємі 3000 мл/м2/добу розчинами 5% глюкози в комбінації з 20 ммоль NaHCO3/л та 20 ммоль розчину KCl/л. При цьому діурез пацієнтки становив більше ніж 600 мл/м2/6 годин (згідно з рекомендаціями). Крім того, застосовувалась антидотна терапія кальцію фолінатом. У літературі існує певна дискусія стосовно схеми застосування фолієвої кислоти та її впливу на ефективність метотрексату [7].
Сьогодні для виведення надмірної кількості метотрексату використовуються різні екстракорпоральні методи, включаючи інтермітуючий гемодіаліз із високим потоком (IHD), та тривалі методики замісної ниркової терапії. Не існує єдиного консенсусу щодо оптимальних методів нирковозамісної терапії [5]. Метотрексат є відносно невеликою молекулою з молекулярною масою 454 дальтон, що сприяє ефективному виведенню шляхом гемодіалізу. Сеанс інтермітуючого гемодіалізу є варіантом вибору в даному разі через високу швидкість потоку крові та діалізату. Проте метотрексат має помірне (50 %) зв’язування з білками плазми крові та великий об’єм розподілу (0,76 л/кг). У даному випадку застосування інтермітуючого діалізу не було б ефективним, оскільки після такої терапії є високі ризики повторного збільшення показників концентрації метотрексату в крові від 10 до 220 %, особливо після коротких у часі сеансів інтермітуючого діалізу. Тому для утримання метотрексату в сироватці крові на низьких рівнях необхідно постійне його видалення шляхом постійної замісної ниркової терапії. У даному випадку ми використали тривалу вено-венозну гемодіа-
фільтрацію апаратом Prismaflex у комплексі з антидотною терапією кальцію фолінатом, в/в гідратаційною терапією й олужненням сечі. Після першого проведеного сеансу, що тривав протягом 78 годин, відмічалось повторне зростання концентрації метотрексату в крові та збільшення лабораторних показників печінкової недостатності, що ще раз свідчить про великий об’єм розподілу метотрексату та потребу в тривалій терапії екстракорпоральними методами. Тому сеанс тривалої вено-венозної гемодіафільтрації був продовжений. Після ще 78 годин проведення тривалої вено-венозної гемодіафільтрації відмічались відсутність повторного зростання рівня метотрексату в крові та нормалізація рівнів трансаміназ та загального білірубіну.
Додатково в пацієнтки був досліджений рівень гомоцистеїну на предмет гіпергомоцистеїнемії, а також 4 гени, які також визначають схильність до гіпергомоцистеїнемії, — метилентетрагідрофолат редуктаза MTHFR C677T, A1298C, метіонін синтетаза MTRR та MTR. За наявності підвищеного рівня гомоцистеїну, а також гетерозиготності даних генів це свідчитиме про сповільнення виведення метотрексату або ж про повну затримку його виведення. У даному випадку результати даних досліджень були негативними.
Висновки
Даний клінічний випадок свідчить про ефективність застосування тривалої вено-венозної гемодіафільтрації в комбінації з внутрішньовенною гідратацією, олужненням сечі та антидотною терапією при токсичному впливі на печінку високодозового метотрексату на тлі уповільненої екскреції.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів стосовно даної статті.
Інформація про фінансування: автори заявляють про відсутність фінансування стосовно даної статті.
Інформація про внесок кожного автора: Собко Р.Ю. — проведення екстракорпоральної детоксикації, аналіз випадку; Борачок Т.Т. — лікування пацієнтки, аналіз клінічного випадку та літератури, написання тексту статті; Оранський Т.Б. — лікування пацієнтки, аналіз випадку; Ковальов М.О. — лікування пацієнтки, аналіз випадку; Запоточна Х.М. — онкологічне лікування пацієнтки; Фесенко У.А. — концепція і дизайн статті.
Отримано/Received 10.09.2021
Рецензовано/Revised 02.10.2021
Прийнято до друку/Accepted 12.10.2021
/97.jpg)

/98.jpg)
/98_2.jpg)