Архив офтальмологии Украины Том 9, №3, 2021
Вернуться к номеру
Гемофтальм після оперативного лікування діабетичної ретинопатії у хворих на цукровий діабет 2-го типу
Авторы: Литвиненко С.С.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
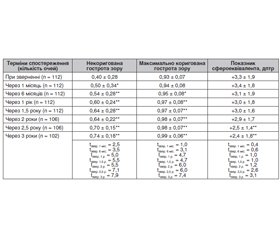
Актуальність. У пацієнтів із цукровим діабетом 2-го типу (ЦД2) та діабетичною ретинопатією (ДР) крововилив у вітреальну порожнину є одним із найбільш поширених ускладнень після закритої субтотальної вітректомії — спостерігається у 12–63 % випадків. Мета: проаналізувати частоту та причини розвитку гемофтальму після оперативного лікування діабетичної ретинопатії у хворих на ЦД2. Матеріали та методи. У дослідженні брали участь 118 пацієнтів (118 очей) із ЦД2 та ДР, які були розподілені на три групи: 1-ша — із початковою непроліферативною ДР (НПДР; 28 очей), 2-га — помірною або тяжкою НПДР (49 очей) та 3-тя — із проліферативною ДР (ПДР; 41 око). Вік пацієнтів становив від 44 до 84 років. Чоловіки — 52 особи (44,1 %), жінки — 66 осіб (55,9 %). У дослідження не включали пацієнтів із тяжкою ПДР та наявністю тракційного відшарування сітківки або масивної кровотечі під час вітректомії при видаленні фіброваскулярної тканини, хірургічне лікування якої потребувало тампонади вітреальної порожнини силіконовою олією. Усім пацієнтам виконали закриту субтотальну вітректомію 25G з етапом панретинальної лазеркоагуляції та тампонадою газо-повітряною сумішшю C3F8 або залишали у вітреальній порожнині розчин BSS plus. Пацієнтів обстежували за стандартним протоколом клінічних та офтальмологічних досліджень. Результати. Протягом трьох місяців після вітректомії в 33,1 % пацієнтів розвинувся післяопераційний гемофтальм, що частіше відбувалося при ПДР (39,0 %). Здебільшого (71,4 %) доопераційний гемофтальм при ПДР супроводжувався розвитком і післяопераційного гемофтальму. Стать суттєво не впливала на частоту розвитку післяопераційного гемофтальму. Хворі з гемофтальмом були старшими від пацієнтів без нього на 9,3 року (p < 0,001), що однаковою мірою стосувалося як чоловіків, так і жінок. Пацієнти з гемофтальмом мали більший стаж ЦД2, ніж без нього (на три роки; р = 0,007), що було підтверджено для чоловіків: чоловіки з гемофтальмом мали довший стаж ЦД2, ніж без гемофтальму (на сім років; р = 0,026). Підвищення вмісту в крові глікованого гемоглобіну (HbA1c) та високий бал за шкалою ETDRS є факторами ризику для розвитку післяопераційного гемофтальму в пацієнтів із ПДР. Висновки. Дослідження протягом трьох місяців після закритої субтотальної вітректомії в пацієнтів із ДР та ЦД2 встановило, що в 33,1 % пацієнтів розвинувся післяопераційний гемофтальм, який частіше виникав при ПДР (39,0 %). Здебільшого (71,4 %) наявність доопераційного гемофтальму при ПДР супроводжувалася розвитком і післяопераційного гемофтальму. Факторами ризику виникнення післяопераційного гемофтальму після вітректомії при ЦД2 та ДР були вік і тривалість діабету, а для ПДР — наявність доопераційного гемофтальму, підвищення вмісту в крові глікованого гемоглобіну та високий бал за шкалою ETDRS.
Background. In patients with type 2 diabetes mellitus (DM2) and diabetic retinopathy (DR), vitreous hemorrhage is one of the most common complications after pars plana vitrectomy (PPV) and ranges from 12 to 63 %. The study was aimed to analyze the frequency and causes of the development of hemophthalmia after surgical treatment of diabetic retinopathy in patients with type 2 diabetes mellitus. Materials and methods. The study involved 118 patients (118 eyes) with type 2 diabetes mellitus and DR, who were divided into three groups: the first group — with initial non-proliferative DR (NPDR; 28 eyes), the second group — with moderate to severe NPDR (49 eyes) and the third group — with proliferative DR (РDR; 41 eyes). The age of patients ranged from 44 to 84 years, men — 52 (44.1 %), women — 66 (55.9 %). The study did not include the patients with severe PDR and tractional retinal detachment or massive hemorrhage that required silicone oil tamponade of the vitreal cavity. All patients underwent closed subtotal vitrectomy 25G with panretinal laser photocoagulation and tamponade with an air-gas C3F8 mixture or the operation was completed with BSS plus solution injected into the vitreal cavity. Patients were examined based on a standard protocol of clinical and ophthalmological studies. Results. Within three months after vitrectomy, 33.1 % of patients developed postoperative hemophthalmia, which happened more often in РDR (39.0 %). In most cases (71.4 %), the preoperative hemophthalmia in РDR was accompanied by the development of postoperative hemophthalmia. Gender did not significantly impact the incidence of postoperative hemophthalmia. Patients with hemophthalmia were 9.3 years older than patients without hemophthalmia (p < 0.001), which affected both men and women equally. Patients with hemophthalmia had a longer history of type 2 diabetes mellitus compared to those without it (three years; p = 0.007), which was confirmed for men: men with hemophthalmia had a longer history of type 2diabetes mellitus than those without hemophthalmia (seven years; p = 0.026). Elevated blood levels of glycated hemoglobin (HbA1c) and a high score on the ETDRS scale are the risk factors for the development of postoperative hemophthalmos in patients with РDR. Conclusions. A study within three months after PPV in patients with DR and type 2 diabetes mellitus found that 33.1 % of patients developed postoperative hemophthalmia, which occurred more often in РDR (39.0 %). In most cases (71.4 %), the preoperative hemophthalmos in РDR was accompanied by the development of postoperative hemophthalmia. The risk factors for postoperative hemophthalmia after vitrectomy in type 2 diabetes mellitus and DR were age and diabetes duration, and for РDR — the presence of preoperative hemophthalmia, increased blood glycated hemoglobin, and a high score on the ETDRS scale.
діабетична ретинопатія; цукровий діабет 2-го типу; закрита субтотальна вітректомія; післяопераційний гемофтальм
diabetic retinopathy; type 2 diabetes mellitus; pars plana vitrectomy; postoperative hemophthalmia
Вступ
Матеріали та методи
Результати та їх обговорення
Висновки
- Kowall B., Rathmann W., Stang A., Bongaerts B., Kuss O., Herder C. et al. Perceived risk of diabetes seriously underestimates actual diabetes risk: The KORA FF4 study. PLoS One. 2017. 12(1). e0171152. doi: 10.1371/journal.pone.0171152.
- Ulyte A., Bähler C., Schwenkglenks M., von Wyl V., Gruebner O., Wei W. et al. Measuring diabetes guideline adherence with claims data: systematic construction of indicators and related challenges. BMJ Open. 2019. 9(4). e027138. doi: 10.1136/bmjopen-2018-027138
- Heidemann C., Paprott R., Stühmann L.M., Baumert J., Mühlenbruch K., Hansen et al. Perceived diabetes risk and related determinants in individuals with high actual diabetes risk: results from a nationwide population-based survey. BMJ Open Diabetes Res. Care. 2019. 7(1). e000680. doi: 10.1136/bmjdrc-2019-000680.
- Harding J.L., Pavkov M.E., Magliano D.J., Shaw J.E., Gregg E.W. Global trends in diabetes complications: a review of current evidence. Diabetologia. 2019. 62(1). 3-16. doi: 10.1007/s00125-018-4711-2.
- Simó-Servat O., Hernández C., Simó R. Diabetic retinopathy in the context of patients with diabetes. Ophthalmic Res. 2019. 62(4). 211-217. doi: 10.1159/000499541.
- Wong K.H., Hu K., Peterson C., Sheibani N., Tsivgoulis G., Majersik J.J. et al. Diabetic retinopathy and risk of stroke: a secondary analysis of the ACCORD Eye study. Stroke. 2020. 51(12). 3733-6. doi: 10.1161/STROKEAHA.120.030350.
- Drinkwater J.J., Davis T.M., Hellbusch V., Turner A.W., Bruce D.G., Davis W.A. Retinopathy predicts stroke but not myocardial infarction in type 2 diabetes: the Fremantle Diabetes Study Phase II. Cardiovasc. Diabetol. 2020. 19(1). 43. doi: 10.1186/s12933-020-01018-3.
- Pearce I., Simó R., Lövestam-Adrian M., Wong D.T., Evans M. Association between diabetic eye disease and other complications of diabetes: implications for care. a systematic review. Diabetes, obesity and metabolism. 2019. 21(3). 467-8. https://doi.org/10.1111/ dom.13550.
- Mo B., Li S.F., Liu Y., Zhou J., Wang S.L., Shi X.Y. Suprachoroidal hemorrhage associated with pars plana vitrectomy. BMC Ophthalmol. 2021 Aug. 11. 21(1). 295. doi: 10.1186/s12886-021-02062-7.
- Sun Q., Jing Y., Zhang B., Gu T., Meng R., Sun J. et al. The risk factors for diabetic retinopathy in a chinese population: a cross-sectional study. J. Diabetes Res. 2021. 2021. 5340453. doi: 10.1155/2021/5340453.
- Tan C.S., Li K.Z., Sadda S.R. Wide-field angiography in retinal vein occlusions. Int. J. Retina Vitreous. 2019. 5(1). 18. doi: 10.1186/s40942-019-0163-1.
- Yorston D., Wickham L., Benson S., Bunce C., Sheard R., Charteris D. Predictive clinical features and outcomes of vitrectomy for proliferative diabetic retinopathy. Br. J. Ophthalmol. 2008 Mar. 92(3). 365-8. doi: 10.1136/bjo.2007.124495.
- Shih K.C., Lam K.S., Tong L. A systematic review on the impact of diabetes mellitus on the ocular surface. Nutr Diabetes. 2017. 7(3). e251. doi: 10.1038/nutd.2017.
- Conart J.B., Berrod J.P. Hémorragies du vitré non traumatiques [Non-traumatic vitreous hemorrhage]. J. Fr. Ophtalmol. 2016 Feb. 39(2). 219-225. French. doi: 10.1016/j.jfo.2015.11.001.
- Marques R.E., Sousa D.C., Leal I., Faria M.Y., Marques-Neves C. Complete ILM peeling versus inverted flap technique for macular hole surgery: a meta-analysis. Ophthalmic Surg. Lasers Imaging Retina. 2020. 51(3). 187-A2. doi: 10.3928/23258160-20200228-08.
- Taskintuna I., Elsayed M.E., Taskintuna K., Ahmad K., Khandecar R., Schatz P. et al. Comparison of outcomes of four different treatment modalities for diabetic vitreous haemorrhage. Sci. Rep. [Internet]. 2020. 10(3674). doi.org/10.1038/s41598-020-60378-8. Available from: https://www.nature.com/articles/s41598-020-60378-8#citeas
- Mahalingam P., Topiwalla T.T., Ganesan G. Vitreous rebleed following sutureless vitrectomy: Incidence and risk factors. Indian J. Ophthalmol. 2018 Apr. 66(4). 558-561. doi: 10.4103/ijo.IJO_770_17. PMID: 29582819; PMCID: PMC5892061.
- Abdelaal A.M., Alqahtani A.S. Mode of delivery in the setting of repeated vitreous hemorrhages in proliferative diabetic retinopathy: a case report and review of the literature. Cureus. 2020. 12(10). e11239. doi:10.7759/cureus.11239.
- Early Treatment Diabetic Retinopathy Study Research Group. Grading Diabetic Retinopathy from Stereoscopic Color Fundus Photographs — An Extension of the Modified Airlie House Classification: ETDRS Report Number 10. Ophthalmology. 2020 Apr. 127(4S). 99-119. doi: 10.1016/ j.ophtha.2020.01.030.
- Grading diabetic retinopathy from stereoscopic color fundus photographs — an extension of the modified Airlie House classification. ETDRS report number 10. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology. 1991 May. 98(5 Suppl.). 786-806. PMID: 2062513.
- Ding Y., Yao B., Hang H., Ye Hui. Multiple factors in the prediction of risk of recurrent vitreous haemorrhage after sutureless vitrectomy for non-clearing vitreous haemorrhage in patients with diabetic retinopathy [Internet]. BMC Ophthalmol. 2020. doi.org/10.1186/s12886-020-01532-8. Available from: https://bmcophthalmol.biomedcentral. com/ articles/10.1186/s12886-020-01532-8#citeas
- Treumer F., Roider J. Glaskörperblutung. Wie lange kann man abwarten? [Vitreous body hemorrhage. How long can one wait?]. Ophthalmologe. 2020. 117(9). 866-70. doi: 10.1007/s00347-020-01112-7. [in German]
- Gupta A., Bhatnagar S. Vasoregression: A Shared Vascular Pathology Underlying Macrovascular And Microvascular Pathologies? OMICS. 2015 Dec. 19(12). 733-753. doi: 10.1089/omi.2015.0128.69.
- Kim K.E., Yang P.S., Jang E., Kim S., Joung B. Antithrombotic medication and the risk of vitreous hemorrhage in atrial fibrillation: Korean national health insurance service national cohort. Yonsei Med. J. 2019. 60(1). 65-72. doi: 10.3349/ymj.2019.60.1.65.
- Motoda S., Shiraki N., Ishihara T., Sakaguchi H., Kabata D., Takahara M., Kimura T., Kozawa J., Imagawa A., Nishida K., Shintani A., Iwahashi H., Shimomura I. Predictors of postoperative bleeding after vitrectomy for vitreous hemorrhage in patients with diabetic retinopathy. J. Diabetes Investig. 2018 Jul. 9(4). 940-945. doi: 10.1111/jdi.12791.
- Abdalla Elsayed M.E., Mura M., Al Dhibi H., Schellini S., Malik R., Kozak I. et al. Sickle cell retinopathy. A focused review. Graefes Arch. Clin. Exp. Ophthalmol. 2019. 257(7). 1353-64. doi: 10.1007/s00417-019-04294-2.
- Rho S.S., Ando K., Fukuhara S. Dynamic regulation of vascular permeability by vascular endothelial cadherin-mediated endothelial cell-cell junctions. J. Nippon Med. Sch. 2017. 84(4). 148-159. doi: 10.1272/jnms.84.148.
- Lin H.-C., Yang C.-M., Chen S.-N., Hsieh Y.-T. Vitrectomy with internal limiting membrane peeling versus nonsurgical treatment for diabetic macular edema with massive hard exudates. PLoS ONE. 2020. 15(7). e0236867. doi.org/10.1371/journal.pone.0236867.
- Forrester J.V., Kuffova L., Delibegovic M. The role of inflammation in diabetic retinopathy. Front. Immunol. 2020. 11. 583687. doi: 10.3389/fimmu.2020.583687.
- Menini S., Iacobini C., Vitale M., Pugliese G. The inflammasome in chronic complications of diabetes and related metabolic disorders. Cells. 2020. 9(8). 1812. doi: 10.3390/cells9081812.
- Wadhwani M., Bhartiya S., Upadhaya A., Manika M. A meta-analysis to study the effect of pan retinal photocoagulation on retinal nerve fiber layer thickness in diabetic retinopathy patients. Rom. J. Ophthalmol. [Internet]. 2020. 64(1). 8-14. Available from: https://pubmed.ncbi.nlm.nih.gov/32292851/.
- Sahajpal N.S., Goel R.K., Chaubey A., Aurora R., Jain S.K. Pathological perturbations in diabetic retinopathy: hyperglycemia, AGEs, oxidative stress and inflammatory pathways. Curr. Protein Pept. Sci. 2019. 20(1). 92-110. doi: 10.2174/13892037196661 80928123449.
- Youngblood H., Robinson R., Sharma A., Sharma S. Proteomic biomarkers of retinal inflammation in diabetic retinopathy. Int. J. Mol. Sci. 2019. 20(19). 4755. doi: 10.3390/ijms20194755.
- Williams D., Argáez C. Acute, sustained, intraocular pressure increases following anti-vascular endothelial growth factor treatment for retinal conditions: a review of clinical evidence and guidelines [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health. 2019. Available from: https://www.ncbi.nlm.nih.gov/ books/NBK545133/.
- Hu X.N., Ni Y., Luan J., Ding Y.Z. A review on vasohibin and ocular neovascularization. Int. J. Ophthalmol. 2020. 13(6). 1004-8. doi: 10.18240/ijo.2020.06.22.
- Senthil S., Dada T., Das T., Kaushik S., Puthuran G.V., Philip R. et al. Neovascular glaucoma — a review. Indian J. Ophthalmol. 2021. 69(3). 525-534. doi: 10.4103/ijo.IJO_1591_20.

/17.jpg)
/18.jpg)