Архив офтальмологии Украины Том 9, №3, 2021
Вернуться к номеру
Сучасний погляд на етіопатогенез вікової макулярної дегенерації та роль молекулярно-генетичних детермінант у ньому
Авторы: Малачкова Н.В., Мохаммад Машхур Мохаммад Маса’дех, Осама Мохаммад Мітеб Аль-Джаррах, Людкевич Г.П., Сухань Д.С.
Вінницький національний медичний університет ім. М.І. Пирогова, м. Вінниця, Україна
Рубрики: Офтальмология
Разделы: Справочник специалиста
Версия для печати
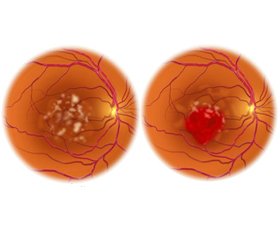
Вікова дегенерація жовтої плями (вікова макулярна дегенерація) вражає переважно людей літнього віку і являє собою одну з найпоширеніших причин втрати зору, що швидко прогресує. Більш ніж за 150 років досліджень наукова спільнота пройшла шлях від розуміння макроскопічної картини ураження (ідентифікації друз як основного морфологічного прояву нозології) до детальних класифікацій і визначення ролі генетичних детермінант в етіопатогенезі захворювання — саме рання діагностика методом генетичного аналізу потребує найбільшої уваги спеціалізованих дослідницьких груп через високу специфічність, можливість превентивного аналізу та багато нез’ясованого у галузі генетичної діагностики очних хвороб. Метою оглядової статті була систематизація інформації про можливі ланки патогенезу вікової макулярної дегенерації та виявлення потенційних поліморфізмів, що здатні ініціювати та модулювати активність цих ланок. Під час нашої роботи вдалось з’ясувати п’ять основних механізмів ураження власне судинної оболонки ока, на які впливають однонуклеотидні поліморфізми. Найбільшу спорідненість проявляли генетичні варіанти окремих ділянок CFH (rs1061170), HTRA1 (rs11200638), TNF (rs1800629), VEGF-A (rs2010963). Літературні дані, отримані з іноземних і вітчизняних джерел, що індексуються базами даних Scopus, Web of Science, зокрема за останні 5 років, приділяють виняткову увагу саме цим ділянкам як потенційним предикторам або модифікаторам патологічних процесів, що залучені в процес макулярної дегенерації. Попри велику кількість досліджень, що вивчають схильність, патогенез, діагностику та лікування вікової макулярної дегенерації і мають на меті зупинити поширення спровокованої нею втрати зору, лише декілька питань є досконало з’ясованими. Беручи до уваги успішні кейси застосування біологічної та генної терапії для лікування подібних пацієнтів, ми вбачаємо нові горизонти саме у детальному вивченні молекулярних взаємодій, що знаходяться в основі патології. Огляд знаходить підтвердження активної ролі поліморфізмів в одному з найактуальніших патологічних процесів людського ока.
Age-related macular degeneration mainly affects the elderly and is one of the most common causes of rapidly progressive vision loss. Over more than 150 years of research, the scientific community has gone from understanding the macroscopic picture of the lesion, presumable identification of drusen as the main morphological manifestation of nosology, to detailed classifications and determine the role of genetic determinants in the etiopathogenesis of the disease — high specificity, the possibility of preventive analysis, and much unclear in the field of genetic diagnosis of eye diseases determine the accurate attention of specialized research groups to the early diagnosis using genetic analysis. The review article was aimed to systematize the information about possible links in the pathogenesis of age-related macular degeneration and identify potential polymorphisms that can initiate and modulate the activity of these links. During the study, we could find out five main mechanisms of damage to the vascular membrane of the eye itself, which are affected by single nucleotide polymorphisms. The highest affinity was shown by genetic variants of separate sites of CFH (rs1061170), HTRA1 (rs11200638), TNF (rs1800629), VEGFA (rs2010963). Literature data obtained from foreign and national sources indexed by Scopus, Web of Science databases, in particular for the last 5 years, pay special attention to these areas as potential predictors or modifiers of pathological processes involved in the process of macular degeneration. Despite the large number of studies examining the predisposition, pathogenesis, diagnosis, and treatment of age-related macular degeneration to stop the spread of vision loss, only a few issues are understood thoroughly. Considering the successful cases of application of biological and gene therapy for the management of such patients, we see new horizons in the detailed study of molecular interactions that underlie the pathology. The review confirms the active role of polymorphisms in one of the most relevant pathological processes of the human eye.
вікова макулярна дегенерація; однонуклеотидні поліморфізми; CFH; TNF; HTRA1; VEGF-A; огляд
age-related macular degeneration; single-nucleotide polymorphisms; CFH; TNF; HTRA1; VEGFA; review
Вступ
Фактори ризику
CFH
HTRA1
TNF
VEGF-A
Висновки
- Colijn J.M. et al. Prevalence of age-related macular degeneration in Europe. Ophthalmology. 2017. Vol. 124. № 12. P. 1753-1763. doi: 10.1016/j.ophtha.2017.05.035.
- García-Onrubia L. et al. Matrix metalloproteinases in age-related macular degeneration (AMD). International Journal of Molecular Sciences. 2020. Vol. 21. № 5934. P. 1-32. doi: 10.3390/ijms21165934.
- Cook H.L., Patel P.J., Tufail A. Age-related macular degeneration: diagnosis and management. British Medical Bulletin. 2008. Vol. 85. № 1. P. 127-149. doi: 10.1093/bmb/ldn012.
- The Age-Related Eye Disease Study Research Group. The age-related eye disease study (AREDS): Design implications AREDS Report No. 1. Controlled Clinical Trials. 1999. Vol. 20. № 6. P. 573-600. doi: 10.1016/S0197-2456(99)00031-8.
- World Health Organization: World report on vision. 2019. URL: https://www.who.int/publications/i/item/9789241516570.
- Kawasaki R. et al. The prevalence of age-related macular degeneration in Asians: a systematic review and meta-analysis. Ophthalmology. 2010. Vol. 117. № 5. P. 921-927. doi: 10.1016/j.ophtha.2009.10.007.
- Nashine S. et al. Age-related macular degeneration (AMD) mitochondria modulate epigenetic mechanisms in retinal pigment epithelial cells. Experimental Eye Research. 2019. Vol. 189. № 107701. P. 1-15. doi: 10.1016/j.exer.2019.107701.
- Blasiak J. Senescence in the pathogenesis of age-related macular degeneration. Cellular and Molecular Life Sciences. 2020. № 77. P. 789-805. doi: 10.1007/s00018-019-03420-x.
- DeAngelis M.M. et al. Genetics of age-related macular degeneration (AMD). Human Molecular Genetics. 2017. Vol. 26. № R1. P. R45-R50. doi: 10.1093/hmg/ddx228.
- Al-Zamil W.M., Yassin S.A. Recent developments in age-related macular degeneration: a review. Clinical Interventions in Aging. 2017. № 12. P. 1313-1330. doi: 10.2147/CIA.S143508.
- Cougnard-Grégoire A. et al. Long-term blood pressure and age-related macular degeneration: the ALIENOR study. Investigative Ophthalmology & Visual Science. 2013. Vol. 54. № 3. P. 1905-1912. doi: 10.1167/iovs.12-10192.
- Rinninella E. et al. The role of diet, micronutrients and the gut microbiota in age-related macular degeneration: New perspectives from the gut-retina axis. Nutrients. 2018. Vol. 10. № 11. P. 1677. doi: 10.3390/nu10111677.
- Merle B.M.J. et al. Mediterranean diet and incidence of advanced age-related macular degeneration: The EYE-RISK Consortium. Ophthalmology. 2019. Vol. 126. № 3. P. 381-390. doi: 10.1016/j.ophtha.2018.08.006.
- Gilbert R. et al. Zinc nutrition and inflammation in the aging retina. Molecular Nutrition & Food Research. 2019. № 1801049. P. 1-16. doi: 10.1002/mnfr.201801049.
- Blasiak J. et al. Zinc and autophagy in age-related macular degeneration. International Journal of Molecular Sciences. 2020. Vol. 21. № 4994. P. 1-19. doi: 10.3390/ijms21144994.
- Di Marco S. et al. Saffron: A multitask neuroprotective agent for retinal degenerative diseases. Antioxidants. 2019. Vol. 8. № 7. P. 224. doi: 10.3390/antiox8070224.
- Datta S. et al. The impact of oxidative stress and inflammation on RPE degeneration in non-neovascular AMD. Progress in Retinal and Eye Research. 2017. № 60. P. 201-218. doi: 10.1016/j.preteyeres.2017.03.002.
- Hanus J., Anderson C., Wang, S. RPE necroptosis in response to oxidative stress and in AMD. Ageing Research Reviews. 2015. № 24B. P. 286-298. doi: 10.1016/j.arr.2015.09.002.
- Wong W.L. et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet. 2014. Vol. 2. № 2. P. E106-E116. doi: 10.1016/S2214-109X(13)70145-1.
- Jonas J.B., Cheung C.M.G., Panda-Jonas S. Updates on the epidemiology of age-related macular degeneration. Asia-Pacific Journal of Ophthalmology. 2017. Vol. 6. № 6. P. 493-497. doi: 10.22608/APO.2017251.
- Gorina M.B., da Silva M.J. Predictive genetics for AMD: Hype and hopes for genetics-based strategies for treatment and prevention. Experimental Eye Research. 2020. Vol. 191. № 107894. P. 1-8. doi: 10.1016/j.exer.2019.107894.
- The AMD Gene Consortium. Seven new loci associated with age-related macular degeneration. Nature Genetics. 2013. Vol. 45. № 4. P. 433-439. doi: 10.1038/ng.2578.
- Mitchell P. et al. Age-related macular degeneration. Lancet. 2018. Vol. 392. № 10153. P. 1147-1159. doi: 10.1016/S0140-6736(18)31550-2.
- Whitmore H.A.B. et al. TNF-α signaling regulates RUNX1 function in endothelial cells. The FASEB Journal. 2020. Vol. 35. № 2. P. 1-17. doi: 10.1096/fj.202001668R.
- Cheng J., Hao X., Zhang Z. Risk of macular degeneration affected by polymorphisms in matrix metalloproteinase-2. Medicine. 2017. Vol. 96. № 47. P. e8190. doi: 10.1097/MD.0000000000008190.
- Black J.R.M., Clark S.J. Age-related macular degeneration: genome-wide association studies to translation. Genetics in Medicine. 2016. Vol. 18. № 4. P. 283-289. doi: 10.1038/gim.2015.70.
- De Jong P.T.V.M. Elusive drusen and changing terminology of AMD. Eye. 2018. Vol. 32. № 5. P. 904-914. doi: 10.1038/eye.2017.298.
- Dysli C. et al. Fluorescence lifetimes of drusen in age-related macular degeneration. Investigative Ophthalmology & Visual Science. 2017. Vol. 58. № 11. P. 4856-4862. doi: 10.1167/iovs.17-22184.
- Nita M. et al. Age-related macular degeneration and changes in the extracellular matrix. Medical Science Monitor. 2014. № 20. P. 1003-1016. doi: 10.12659/MSM.889887.
- Toomey C.B., Johnson L.V., Rickman C.B. Complement factor H in AMD: Bridging genetic associations and pathobiology. Progress in Retinal and Eye Research. 2018. № 62. P. 38-57. doi: 10.1016/j.preteyeres.2017.09.001.
- Klein R.J. et al. Complement factor H polymorphism in age-related macular degeneration. Science. 2005. Vol. 308. № 5720. P. 385-389. doi: 10.1126/science.1109557.
- Belekhova S.G., Astakhov Yu.S. The role of genetically determined factors in age-related macular degeneration pathogenesis. Ophthalmology Journal. 2015. Vol. 8. № 4. P. 30-39.
- GeneCards — the human gene database: CFH Gene — GeneCards. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene=CFH.
- Tam P.O.S. et al. HTRA1 variants in exudative age-related macular degeneration and interactions with smoking and CFH. Investigative Ophthalmology & Visual Science. 2008. Vol. 49. № 6. P. 2357-2365. doi: 10.1167/iovs.07-1520.
- Wang L. et al. Nrf2 signaling modulates cigarette smoke induced complement activation in retinal pigmented epithelial cells. Free Radical Biology and Medicine. 2014. № 70. P. 155-166. doi: 10.1016/j.freeradbiomed.2014.01.015.
- Gotoh N. et al. No association between complement factor H gene polymorphism and exudative age-related macular degeneration in Japanese. Human Genetics. 2006. Vol. 120. № 1. P. 139-143. doi: 10.1007/s00439-006-0187-0.
- Mattapallil M.J., Caspi R.R. Compliments of factor H: What’s in it for AMD? Immunity. 2017. Vol. 46. № 2. P. 167-169. doi: 10.1016/j.immuni.2017.02.008.
- GeneCards — the human gene database: HTRA1 Gene — GeneCards. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene=HTRA1.
- Akhtar-Schaefer I. et al. AMD-associated HTRA1 variants do not influence TGF-β signaling in microglia. Retinal Degenerative Diseases. 2019. № 1185. P. 3-7. doi: 10.1007/978-3-030-27378-1_1.
- Jaouni T. et al. Association of pattern dystrophy with an HTRA1 single-nucleotide polymorphism. JAMA Ophthalmology. 2012. Vol. 130. № 8. P. 987-991. doi: 10.1001/archophthalmol.2012.1483.
- Zhang L. et al. High temperature requirement factor A1 (HTRA1) gene regulates angiogenesis through transforming growth factor-β family member growth differentiation factor 6. Journal of Biological Chemistry. 2012. Vol. 287. № 2. P. 1520-1526. doi: 10.1074/jbc.M111.275990.
- Zhou Y. et al. Association between polymorphism rs11200638 in the HTRA1 gene and the response to anti-VEGF treatment of exudative AMD: a meta-analysis. BMC Ophthalmology. 2017. Vol. 17. № 97. P. 1-9. doi: 10.1186/s12886-017-0487-2.
- GeneCards — the human gene database: TNF Gene — GeneCards. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene=TNF.
- Kim S. et al. Evolution of oxidative stress, inflammation and neovascularization in the choroid and retina in a subretinal lipid induced age-related macular degeneration model. Experimental Eye Research. 2021. Vol. 203. № 108391. doi: 10.1016/j.exer.2020.108391.
- Litwińska Z. et al. The interplay between systemic inflammatory factors and microRNAs in age-related macular degeneration. Frontiers in Aging Neuroscience. 2019. Vol. 11. № 286. P. 1-13. doi: 10.3389/fnagi.2019.00286.
- Bonyadi M.H.J. et al. Tumor necrosis factor gene polymorphisms in advanced non-exudative age-related macular degeneration. Journal of Ophthalmic & Vision Research. 2015. Vol. 10. № 2. P. 155-159. doi: 10.4103/2008-322X.163781.
- Chernykh V. et al. TNF-α gene polymorphisms: association with age-related macular degeneration in Russian population. International Journal of Ophthalmology. 2019. Vol. 12. № 1. P. 25-29. doi: 10.18240/ijo.2019.01.04.
- GeneCards — the human gene database: VEGFA Gene — GeneCards. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene=VEGFA.
- Blasiak J. et al. Expression of VEGFA-regulating miRNAs and mortality in wet AMD. Journal of Cellular and Molecular Medicine. 2019. Vol. 23. № 12. P. 8464-8471. doi: 10.1111/jcmm.14731.
- Apte R.S. Reducing treatment burden in AMD. Cell. 2020. Vol. 180. № 6. P. 1033. doi: 10.1016/j.cell.2020.02.028.
- Huang C. et al. Vascular endothelial growth factor A polymorphisms and age-related macular degeneration: a systematic review and meta-analysis. Molecular Vision. 2013. № 19. P. 1211-1221.