Архив офтальмологии Украины Том 9, №3, 2021
Вернуться к номеру
Нові, генетично детерміновані, фактори ризику діабетичної ретинопатії при цукровому діабеті 2-го типу: заключне повідомлення
Авторы: Могілевський С.Ю. (1), Гудзь А.С. (2), Панченко Ю.О. (1), Бушуєва О.В. (2), Захаревич Г.Е. (2)
(1) — Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(2) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
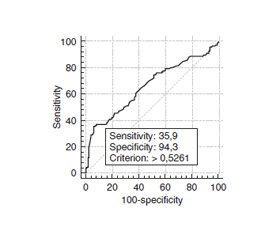
Актуальність. За прогнозами Міжнародної федерації діабету (IDF), до 2030 року кількість хворих на цукровий діабет (ЦД) зросте з 366 до 552 мільйонів. В Україні зареєстровано понад 1,5 мільйона хворих на цукровий діабет, із яких 84–95 % — хворі на діабет 2-го типу (ЦД2). Одним із важливих ускладнень цукрового діабету є діабетична ретинопатія (ДР), що залишається однією з причин сліпоти і слабкозорості, в тому числі в осіб працездатного віку. В патогенезі ДР важлива роль належить метаболічним порушенням, в тому числі активації поліолового шляху утилізації глюкози, ключову роль у чому відіграє альдозоредуктаза, активність якої пов’язують з поліморфізмом її гена — AKR1B1. Вивчення нових метаболічних і генетичних механізмів розвитку і прогресування ДР при ЦД2 у пацієнтів української популяції є актуальним завданням сучасної офтальмології. Мета: дослідити та узагальнити нові дані про генетично детерміновані фактори ризику діабетичної ретинопатії при цукровому діабеті 2-го типу. Матеріали та методи. У дослідження було залучено 409 осіб, які були розподілені на чотири групи: 1-ша — пацієнти когорти порівняння (98 осіб без ЦД2); 2-га — 76 пацієнтів (I стадія ДР, без змін на очному дні); 3-тя — 64 пацієнти (непроліферативна ДР (НПДР)); 4-та — 64 пацієнти (проліферативна ДР); контрольну групу для генетичних досліджень становили 107 офтальмологічно здорових обстежених пацієнтів. Всім пацієнтам виконували забір крові для молекулярно-генетичних досліджень шляхом пункції ліктьової вени і забору 2,5 мл крові через одноразовий шприц (Hemoplast, Etalon+, Україна) об’ємом 5,0 мл із голкою діаметром 23G з подальшим випусканням до контейнера (Vacuette K3E K3EDTA, Greiner bio-one, Австрія) об’ємом 3,0 мл. Досліджували розподіл поліморфних алелей і генотипів rs759853 та rs9640883 гена AKR1B1 у пацієнтів з НПДР та ПДР і ЦД2 та в контрольній групі та їх асоціацію з захворюванням і впливом на виникнення, механізми розвитку і прогресування ДР. На підставі проведених досліджень було розроблено модель прогнозування розвитку ДР шляхом побудови множинної регресії з достатньою надійністю ступеня впливу незалежних змінних на розрахунковий показник. Результати. В результаті проведених нами досліджень були встановлені нові, генетично детерміновані, фактори ризику розвитку та прогресування різних стадій ДР у пацієнтів із ЦД2, а саме роль поліморфних алелей і генотипів rs759853 та rs9640883 гена AKR1B1. Розроблені логістичні моделі регресії встановили, що ризик розвитку ДР у п’ять разів менший у носіїв генотипів G/G і G/A порівняно з носіями генотипу A/A поліморфізму rs759853 (p < 0,001). Встановлено, що ризик у два рази більший (p = 0,01) у носіїв генотипу G/G rs9640883 порівняно з генотипами A/A + G/A. Ризик розвитку ПДР у 3,3 раза менший у носіїв генотипу G/G та в 2,5 раза — у носіїв генотипу G/A порівняно з носіями генотипу А/А rs759853. Висновки. Отже, на підставі проведених нами клінічних, офтальмологічних і молекулярно-генетичних та статистичних досліджень були встановлені нові фактори ризику розвитку та прогресування різних стадій ДР у пацієнтів із ЦД2. Були побудовані математичні моделі розвитку та прогресування різних стадій ДР у пацієнтів із ЦД2.
Background. According to the International Diabetes Federation, the number of people with diabetes mellitus is going to increase from 366 to 552 million by 2030. More than 1.5 million patients with diabetes are registered in Ukraine, of which 84–95 % have type 2 diabetes. Diabetic retinopathy (DR) is one of the common diabetes complications, being one of the leading causes of blindness and low vision, in particular in people of occupational age. Metabolic disorders, including activation of the polyol pathway of glucose utilization, play an important role in the pathogenesis of DR, with aldose reductase playing a key role, the activity of which is associated with the polymorphism of its gene, AKR1B1. The study of new metabolic and genetic mechanisms for the development and progression of DR in type 2 diabetes mellitus in patients from the Ukrainian population is an actual task of modern ophthalmology. Purpose: to investigate and generalize new genetically determined risk factors for diabetic retinopathy in type 2 diabetes mellitus. Materials and methods. The study involved 409 participants, who were divided into four groups: 1 — comparison cohort (98 people without diabetes mellitus type 2); 2 — 76 patients (stage I DR, without fundus changes); 3 — 64 individuals with non-proliferative DR; 4 — 64 patients with proliferative DR; control group for genetic researches included 107 ophthalmologically healthy individuals. All patients underwent blood sampling for molecular genetic research by puncture of the ulnar vein and aspiration of 2.5 ml of blood through a 23G 5.0 ml disposable syringe (Hemoplast, Etalon+, Ukraine), followed by a release into a 3.0 ml container (Vacuette K3E K3EDTA, Greiner Bio-One, Austria). Distribution of polymorphic alleles and genotypes of rs759853 and rs9640883 aldose reductase gene (AKR1B1) in patients with non-proliferative DR, proliferative DR and in the control group and their association with disease and effects on the occurrence, mechanisms of development and progression of DR were studied. Based on the conducted researches, a model of DR development prognosis was developed by construction of multiple regression with sufficient reliability of degree of influence of independent variables on a calculated indicator. Results. As a result of our research, we identified new genetically determined risk factors for the development and progression of the different stages of DR in patients with diabetes mellitus type 2, namely the role of polymorphic alleles and genotypes rs759853 and rs9640883 of the AKR1B1 gene. The developed logistic regression models found that the risk of DR incidence is five times lower in carriers of the G/G and G/A genotypes compared to carriers of the A/A genotype rs759853 polymorphism (p < 0.001). It was found that the risk is twice as high (p = 0.01) for carriers of the G/G genotype rs9640883 compared to the A/A + G/A genotypes. The risk of developing proliferative DR is 3.3 times lower in carriers of the G/G genotype and 2.5 times lower in carriers of the G/A genotype compared to carriers of the A/A genotype rs759853. Conclusions. Therefore, on the basis of our clinical, ophthalmological, molecular genetic and statistical studies we have identified new risk factors for the development and progression of different stages of DR in patients with diabetes mellitus type 2. Mathematical models of development and progression of different stages of DR in patients with diabetes type 2 were built.
діабетична ретинопатія; цукровий діабет 2-го типу; фактори ризику; поліморфізми алелей і генотипів rs759853 та rs9640883 гена AKR1B1
diabetic retinopathy; type 2 diabetes mellitus; risk factors; polymorphisms of alleles and genotypes rs759853 and rs9640883 of the AKR1B1 gene
Актуальність
Матеріали та методи
Результати та обговорення
Висновки
- Ametov A.S., Karpova E.V. Rol’ tanakana v lechenii pozdnih oslozhnenij saharnogo diabeta. Russkij medicinskij zhurnal. 2007. T. 15. № 27(308). S. 2088-2092. [in Russian]
- Balabolkin M.I., Klebanova E.M., Kreminskaya V.M. Lechenie saharnogo diabeta i ego oslozhnenij: Rukovodstvo dlya vrachej. M.: Medicina, 2005. 512 s. [in Russian]
- Bezdetko P.A., Gorbacheva E.V. Epidemiologiya i chastota saharnogo diabeta i diabeticheskoj retinopatii. Mezhdunarodnyj endokrinologicheskij zhurnal. 2006. № 4(6). S. 76-80. [in Russian]
- Vlasenko M.V. Cukrovij dіabet: dіagnostika і monіtoring. Lіki Ukraїni. 2013. № 9–10. S. 17-18. [in Ukrainian]
- Dorogoj A.P. Trivalіst' zhittya, potencіjnі vtrati trudovogo potencіalu j povіkova smertnіst' pri cukrovomu dіabetі: Dinamіka pokaznikіv. Mіzhnarodnij endokrinologіchnij zhurnal. 2007. № 3(9). S. 14-19. [in Russian]
- Naumenko V.A. Sistemnyj podhod k rannej diagnostike diabeticheskoj retinopatii. Problemi ekologіchnoї ta medichnoї genetiki і klіnіchnoї іmunologії. 2010. Vip. 1. S. 425-434. [in Russian]
- Suplotova L.A., Bel’chikova L.N., Rozhnova N.A. Epidemiologicheskie aspekty saharnogo diabeta 2 tipa s manifestaciej zabolevaniya v molodom vozraste. Saharnyj diabet. 2011. № 1. S. 11-13. [in Russian]
- Scanlon P.H., Aldington S.J., Stratton I.M. Epidemiological issues in diabetic retinopathy. Middle East Afr. J. Ophthalmol. 2013. Vol. 20. № 4. P. 293-300.
- Ametov A.S., Kurochkin I.O., Zubkov A.A. Saharnyj diabet i serdechno-sosudistye zabolevaniya. Russkij medicinskij zhurnal. 2014. № 13. S. 954-959. [in Russian] [Elektronnyj resurs]
- Vorob’eva I.V., Repkina M.Yu. Prakticheskie rekomendacii o nablyudenii bol’nyh s diabeticheskoj retinopatiej. Russkij medicinskij zhurnal. 2009. № 24. Rezhim dostupa: http://www.rmj.ru/articles_6912.htm [in Russian] [Elektronnyj resurs]
- Dedov I.I., Shestakova M.V., Milen’kaya T.M. Saharnyj diabet: retinopatiya, nefropatiya. M.: Medicina, 2001. 176 s. [in Russian]
- Komіsarenko Yu.І. Korekcіya vіtamіnom D3 porushen’ metabolіchnih procesіv u pacієntіv іz cukrovim dіabetom 1-go ta 2-go tipіv. Ukraїns’kij bіohіmіchnij zhurnal. 2014. T. 86. № 1. S. 111-116. [in Ukrainian]
- Bel’gov A.Yu. Hronicheskie oslozhneniya saharnogo diabeta. Chast’ 1. Sosudistye oslozhneniya saharnogo diabeta. Novye Sankt-Peterburgskie vrachebnye vedomosti. 2013. T. 63. № 1. S. 13-20. [in Russian]
- Gendeleka G.F. Preventivnaya diabetologiya. Odessa: VMV, 2013. 608 s. [in Russian]
- Golivec T.P., Kuz’mina O.A., Dmitrieva T.V. Hronicheskie sosudistye oslozhneniya saharnogo diabeta (patogenez, diagnostika, lechenie, mediko-social’naya ekspertiza i reabilitaciya): ucheb. posobie dlya samostoyat. Podgotovki. Belgorod: IPK NIU “BelGU”, 2011. 60 s. [in Russian]
- Ivanova N.V., Yarosheva L.M., Yarosheva N.A. Konservativnoe lechenie diabeticheskoj retinopatii. Oftal’mologiya. Vostochnaya Evropa. 2014. № 1. S. 141-151. [in Russian]
- Skripnik N.V., Grib V.A., Dіdushko O.M. Osoblivostі patogenezu ta lіkuvannya dіabetichnoї avtonomnoї nejropatії (oglyad lіteraturi). Lіki Ukraїni. 2012. № 2. S. 6-14. [in Ukrainian]
- Tron’ko M.D., Pan’kіv V.І. Klіnіchna efektivnіst' ta organіzacіya programi skrinіngu cukrovogo dіabetu v Kolomijs’komu rajonі Іvano-Frankіvs’koї oblastі. Endokrinologіya. 2005. T. 10. № 1. S. 5-13. [in Ukrainian]
- Zhaboedov G.D., Sidorova M.V., Skripnik R.L. Nekotorye aspekty patogeneza diabeticheskoj retinopatii. Mezhdunarodnyj zhurnal. 2000. № 1. S. 46-49. [in Russian]
- Naumenko V.A. Integral’naya sistema rannej diagnostiki neproliferativnoj diabeticheskoj retinopatii. Eksperimental’na ta klіnіchna fіzіologіya і bіohіmіya. 2010. № 2. S. 98-103. [in Russian]
- Abhary S., Hewitt A.W., Burdon K.P., Craid J.E. A systematic meta-analysis of genetic association studies for diabetic retinopathy. Diabetes. 2009. Vol. 58. № 9. P. 2137-2147.
- Buraczynska M., Ksiazek P., Baranowicz-Gaszczyk I., Jozwiak L. Association of the VEGF gene polymorphism with diabetic retinopathy in type 2 diabetes patients. Nephrol. Dial. Transplant. 2007. Vol. 22. № 3. Р. 827-32.
- Kuo J.Z., Wong T.Y., Rotter J.I. Challenges in elucidating the genetics of diabetic retinopathy. JAMA Ophthalmol. 2014. Vol. 132. № 1. P. 96-107.
- Yau J.W., Rogers S.L., Kawasaki R. [et al.]. Global prevalence and major risk factors of diabetic retinopathy. Diabetes Care. 2012. Vol. 35. № 3. P. 556-564.
- Tarr J.M., Kaul K., Chopra M. [et al.]. Pathophysiology of diabetic retinopathy. ISRN Ophthalmol. 2013. e343560.
- Velichko P.B., Osmanov E.M. Sovremennye metodicheskie podhody k lecheniyu diabeticheskoj retinopatii. Vestnik TGU. 2013. T. 18. Vyp. 6. S. 3248-3249. [in Russian]
- Mohort T.V. Diabeticheskaya retinopatiya: tochka zreniya endokrinologa, osnovannaya na rezul’tatah mnogocentrovyh issledovanij. Oftal’mologiya. Vostochnaya Evropa. 2012. № 4. S. 102-118. [in Russian]
- Li Q., Verna A., Han P.Y. [et al.]. Diabetic eNOS-knockout mice develop accelerated retinopathy. Invest. Ophthalmol. Vis. Sci. 2012. Vol. 51. № 10. P. 5240-6.
- Wong T.Y., Klein R., Klein B.E. [et al.]. Retinal microvascular abnormalities and their relationship with hypertension, cardiovascular disease, and mortality. Surv. Ophthalmol. 2001. Vol. 46. P. 59-80.
- Sladek R., Rocheleau G., Rung J. [et al.]. A genome-wide association study identifies novel risk loci for type 2 diabetes. Nature. 2007. Vol. 445. P. 881-885.
- Abhary S., Burdon K.P., Laurie K.J. [et al.]. Aldose reductase gene polymorphisms and diabetic retinopathy susceptibility. Diabetes Care. 2010. Vol. 33. № 8. P. 1834-6.
- Balasubbu S., Sundaresan P., Rajedran A. [et al.]. Association of nine candidate gene polymorphisms in Indian patients with type 2 diabetic retinopathy. BMC Med. Genet. 2012. Vol. 10. № 11. P. 158.
- Kaidonis G., Abhary S., Daniell M. [et al.]. Genetic study of diabetic retinopathy: recruitment methodology and analysis of baseline characteristics. Clin. Experiment. Ophthalmol. 2014. Vol. 42. № 5. P. 486-93.
- Hietala K., Forsblom C., Summanen P., Groop P.H. Heritability of proliferative diabetic retinopathy. Diabetes. 2008. Vol. 57. P. 2176-2180.
- Arar N.H., Freedman B.I., Adler S.G. [et al.]. Heritability of the severity of diabetic retinopathy the FIND-Eye study. Invest. Ophthalmol. Vis. Sci. 2008. Vol. 49. P. 3839-3845.
- Ma Z.J., Chen R., Ren H.Z. [et al.]. Association between eNOS 4b/a polymorphism and the risk of diabetic retinopathy in type 2 diabetes mellitus: a meta-analysis. J. Diabetes Res. 2014. [Electronic resource]. Access mode: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4033540/
- Cooke J.N., Ng M.C.Y., Palmer N.D. [et al.]. Genetic risk assessment of type 2 diabetes-associated polymorphisms in african americans. Diabetes Care. 2012. Vol. 35. № 2. P. 287-292.

/32.jpg)