Международный эндокринологический журнал Том 18, №5, 2022
Вернуться к номеру
Езетиміб і цукровий діабет: нова стратегія зниження рівня холестерину
Авторы: Сергієнко В.О., Сергієнко О.О.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Цукровий діабет (ЦД) — загальновизнаний чинник ризику серцево-судинних захворювань, тому деяким пацієнтам із групи високого ризику необхідний «агресивний» терапевтичний підхід. Холестерин (ХС) ліпопротеїнів низької щільності (ЛПНЩ) є провідним модифікованим чинником ризику розвитку атеросклеротичних серцево-судинних захворювань (АССЗ). Відомо, що статини — золотий стандарт для контролю вмісту ХС ЛПНЩ і зниження ризиків, пов’язаних з АССЗ; однак багато пацієнтів не досягають цільового рівня ХС ЛПНЩ або не можуть вживати препарати цього класу через асоційовані з ними побічні дії. Нещодавні дослідження нестатинових лікарських засобів, що знижують концентрацію холестерину (езетиміб, інгібітори пропротеїнової конвертази субтилізин-кексинового типу 9), продемонстрували переваги в лікуванні АССЗ; і нові препарати (бемпедоєва кислота, інклісиран) дали багатообіцяючі результати в доклінічних і клінічних дослідженнях. Нові дані свідчать про те, що езетиміб як доповнення до статинів забезпечує додатковий кардіопротекторний ефект. Цей огляд має на меті обговорити місце езетимібу в терапії хворих на ЦД з дисліпопротеїнеміями і розглянути його ефективність і безпеку. Комбіноване використання низькоінтенсивної або помірноінтенсивної терапії статинами й езетимібом задіює два комплементарних один щодо одного механізми: зниження внутрішньоклітинної концентрації ХС з посиленням захоплення ХС ЛПНЩ гепатоцитами і зниження абсорбції ХС у кишечнику. Ці механізми діють синергічно й можуть забезпечити такий же сумарний ефект, як і при використанні високоінтенсивної терапії статинами. Безпека комбінованої терапії еквівалентна безпеці монотерапії інгібіторами ГМГ-КoА-редуктази в аналогічних дозах. Ця комбінація, як правило, переноситься краще, ніж високі дози інгібіторів ГМГ-КоА-редуктази, і має переваги у хворих з ризиком розвитку міопатії і статин-індукованого ЦД 2-го типу. Отже, попри деякі застереження, езетиміб залишається препаратом вибору в арсеналі фармакологічних агентів.
Diabetes mellitus is a well-recognized risk factor for cardiovascular diseases, so an “aggressive” therapeutic approach is necessary for some high-risk patients. Low-density lipoprotein (LDL) cholesterol is the leading modifiable risk factor for the development of atherosclerotic cardiovascular diseases (ACVD). It is known that statins are the gold standard to control LDL cholesterol and reduce the risks associated with ACVD; however, many patients do not achieve their LDL cholesterol target or are unable to use this class of drugs due to associated side effects. Recent studies of non-statin cholesterol-lowering drugs (ezetimibe, proprotein convertase subtilisin/kexin type 9 inhibitors) have demonstrated benefits in the treatment of ACVD, and new drugs (bempedoic acid, inclisiran) have shown promising results in preclinical and clinical studies. New evidence suggests that prescription of ezetimibe as an addition to statins provides an additional cardioprotective effect. This review aims to discuss the role of ezetimibe in the treatment of patients with diabetes mellitus and dyslipoproteinemia and to consider its efficacy and safety. The combined use of low- or moderate-intensity therapy with statins and ezetimibe involves two complementary mechanisms: a decrease in the intracellular concentration of cholesterol with increased uptake of LDL cholesterol by hepatocytes and a decrease in cholesterol absorption in the intestines. These mechanisms act synergistically and can provide the same overall effect as when using high-intensity statin therapy. The safety of combined therapy is equivalent to that of monotherapy with HMG-CoA reductase inhibitors in similar doses. This combination is generally better tolerated than high doses of HMG-CoA reductase inhibitors and has advantages in patients at risk of myopathy and statin-induced type 2 diabetes. Thus, despite some caveats, ezetimibe remains the drug of choice in the arsenal of pharmacological agents.
цукровий діабет; езетиміб; огляд
diabetes mellitus; ezetimibe; review
- Sabatine M.S., Giugliano R.P., Keech A.C., Honarpour N., Wiviott S.D., Murphy S.A., Kuder J.F. et al.; FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N. Engl. J. Med. 2017 May 4. 376(18). 1713-1722. doi: 10.1056/NEJMoa1615664.
- Joseph J.J., Deedwania P., Acharya T., Aguilar D., Bhatt D.L., Chyun D.A., Di Palo K.E. et al.; American Heart Association Diabetes Committee of the Council on Lifestyle and Cardiometabolic Health; Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Clinical Cardiology; and Council on Hypertension. Comprehensive Management of Cardiovascular Risk Factors for Adults With Type 2 Diabetes: A Scientific Statement From the American Heart Association. Circulation. 2022 Mar. 145(9). e722-e759. doi: 10.1161/CIR.0000000000001040.
- Veilleux A., Grenier E., Marceau P., Carpentier A.C., Richard D., Levy E. Intestinal lipid handling: evidence and implication of insulin signaling abnormalities in human obese subjects. Arterioscler. Thromb. Vasc. Biol. 2014 Mar. 34(3). 644-653. doi: 10.1161/ATVBAHA.113.302993.
- Sahebkar A., Simental-Mendía L.E., Pedone C., Ferretti G., Nachtigal P., Bo S., Derosa G. et al. Statin therapy and plasma free fatty acids: a systematic review and meta-analysis of controlled clinical trials. Br. J. Clin. Pharmacol. 2016 May. 81(5). 807-818. doi: 10.1111/bcp.12854.
- Cai R., Yuan Y., Sun J., Xia W., Huang R., Tian S., Dong X. et al. Statins worsen glycemic control of T2DM in target LDL-c level and LDL-c reduction dependent manners: a meta-analysis. Expert Opin. Pharmacother. 2016 Oct. 17(14). 1839-1849. doi: 10.1080/14656566.2016.1220539.
- Cui J.Y., Zhou R.R., Han S., Wang T.S., Wang L.Q., Xie X.H. Statin therapy on glycemic control in type 2 diabetic patients: A network meta-analysis. J. Clin. Pharm. Ther. 2018 Aug. 43(4). 556-570. doi: 10.1111/jcpt.12690.
- Mach F., Baigent C., Catapano A.L., Koskinas K.C., Casula M., Badimon L., Chapman M.J. et al. ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur. Heart J. 2020 Jan 1. 41(1). 111-188. doi: 10.1093/eurheartj/ehz455.
- Serhiyenko V.A., Serhiyenko A.A. Diabetes and Cardiovascular Diseases. Lviv: Kvart, 2022. 352 с. ISBN 978-617-7196-32-6. (in Ukrainian)
- Dormuth C.R., Filion K.B., Paterson J.M., James M.T., Teare G.F., Raymond C.B., Rahme E. et al.; Canadian Network for Observational Drug Effect Studies Investigators. Higher potency statins and the risk of new diabetes: multicentre, observational study of administrative databases. BMJ. 2014 May 29. 348. g3244. doi: 10.1136/bmj.g3244.
- Sakamoto K., Kawamura M., Kohro T., Omura M., Watanabe T., Ashidate K., Horiuchi T. et al.; RESEARCH Study Group. Effect of Ezetimibe on LDL-C Lowering and Atherogenic Lipoprotein Profiles in Type 2 Diabetic Patients Poorly Controlled by Statins. PLoS One. 2015 Sep 23. 10(9). e0138332. doi: 10.1371/journal.pone.0138332.
- Tsunoda F., Asztalos I.B., Horvath K.V., Steiner G., Schaefer E.J., Asztalos B.F. Fenofibrate, HDL, and cardiovascular disease in Type-2 diabetes: The DAIS trial. Atherosclerosis. 2016 Apr. 247. 35-39. doi: 10.1016/j.atherosclerosis.2016.01.028.
- Bardolia C., Amin N.S., Turgeon J. Emerging Non-statin Treatment Options for Lowering Low-Density Lipoprotein Cholesterol. Front. Cardiovasc. Med. 2021 Nov 17. 8. 789931. doi: 10.3389/fcvm.2021.789931.
- De Luca L., Corsini A., Uguccioni M., Colivicchi F. Statins plus ezetimibe in the era of proprotein convertase subtilisin/kexin type 9 inhibitors. Kardiol. Pol. 2020 Sep 25. 78(9). 850-860. doi: 10.33963/KP.15529.
- Le N.A., Tomassini J.E., Tershakovec A.M., Neff D.R., Wilson P.W. Effect of Switching From Statin Monotherapy to Ezetimibe/Simvastatin Combination Therapy Compared With Other Intensified Lipid-Lowering Strategies on Lipoprotein Subclasses in Diabetic Patients With Symptomatic Cardiovascular Disease. J. Am. Heart Assoc. 2015 Oct 20. 4(10). e001675. doi: 10.1161/JAHA.114.001675.
- Chang S.H., Wu L.S., Lee C.H., Kuo C.T., Liu J.R., Wen M.S., Chen W.J. et al. Simvastatin-ezetimibe combination therapy is associated with a lower rate of major adverse cardiac events in type 2 diabetics than high potency statins alone: A population-based dynamic cohort study. Int. J. Cardiol. 2015. 190. 20-25. doi: 10.1016/j.ijcard.2015.04.121.
- Liu C.H., Chen T.H., Lin M.S., Hung M.J., Chung C.M., Cherng W.J., Lee T.H. et al. Ezetimibe-Simvastatin Therapy Reduce Recurrent Ischemic Stroke Risks in Type 2 Diabetic Patients. J. Clin. Endocrinol. Metab. 2016 Aug. 101(8). 2994-3001. doi: 10.1210/jc.2016-1831.
- Ahmed O., Littmann K., Gustafsson U., Pramfalk C., Öörni K., Larsson L., Minniti M.E. et al. Ezetimibe in Combination With Simvastatin Reduces Remnant Cholesterol Without Affecting Biliary. J. Am. Heart Assoc. 2018. 7(24). e009876.
- Huang Z., Li Q., Ye W., Zhang Q., Li X. Efficacy and Safety of Ezetimibe in Combination with Atorvastatin for Acute Coronary Syndrome Patients Accompanied with Type 2 Diabetes: A Single-Center, Non-randomized Cohort Study. Chem. Pharm. Bull. (Tokyo). 2019. 67(5). 419-425. doi: 10.1248/cpb.c18-00685.
- Hwang Y.C., Jun J.E., Jeong I.K., Ahn K.J., Chung H.Y. Comparison of the Efficacy of Rosuvastatin Monotherapy 20 mg with Rosuvastatin 5 mg and Ezetimibe 10 mg Combination Therapy on Lipid Parameters in Patients with Type 2 Diabetes Mellitus. Diabetes Metab. J. 2019 Oct. 43(5). 582-589. doi: 10.4093/dmj.2018.0124.
- Miao X.Y., Liu H.Z., Jin M.M., Sun B.R., Tian H., Li J., Li N. et al. A comparative meta-analysis of the efficacy of statin-ezetimibe co-therapy versus statin monotherapy in reducing cardiovascular and cerebrovascular adverse events in patients with type 2 diabetes mellitus. Eur. Rev. Med. Pharmacol. Sci. 2019 Mar. 23(5). 2302-2310. doi: 10.26355/eurrev_201903_17279.
- Hammersley D., Signy M. Ezetimibe: an update on its clinical usefulness in specific patient groups. Ther. Adv. Chronic. Dis. 2017 Jan. 8(1). 4-11. doi: 10.1177/2040622316672544.
- Ciriacks K., Coly G., Krishnaswami S., Patel S.B., Kidambi S. Effects of simvastatin and ezetimibe in lowering low-density lipoprotein cholesterol in subjects with type 1 and type 2 diabetes mellitus. Metab. Syndr. Relat. Disord. 2015. 13(2). 84-90. doi: 10.1089/met.2014.0114.
- Pradhan A., Bhandari M., Sethi R. Ezetimibe, and Improving Cardiovascular Outcomes: Current Evidence and Perspectives. Cardiol. Res Pract. 2020 Jun 28. 2020. 9815016. doi: 10.1155/2020/9815016.
- Huang C.S., Yu X., Fordstrom P., Choi K., Chung B.C., Roh S.H., Chiu W. et al. Cryo-EM structures of NPC1L1 reveal mechanisms of cholesterol transport and ezetimibe inhibition. Sci Adv. 2020 Jun 19. 6(25). eabb1989. doi: 10.1126/sciadv.abb1989.
- Cosentino F., Grant P.J., Aboyans V., Bailey C.J., Ceriello A., Delgado V., Federici M. et al.; ESC Scientific Document Group. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur. Heart J. 2020 Jan 7. 41(2). 255-323. doi: 10.1093/eurheartj/ehz486.
- Jellinger P.S. American Association of Clinical Endocrinologists/American College of Endocrinology Management of Dyslipidemia and Prevention of Cardiovascular Disease Clinical Practice Guidelines. Diabetes Spectr. 2018 Aug. 31(3). 234-245. doi: 10.2337/ds18-0009.
- Giugliano R.P., Cannon C.P., Blazing M.A., Nicolau J.C., Corbalán R., Špinar J., Park J.G. et al.; IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial) Investigators. Benefit of Adding Ezetimibe to Statin Therapy on Cardiovascular Outcomes and Safety in Patients With Versus Without Diabetes Mellitus: Results From IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial). Circulation. 2018 Apr 10. 137(15). 1571-1582. doi: 10.1161/CIRCULATIONAHA.117.030950.
- Nakamura A., Sato K., Kanazawa M., Kondo M., Endo H., Takahashi T., Nozaki E. Impact of decreased insulin resistance by ezetimibe on postprandial lipid profiles and endothelial functions in obese, non-diabetic-metabolic syndrome patients with coronary artery disease. Heart Vessels. 2019 Jun. 34(6). 916-925. doi: 10.1007/s00380-018-1319-x.
- Cannon C.P., Blazing M.A., Giugliano R.P., McCagg A., White J.A., Theroux P., Darius H. et al.; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N. Engl. J. Med. 2015 Jun 18. 372(25). 2387-2397. doi: 10.1056/NEJMoa1410489.
- Rudofsky G., Reismann P., Groener J.B., Djuric Z., Fleming T., Metzner C., Grafe I.A. et al. Identical LDL-cholesterol lowering but non-identical effects on NF-κB activity: High dose simvastatin vs combination therapy with ezetimibe. Atherosclerosis. 2012 Jul. 223(1). 190-196. doi: 10.1016/j.atherosclerosis.2012.04.003.
- Wang J., Ai X.B., Wang F., Zou Y.W., Li L., Yi X.L. Efficacy of ezetimibe combined with atorvastatin in the treatment of carotid artery plaque in patients with type 2 diabetes mellitus complicated with coronary heart disease. Int. Angiol. 2017 Oct. 36(5). 467-473. doi: 10.23736/S0392-9590.17.03818-4.
- Yang Y.J., Lee S.H., Kim B.S., Cho Y.K., Cho H.J., Cho K.I., Kim S.Y. et al. Combination Therapy of Rosuvastatin and Ezetimibe in Patients with High Cardiovascular Risk. Clin. Ther. 2017 Jan. 39(1). 107-117. doi: 10.1016/j.clinthera.2016.11.014.
- Swindle J.P., Ye X., Mallick R., Song R., Horstman T., Bays H.E. Colesevelam, Ezetimibe, and Patients With Type 2 Diabetes Mellitus: Characteristics and Clinical Outcomes From a Health Care Database. Ann. Pharmacother. 2014 Jul. 48(7). 847-855. doi: 10.1177/1060028014531737.
- Krysiak R., Zmuda W., Okopien B. The effect of simvastatin-ezetimibe combination therapy on adipose tissue hormones and systemic inflammation in patients with isolated hypercholesterolemia. Cardiovasc. Ther. 2014 Apr. 32(2). 40-46. doi: 10.1111/1755-5922.12057.
- Rizos C.V., Kostapanos M.S., Rizos E.C., Tselepis A.D., Elisaf M.S. The effect of rosuvastatin on low-density lipoprotein subfractions in patients with impaired fasting glucose. J. Cardiovasc. Pharmacol. Ther. 2015 May. 20(3). 276-283. doi: 10.1177/1074248414549419.
- Kim K.J., Kim S.H., Yoon Y.W., Rha S.W., Hong S.J., Kwak C.H., Kim W. et al. Effect of fixed-dose combinations of ezetimibe plus rosuvastatin in patients with primary hypercholesterolemia: MRS-ROZE (Multicenter Randomized Study of ROsuvastatin and eZEtimibe). Cardiovasc. Ther. 2016 Oct. 34(5). 371-382. doi: 10.1111/1755-5922.12213.
- Tsunoda T., Nozue T., Yamada M., Mizuguchi I., Sasaki M., Michishita I. Effects of ezetimibe on atherogenic lipoproteins and glucose metabolism in patients with diabetes and glucose intolerance. Diabetes Res Clin. Pract. 2013 Apr. 100(1). 46-52. doi: 10.1016/j.diabres.2012.12.026.
- Saito I., Azuma K., Kakikawa T., Oshima N., Hanson M.E., Tershakovec A.M. A randomized, double-blind, placebo-controlled study of the effect of ezetimibe on glucose metabolism in subjects with type 2 diabetes mellitus and hypercholesterolemia. Lipids Health Dis. 2015 May 1. 14. 40. doi: 10.1186/s12944-015-0036-z.
- Zafrir B., Jain M. Lipid-lowering therapies, glucose control and incident diabetes: evidence, mechanisms, and clinical implications. Cardiovasc. Drugs Ther. 2014 Aug. 28(4). 361-77. doi: 10.1007/s10557-014-6534-9.
- Wu H., Shang H., Wu J. Effect of ezetimibe on glycemic control: a systematic review and meta-analysis of randomized controlled trials. Endocrine. 2018 May. 60(2). 229-239. doi: 10.1007/s12020-018-1541-4.
- Chang E., Kim L., Choi J.M., Park S.E., Rhee E.J., Lee W.Y., Oh K.W. et al. Ezetimibe stimulates intestinal glucagon-like peptide 1 secretion via the MEK/ERK pathway rather than dipeptidyl peptidase 4 inhibition. Metabolism. 2015 May. 64(5). 633-641. doi: 10.1016/j.metabol.2015.02.001.
- Lee Y.B., Kim B., Han K., Kim J.A., Roh E., Hong S.H., Choi K.M. et al. Combination of Statin and Ezetimibe versus Statin Monotherapy on Cardiovascular Disease and Type 2 Diabetes Incidence among Adults with Impaired Fasting Glucose: a Propensity-Matched Nationwide Cohort Study. J. Lipid Atheroscler. 2021 Sep. 10(3). 303-312. doi: 10.12997/jla.2021.10.3.303.
- Barkas F., Elisaf M., Liberopoulos E., Klouras E., Liamis G., Rizos E.C. Statin therapy with or without ezetimibe and the progression to diabetes. J. Clin. Lipidol. 2016 Mar-Apr. 10(2). 306-313. doi: 10.1016/j.jacl.2015.11.015.
- Takeshita M., Tanaka A., Kawagushi A., Sato K., Toyoda S., Inoue T., Node K., On behalf of the EUCLID Study Investigators. The effect of switching from statin-monotherapy to statin/ezetimibe combination therapy on lipid profiles in patients with type 2 diabetes and dyslipidemia: a multicenter open-label study (EUCLID). Vasc. Fail. 2020 Jan. 4(1). 22-31. doi: 10.30548/vascfail.4.1_22.
- Shin K.H., Choi H.D. Comparison of Efficacy and Safety of Statin-Ezetimibe Combination Therapy with Statin Monotherapy in Patients with Diabetes: A Meta-Analysis of Randomized Controlled Studies. Am. J. Cardiovasc. Drugs. 2022 Jul. 22(4). 395-406. doi: 10.1007/s40256-021-00516-3.
- Torimoto K., Okada Y., Mori H., Hajime M., Tanaka K., Kurozumi A., Narisawa M. et al. Efficacy of combination of Ezetimibe 10 mg and rosuvastatin 2.5 mg versus rosuvastatin 5 mg monotherapy for hypercholesterolemia in patients with type 2 diabetes. Lipids Health Dis. 2013 Sep 22. 12. 137. doi: 10.1186/1476-511X-12-137.
- Sugiyama S., Jinnouchi H., Hieshima K., Kurinami N., Suzuki T., Miyamoto F., Kajiwara K. et al. A pilot study of ezetimibe vs. atorvastatin for improving peripheral microvascular endothelial function in stable patients with type 2 diabetes mellitus. Lipids Health Dis. 2015 Apr 23. 14. 37. doi: 10.1186/s12944-015-0028-z.
- Inazawa T., Sakamoto K., Kohro T., Iijima R., Kitazawa T., Hirano T., Kawamura M. et al.; RESEARCH Study Group. RESEARCH (Recognized effect of Statin and ezetimibe therapy for achieving LDL-C Goal), a randomized, doctor-oriented, multicenter trial to compare the effects of higher-dose statin versus ezetimibe-plus-statin on the serum LDL-C concentration of Japanese type-2 diabetes patients design and rationale. Lipids Health Dis. 2013 Oct 5. 12. 142. doi: 10.1186/1476-511X-12-142.
- Sakamoto K., Kawamura M., Watanabe T., Ashidate K., Kohro T., Tanaka A., Mori Y. et al.; RESEARCH Study Group. Effect of ezetimibe add-on therapy over 52 weeks extension analysis of prospective randomized trial (RESEARCH study) in type 2 diabetes subjects. Lipids Health Dis. 2017 Jun 24. 16(1). 122. doi: 10.1186/s12944-017-0508-4.
- Tsujita K., Sugiyama S., Sumida H., Shimomura H., Yamashita T., Yamanaga K., Komura N. et al.; PRECISE-IVUS Investigators. Impact of Dual Lipid-Lowering Strategy with Ezetimibe and Atorvastatin on Coronary Plaque Regression in Patients With Percutaneous Coronary Intervention: The Multicenter Randomized Controlled PRECISE-IVUS Trial. J. Am. Coll. Cardiol. 2015 Aug 4. 66(5). 495-507. doi: 10.1016/j.jacc.2015.05.065.
- Razzack A., Ahmed F., Thompson A., Mandava S., Abraham V.A., Panday P., Pacha F. Synergistic effect of ezetimibe and statin on lipoproteins in patients with type 2 diabetes mellitus-a systematic review and meta-analysis. J. Am. Coll. Cardiol. 2021 May. 77 (18 Suppl. 1). 1618. doi: 10.1016/S0735-1097(21)02975-2.
- Hong N., Lee Y.H., Tsujita K., Gonzalez J.A., Gonzalez J.A., Kramer C.M., Kovarnik T., Kouvelos G.N. et al. Comparison of the Effects of Ezetimibe-Statin Combination Therapy on Major Adverse Cardiovascular Events in Patients with and without Diabetes: A Meta-Analysis. Endocrinol. Metab. (Seoul). 2018 Jun. 33(2). 219-227. doi: 10.3803/EnM.2018.33.2.219.
- Yu M., Liang C., Kong Q., Wang Y., Li M. Efficacy of combination therapy with ezetimibe and statins versus a double dose of statin monotherapy in participants with hypercholesterolemia: a meta-analysis of literature. Lipids Health Dis. 2020 Jan 4. 19(1). 1. doi: 10.1186/s12944-019-1182-5.
- Zhu Y., Hu H., Yang J., Yao Q., Xu H., Yu Y., Liu T. et al. The efficacy and safety of statin in combination with ezetimibe compared with double-dose statin in patients with high cardiovascular risk: A meta-analysis. Bosn. J. Basic Med. Sci. 2020 May 1. 20(2). 169-182. doi: 10.17305/bjbms.2019.4437.
- Visseren F.L.J., Mach F., Smulders Y.M., Carballo D., Koskinas K.C., Bäck M., Benetos A. et al.; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur. Heart J. 2021 Sep 7. 42(34). 3227-3237. doi: 10.1093/eurheartj/ehab484.
- Grundy S.M., Stone N.J., Bailey A.L., Beam C., Birtcher K.K., Blumenthal R.S., Braun L.T. et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019. 139. e1082-e1143. doi: 10.1161/CIR.0000000000000625.
- Luo L., Yuan X., Huang W., Ren F., Zhu H., Zheng Y., Tang L. Safety of coadministration of ezetimibe and statins in patients with hypercholesterolaemia: a meta-analysis. Intern. Med. J. 2015 May. 45(5). 546-557. doi: 10.1111/imj.12706.
- Nishikido T., Oyama J., Keida T., Ohira H., Node K. High-dose statin therapy with rosuvastatin reduces small dense LDL and MDA-LDL: The Standard versus high-dose therApy with Rosuvastatin for lipiD lowering (SARD) trial. J. Cardiol. 2016 Apr. 67(4). 340-346. doi: 10.1016/j.jjcc.2015.05.017.
- Guimarães E.S., Cerda A., Dorea E.L., Bernik M.M.S., Gusukuma M.C., Pinto G.A., Fajardo C.M. et al. Effects of short-term add-on ezetimibe to statin treatment on expression of adipokines and inflammatory markers in diabetic and dyslipidemic patients. Cardiovasc. Ther. 2017 Dec. 35(6). e12307. doi: 10.1111/1755-5922.12307.
- Rhee E.J. Recent dyslipidemia guidelines for patients with diabetes mellitus. Precis Future Med. 2020. 4(4). 133-140. doi: 10.23838/pfm.2020.00100.

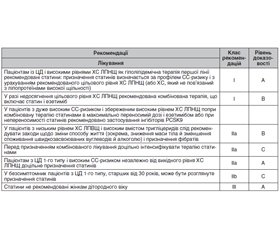
/65.jpg)
/64.jpg)
/65_2.jpg)
/66.jpg)
/67.jpg)
/71.jpg)
/72.jpg)