Журнал «Медицина неотложных состояний» Том 18, №4, 2022
Вернуться к номеру
Патофізіологічні особливості онкохворих дітей. Що повинен знати та контролювати анестезіолог перед операцією
Авторы: Снісарь В.І., Миронов Д.В.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
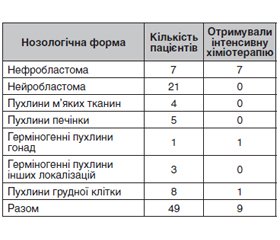
Актуальність. У цій статті подано огляд літератури щодо деяких патофізіологічних особливостей онкохворих дітей та дані власних спостережень. Педіатричні пацієнти, хворі на рак, піддаються безлічі операцій і процедур, тому знання всіх особливостей дитячого організму перед анестезією буде визначати їх інтраопераційну стабільність і зводити до мінімуму можливі ускладнення. Анестезіологічна допомога немовлятам та дітям з онкологією вимагає підвищеної уваги до фізіологічних та психологічних змін, що відбуваються внаслідок їх захворювання та лікування. Це потребує іншого періопераційного підходу, ніж у дітей з неонкологічною патологією. Мета дослідження: оцінити вихідний стан гемодинаміки, вегетативної нервової системи, стресової реакції та запальної відповіді у дітей з онкологічною патологією у передопераційному періоді. Матеріали та методи. Нами було обстежено 49 дітей з онкологічною патологією віком 9,02 ± 6,05 року, які надійшли на лікування до КП «Дніпропетровська обласна дитяча клінічна лікарня» ДОР у період 2019–2021 років. Для порівняння досліджуваних показників додатково було обстежено групу дітей, яким планувалося оперативне лікування з приводу травматологічної патології (49 дітей порівнянного з першою групою віку). Досліджувалися показники гемодинаміки: частота серцевих скорочень, артеріальний тиск, систолічний, діастолічний, середній, пульсовий тиск, ударний об’єм, хвилинний об’єм крові, загальний периферичний опір судин. Активність вегетативної нервової системи вимірювали на основі варіабельності серцевого ритму. Крім кількості циркулюючих клітин крові, включаючи нейтрофіли, лімфоцити, тромбоцити, визначали рівень кортизолу, С-реактивного білка та інтерлейкінів (IL-6, TNF). Результати. Передопераційний стан у дітей з онкологічною патологією мало чим відрізняється від пацієнтів із травматологічною патологією як за клінічним аналізом крові, так і за гемодинамічними показниками. Профіль стресових реакцій на майбутнє оперативне лікування був більш виражений у дітей з онкологією, що підтверджувалося стійким сплеском кортизолу та зниженим рівнем дуже низькочастотних показників кардіоінтервалограми. А підвищення рівня прозапальних цитокінів можна пояснити наявністю хронічного запалення в дітей із раком. Висновки. Майбутні режими анестезії повинні оптимізувати модуляцію реакцій на стрес, і для її безпеки у педіатричних пацієнтів важливо знайти точні маркери можливого дистресу.
Background. This article presents a literature review on some pathophysiological features of children with cancer and data from our own observations. Pediatric cancer patients undergo many surgeries and procedures, so knowledge of all the features of the child’s body before anesthesia will determine their intraoperative stability and minimize possible complications. Anesthetic care for infants and children with oncology requires increased attention to the physiological and psychological changes that occur as a result of their disease and treatment. This requires a perioperative approach other than in children with non-cancerous pathology. Consequently, our purpose was to assess the initial state of hemodynamics, autonomic nervous system, stress response and inflammatory response in children with cancer in the preoperative period. Materials and methods. We examined 49 children with oncological pathology aged 9.02 ± 6.05 years, who were treated at the Dnipro Regional Children’s Clinical Hospital of DRC in 2019–2021. To compare the studied parameters, a group of children preparing to the elective surgical treatment for traumatic pathology was additionally examined; it included 49 patients of similar age. Parameters of hemodynamics (heart rate, systolic, diastolic blood pressure, mean arterial pressure, pulse pressure, stroke volume, cardiac output, systemic vascular resistance) were studied. The activity of the autonomic nervous system was measured based on heart rate variability. In addition to the number of circulating blood cells, including neutrophils, lymphocytes, platelets, the levels of cortisol, C-reactive protein, interleukin 6 and tumor necrosis factor α were determined. Results. The preoperative condition of children with cancer differs a little from that of patients with trauma pathology, both in terms of clinical blood tests and hemodynamic parameters. The profile of stress responses to future surgical treatment was more pronounced in children with oncology, as evidenced by a persistent surge in cortisol and reduced levels of very low-frequency components of cardiointervalogram. And an increase in proinflammatory cytokines can be explained by the presence of chronic inflammation in children with cancer. Conclusions. Future anesthesia regimens should optimize the modulation of stress responses, and for its safety it is important to find accurate markers of possible distress in pediatric patients.
діти; онкологічне захворювання; стрес; передопераційний стан
children; cancer; stress; preoperative condition
Вступ
Матеріали та методи
/38.jpg)
Результати та обговорення
Висновки
- Anghelescu D.L., Burgoyne L.L., Liu W. et al. Safe anesthesia for radiotherapy in pediatric oncology: St. Jude Children’s Research Hospital Experience. 2004–2006. Int. J. Radiat. Oncol. Biol. Phys. 2008. Vol. 71(2). P. 491-497. doi: 10.1016/j.ijrobp.2007.09.044.
- Latham G.J., Greenberg R.S. Anesthetic considerations for the pediatric oncology patient — part 1: a review of antitumor therapy. Paediatr. Anaesth. 2010. Vol. 20(4). P. 295-304. doi: 10.1111/j.1460-9592.2010.03257.x.
- King D.R., Patrick L.E., Ginn-Pease M.E. et al. Pulmonary function is compromised in children with mediastinal lymphoma. J. Pediatr. Surg. 1997. Vol. 32(2). P. 294-299. doi: 10.1016/s0022-3468(97)90197-4.
- Meyer S., Reinhard H., Gottschling S., Nunold H., Graf N. Pulmonary dysfunction in pediatric oncology patients. Pediatr. Hematol. Oncol. 2004. Vol. 21. P. 175-195. doi: 10.1080/08880010490272894.
- Nazemi K.J., Malempati S. Emergency department presentation of childhood cancer. Emerg. Med. Clin. North. Am. 2009. Vol. 27. P. 477-495. doi: 10.1016/j.emc.2009.04.008.
- Dalton H.J., Slonim A.D., Pollack M.M. Multicenter outcome of pediatric oncology patients requiring intensive care. Pediatr. Hematol. Oncol. 2003. Vol. 20. P. 643-649.
- Shibasaki M., Nakajima Y., Inami N., Shimizu F., Beppu S., Tanaka Y. Acute development of superior vena cava syndrome after pediatric cardiac surgery. Paediatr. Anaesth. 2008. Vol. 18. P. 997-998. doi: 10.1111/j.1460-9592.2008.02662.x.
- Bax K.N. Re: Thoracoscopic-assisted central line placement for a thrombosed superior vena cava. J. Pediatr. Surg. 2009. Vol. 44. P. 1672-1673. doi: 10.1016/j.jpedsurg.2009.03.043.
- Athale U.H., Chan A.K. Hemorrhagic complications in pediatric hematologic malignancies. Semin. Thromb. Hemost. 2007. Vol. 33. P. 408-415. doi: 10.1055/s-2007-976176.
- Kelly S., Wheatley D. Prevention of febrile neutropenia: use of granulocyte colony-stimulating factors. Br. J. Cancer. 2009. Vol. 101. P. S6-S10. doi: 10.1038/sj.bjc.6605269.
- Hack H.A., Wright N.B., Wynn R.F. The anaesthetic management of children with anterior mediastinal masses. Anaesthesia. 2008. Vol. 63(8). P. 837-846. doi: 10.1111/j.1365-2044.2008.05515.x.
- Slinger P., Karsli C. Management of the patient with a large anterior mediastinal mass: recurring myths. Curr. Opin. Anaesthesiol. 2007. Vol. 20(1). P. 1-3. doi: 10.1097/ACO.0b013e328011390b.
- Leerink J.M., Kok W.E.M., Vander Pal H.J.H., Kremer L.C.M. Cardiac Disease in Childhood Cancer Survivors: Risk Prediction, Prevention and Surveillance. JACC CardioOncol. 2020. Vol. 2(3). P 363-378. doi: 10.1016/j.jaccao.2020.08.006.
- Noje C., Cohen K., Jordan L.C. Hemorrhagican dischemic stroke in children with cancer. Pediatr. Neurol. 2013. Vol. 49(4). P. 237-242. doi: 10.1016/j.pediatrneurol.2013.04.009.
- Simbre V.C., Duffy S.A., Dadlani G.H. et al. Cardiotoxicity of cancer chemotherapy: implications for children. Paediatr. Drugs. 2005. Vol. 7(3). P. 187-202. doi: 10.2165/00148581-200507030-00005.
- Huettemann E., Sakka S.G. Anaesthesia and anti-cancer chemotherapeutic drugs. Curr. Opin. Anaesthesiol. 2005. Vol. 18(3). P. 307-314. doi: 10.1097/01.aco.0000169240.14056.19.
- Trobs R.B., Mader E., Friedrich T. et al. Oral tumors and tumor like lesions in infants and children. Pediatr. Surg. Int. 2003. Vol. 19. P. 639-645. doi: 10.1007/s00383-003-0983-8.
- Burke A., Virmani R. Pediatric heart tumors. Cardiovasc. Pathol. 2008. Vol. 17. P. 193-198. doi: 10.1016/j.carpath.2007.08.008.
- Adams M.J., Lipshultz S.E., Schwartz C. et al. Radiation-associated cardiovascular disease: manifestations and management. Semin. Radiat. Oncol. 2003. Vol. 13(3). P. 346-356. doi: 10.1016/S1053-4296(03)00026-2.
- Berry G.J., Jorden M. Pathology of radiation and anthracycline cardiotoxicity. Pediatr. Blood Cancer. 2005. Vol. 44(7). P. 630-637. doi: 10.1002/pbc.20346.
- Lewandowska A., Zych B., Katalin Papp K. et al. Problems, Stressors and Needs of Children and Adolescents with Cancer. Children. 2021. Vol. 8. P. 1173. doi: 10.3390/children8121173.
- Berger C., Casagranda L., Pichotetal V. Dysautonomia in Childhood Cancer Survivors: A Widely Underestimated Risk. Journal of Adolescent and Young Adult Oncology. 2018. Vol. 00. Р. 1-9. doi: 10.1089/jayao.2018.0021.
- Hockenberry-Eaton M., Kemp V., DiIorio C. Cancer stressors and protective factors: predictors of stress experienced during treatment for childhood cancer. Res. Nurs. Health. 1994. Vol. 17(5). P. 351-361. doi: 10.1002/nur.4770170506.
- Varni J.W., Katz E. Stress, social support and negative affectivity in children with newly diagnosed cancer: a prospective transactional analysis. Psychooncology. 1997. Vol. 6(4). P. 267-278. doi: 10.1002/(SICI)1099-1611(199712)6:4<267::AID-PON277>3.0.CO;2-O.
- Kazak A.E., Barakat L.P., Meeske K., Gallagher P., Cnaan A., Stuber M. Posttraumatic stress in survivors of childhood cancer and their mothers: Development and validation of the Impact of Traumatic Stressors Interview Schedule (ITSIS). Journal of Clinical Psychology in Medical Settings. 2001. Vol. 8(4). P. 307-323.
- Selye H. Stress and disease. Laryngoscope. 1955. Vol. 65. P. 514. doi: 10.1288/00005537-195507000-00002.
- McEwen B.S. The neurobiology of stress: From serendipity to clinical relevance. Brain Res. 2000. Vol. 886. P. 172-189. doi: 10.1016/s0006-8993(00)02950-4.
- Kaiser R.H., Clegg R., Goer F. et al. Childhood stress, grown-up brain networks: Corticolimbic correlates of threat-related early life stress and adult stress response. Psychol. Med. 2017. Vol. 48. P. 1157-1166. doi: 10.1017/S0033291717002628.
- Gleeson M., Bishop N., Walsh N. Exercise Immunology. Routledge; London, UK: 2013. 456 p.
- Dhabhar F.S. Effects of stress on immune function: The good, the bad, and the beautiful. Immunol. Res. 2014. Vol. 58. P. 193-210. doi: 10.1007/s12026-014-8517-0.
- Reiche E.M., Morimoto H.K., Nunes S.M. Stress and depression in duced immune dysfunction: implications for the development and progression of cancer. Int. Rev. Psychiatry. 2005. Vol. 17. P. 515-527. doi: 10.1080/02646830500382102.
- Mravec B., Gidron Y., Hulin I. Neurobiology of cancer: Interactions between nervous, endocrine and immune systems as a base for monitoring and modulating the tumorigenesis by the brain. Semin. Cancer Biol. 2008. Vol. 18. P. 150-163. doi: 10.1016/j.semcancer.2007.12.002.
- Iuvone L., Mariotti P., Colosimo C., Guzzetta F., Ruggiero A., Riccardi R. Long-term cognitive outcome, brain computed tomography scan, and magnetic resonance imaging in children cured for acute lymphoblastic leukemia. Cancer. 2002. Vol. 95. P. 2562-2570. doi: 10.1002/cncr.10999.
- Moleski M. Neuropsychological, Neuroanatomical, and Neurophysiological Consequences of CNS Chemotherapy for Acute Lymphoblastic Leukemia. Arch. Clin. Neuropsychol. Off J. Natl. Acad. Neuropsychol. 2000. Vol. 15. P. 603-630.
- Monje M., Thomason M.E., Rigolo L. et al. Functional and structural differences in the hippocampus associated with memory deficits in adult survivors of acute lymphoblastic leukemia. Pediatr. Blood Cancer. 2012. Vol. 60. P. 293-300. doi: 10.1002/pbc.24263.
- Lesnik P.G., Ciesielski K.T., Hart B.L., Benzel E.C., Sanders J.A. Evidence for Cerebellar-Frontal Subsystem Changes in Children Treated With Intrathecal Chemotherapy for Leukemia: Enhanced Data Analysis Using an Effect Size Model. Arch. Neurol. 1998. Vol. 55. P. 1561-1568. doi: 10.1001/archneur.55.12.1561.
- Ackerman R.S., Luddy K.A., Icard B.E. et al. The Effects of Anesthetics and Perioperative Medications on Immune Function: A Narrative Review. Anesth. Analg. 2021. Vol. 133(3). P. 676-689. doi: 10.1213/ANE.0000000000005607.
- Lim J.A., Oh C.S., Yoon T.G, Lee J.Y., Lee S.H., Yoo Y.B. The effect of propofol and sevoflurane on cancer cell, natural killer cell, and cytotoxic T lymphocyte function in patients undergoing breast cancer surgery: an in vitro analysis. BMC Cancer. 2018. Vol. 18(1). P. 159. doi: 10.1186/s12885-018-4064-8.
- Snyder G.L., Greenberg S. Effect of anaesthetic technique and other perioperative factors on cancer recurrence. Br. J. Anaesth. 2010. Vol. 105(2). P. 106-115. doi: 10.1093/bja/aeq164.
- Section on Anesthesiology Bridges Committee. Evaluation and preparation of pediatric patients undergoing anesthesia. American Academy of Pediatrics. Section on Anesthesiology. Pediatrics. 1996. Vol. 98. P. 502-508.
- Ketterl T.G., Latham G.J. Perioperative Cardiothoracic and Vascular Risk in Childhood Cancer and its Survivors. Journal of Cardiothoracic and Vascular Anesthesia. 2021. Vol. 35(1). P. 162-175. doi: 10.1053/j.jvca.2020.02.052.
- Gudaitytė J., Dvylys D., Šimeliūnaitė I. Anaesthetic challenges in cancer patients: current therapies and pain management. Acta. Med. Litu. 2017. Vol. 24(2). P. 121-127. doi: 10.6001/actamedica.v24i2.3493.
- Хаспекова Н. Б. Регуляция вариативности ритма сердца у здоровых и больных с психогенной и органической патологией мозга: дис. ... докт. мед. наук. Москва: Ин-т ВНД, 1996. 236 c.
- Баевский Р.М. Проблема оценки и прогнозирования функционального организма и ее развитие в космической медицине. Успехи физиологических наук. 2006. № 37. С. 42-57.
- Carpenter L.L., Gawuga C.E., Tyrka A.R. et al. Association between Plasma IL-6 Response to Acute Stress and Early-Life Adversity in Healthy Adults. Neuropsychopharmacology. 2010. Vol. 35(13). P. 2617-2623. doi: 10.1038/npp.2010.159.
- Morgenstern D.A., Anderson J. Inflammation: what role in pediatric cancer. Pediatr. Blood Cancer. 2012. Vol. 58(5). P. 659-664. doi: 10.1002/pbc.24008.
- Narendran G., Tomfohr L., Schulte F. Inflammatory cytokines and depression in children with cancer. Pediatr. Hematol. Oncol. 2018. Vol. 35(1). P. 11-19. doi: 10.1080/08880018.2018. 1440335.

/39.jpg)
/40.jpg)