Международный эндокринологический журнал Том 18, №7, 2022
Вернуться к номеру
Шляхи корекції ранніх порушень вуглеводного обміну: сучасні можливості фітотерапії
Авторы: Паньків В.І.
Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
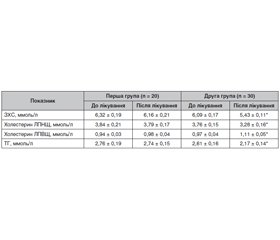
Актуальність. Фітотерапія є методом вибору в лікуванні початкових проявів цукрового діабету (ЦД) 2-го типу. В осіб із порушеною глікемією натще й порушенням толерантності до глюкози (ПТГ) фітотерапія у поєднанні з корекцією стилю життя може зупинити подальший розвиток хвороби. При виявленні легкої форми ЦД своєчасне призначення адекватної фітотерапії забезпечує компенсацію обмінних порушень і запобігає прогресуванню захворювання. У багатьох країнах накопичено значний досвід успішного лікування ЦД із використанням фітотерапії. Мета: оцінка ефективності й безпеки дієтичної добавки Сахніл як додаткового комплексу біологічно активних речовин рослинного походження в пацієнтів з порушенням вуглеводного обміну. Матеріали та методи. Під спостереженням перебувало 50 осіб із ПТГ. Пацієнти першої групи (n = 20) дотримувалися рекомендацій щодо зміни способу життя й фізичної активності. Пацієнти другої групи (n = 30) отримували дієтичну добавку Сахніл. Сахніл призначали по 2 таблетки двічі на добу за 30 хвилин до їди впродовж трьох місяців. Результати. У першій групі наприкінці спостереження рівень глікемії натще практично не змінився і становив 6,76 ± 0,11 ммоль/л. Через 12 тижнів у групі пацієнтів, які отримували Сахніл, рівень глікемії натще вірогідно знизився на 18,9 % і становив 5,62 ± 0,09 ммоль/л. Наприкінці лікування в осіб першої групи відзначалося незначне зниження рівня глікемії через 2 години після навантаження (р = 0,08). Терапія із застосуванням дієтичної добавки Сахніл привела до суттєвого зниження (на 20,8 %, р = 0,001) рівня глікемії через 2 години після навантаження, що становило 7,14 ± 0,19 ммоль/л. При аналізі показників ліпідного обміну в динаміці спостереження й лікування встановлено, що в другій групі пацієнтів, які приймали Сахніл, концентрація загального холестерину вірогідно знизилася на 10,8 % (до лікування 6,09 ± 0,17 ммоль/л, після лікування — 5,43 ± 0,11 ммоль/л; р = 0,03). В осіб першої групи рівень загального холестерину за час спостереження не змінився (на початку — 6,32 ± 0,19 ммоль/л і після лікування — 6,16 ± 0,21 ммоль/л). Висновки. Дієтична добавка Сахніл є ефективним засобом для лікування хворих з порушеною толерантністю до глюкози. Терапія із застосуванням дієтичної добавки Сахніл у добовій дозі 2 таблетки двічі на день приводить до зниження й нормалізації параметрів вуглеводного обміну. Ці зміни мають статистично значущий характер порівняно з початковим рівнем глікемії. Сахніл добре переноситься хворими, не викликає побічних ефектів.
Background. Phytotherapy is the method of choice in the treatment of the initial manifestations of type 2 diabetes mellitus (DM). In people with impaired fasting glycemia and impaired glucose tolerance (IGT), phytotherapy in combination with lifestyle correction can stop the further development of the disease. When a mild form of DM is detected, the timely administration of adequate phytotherapy ensures compensation of metabolic disorders and prevents the progression of the disease. In many countries, considerable experience has been accumulated on the successful treatment of DM using phytotherapy. The purpose of the study is to evaluate the effectiveness and safety of the dietary supplement Sakhnil as an additional complex of biologically active substances of plant origin in patients with impaired carbohydrate metabolism. Material and methods. Fifty people with IGT were under observation. Patients of the first group (n = 20) with IGT followed the recommendations for lifestyle changes and physical activity. Patients of the second group (n = 30) with IGT received the dietary supplement Sakhnil. Sakhnil was prescribed 2 tablets twice a day 30 minutes before meals for three months. Results. In the first group, by the end of observation, the level of fasting blood glucose practically did not change and was 6.76 ± 0.11 mmol/l. After 12 weeks in the group of patients who received Sakhnil, the level of fasting blood glucose significantly decreased by 18.9 % and amounted to 5.62 ± 0.09 mmol/l. By the end of treatment, a slight decrease in postprandial blood glucose was noted (p = 0.08). Therapy with the dietary supplement Sakhnil led to a significant decrease (by 20.8 %, p = 0.001) in the postprandial glycemia, which was 7.14 ± 0.19 mmol/l. When analyzing the indicators of lipid metabolism in the dynamics of observation and treatment, it was found that in the second group of patients who took Sakhnil, the concentration of total cholesterol decreased significantly, by 10.8 % (before treatment 6.09 ± 0.17 mmol/l, after treatment 5.43 ± 0.11 mmol/l; p = 0.03). In the first group, the level of total cholesterol did not change during the observation period (at the beginning 6.32 ± 0.19 mmol/l and after treatment 6.16 ± 0.21 mmol/l). Conclusions. The dietary supplement Sakhnil is an effective mean for the treatment of patients with impaired glucose tolerance. Therapy with the dietary supplement Sakhnil in a daily dose of 2 tablets twice a day leads to a decrease and normalization of parameters of carbohydrate metabolism. These changes are statistically significant compared to the initial level of glycemia. Sakhnil is well tolerated by patients, does not cause side effects.
цукровий діабет; порушення толерантності до глюкози; фітотерапія
diabetes mellitus; impaired glucose tolerance; phytotherapy
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Wang H., Li N., Chivese T., Werfalli M., Sun H., Yuen L., Hoegfeldt C.A. et al.; IDF Diabetes Atlas Committee Hyperglycaemia in Pregnancy Special Interest Group. IDF Diabetes Atlas: Estimation of Global and Regional Gestational Diabetes Mellitus Prevalence for 2021 by International Association of Diabetes in Pregnancy Study Group’s Criteria. Diabetes Res. Clin. Pract. 2022. 183. 109050. doi: 10.1016/j.diabres.2021.109050.
- Liu J., Ren Z.H., Qiang H., Wu J., Shen M., Zhang L., Lyu J. Trends in the incidence of diabetes mellitus: results from the Global Burden of Disease Study 2017 and implications for diabetes mellitus prevention. BMC Public Health. 2020. 20(1). 1415. doi: 10.1186/s12889-020-09502-x. PMID: 32943028; PMCID: PMC7500018.
- Galaviz K.I., Weber M.B., Straus A., Haw J.S., Narayan K.M.V., Ali M.K. Global Diabetes Prevention Interventions: A Systematic Review and Network Meta-analysis of the Real-World Impact on Incidence, Weight, and Glucose. Diabetes Care. 2018. 41(7). 1526-1534. doi: 10.2337/dc17-2222. PMID: 29934481; PMCID: PMC6463613.
- Stuart R.M., Khan O., Abeysuriya R., Kryvchun T., Lysak V., Bredikhina A., Durdykulyieva N. et al. Diabetes care cascade in Ukraine: an analysis of breakpoints and opportunities for improved diabetes outcomes. BMC Health Serv. Res. 2020. 20(1). 409. doi: 10.1186/s12913-020-05261-y. PMID: 32393341; PMCID: PMC7212677.
- Bansal N. Prediabetes diagnosis and treatment: A review. World J. Diabetes. 2015. 6(2). 296-303. doi: 10.4239/wjd.v6.i2.296. PMID: 25789110; PMCID: PMC4360422.
- Sam S., Edelstein S.L., Arslanian S.A., Barengolts E., Buchanan T.A., Caprio S., Ehrmann D.A. et al.; RISE Consortium; RISE Consortium Investigators. Baseline Predictors of Glycemic Worsening in Youth and Adults With Impaired Glucose Tolerance or Recently Diagnosed Type 2 Diabetes in the Restoring Insulin Secretion (RISE) Study. Diabetes Care. 2021. 44(9). 1938-1947. doi: 10.2337/dc21-0027.
- Anderson J., Meneghini L., Hinnen D., Gill J., Coudert M., Evenou P., Munshi M. Target attainment in insulin-naive patients at high risk for hypoglycemia: Results from ACHIEVE Control. J. Diabetes Complications. 2021. 35(4). 107831. doi: 10.1016/j.jdiacomp.2020.107831.
- Tsuchida K., Mitsuma W., Sato Y., Ozaki K., Soda S., Hatada K., Tanaka K. et al. Impaired glucose tolerance and future cardiovascular risk after coronary revascularization: a 10-year follow-up report. Acta Diabetol. 2020. 57(2). 173-182. doi: 10.1007/s00592-019-01394-7.
- DeFronzo R.A., Abdul-Ghani M. Assessment and treatment of cardiovascular risk in prediabetes: impaired glucose tolerance and impaired fasting glucose. Am. J. Cardiol. 2011. 108 (3 Suppl.). 3B-24B. doi: 10.1016/j.amjcard.2011.03.013. PMID: 21802577.
- Braga T., Kraemer-Aguiar L.G., Docherty N.G., Le Roux C.W. Treating prediabetes: why and how should we do it? Minerva Med. 2019. 110(1). 52-61. doi: 10.23736/S0026-4806.18.05897-4.
- Волшин О.І., Глубоченко О.В., Паньків І.В., Глубоченко В.Г., Малкович Н.М. Особливості фітотерапії цукрового діабету крізь призму коморбідності й профілактики ускладнень (огляд літератури). Міжнародний ендокринологічний журнал. 2019. 15(3). 258-267. https://doi.org/10.22141/2224-0721. 15.3.2019.172113
- Governa P., Baini G., Borgonetti V., Cettolin G., Giachetti D., Magnano A.R., Miraldi E., Biagi M. Phytotherapy in the Management of Diabetes: A Review. Molecules. 2018. 23(1). 105. doi: 10.3390/molecules23010105. PMID: 29300317; PMCID: PMC6017385.
- Farzaei F., Morovati M.R., Farjadmand F., Farzaei M.H. A Mechanistic Review on Medicinal Plants Used for Diabetes Mellitus in Traditional Persian Medicine. J. Evid. Based Complementary Altern. Med. 2017. 22(4). 944-955. doi: 10.1177/2156587216686461.
- Di Fabio G., Romanucci V., Zarrelli M., Giordano M., Zarrelli A. C-4 gem-dimethylated oleanes of Gymnema sylvestre and their pharmacological activities. Molecules. 2013. 18(12). 14892-919. doi: 10.3390/molecules181214892. PMID: 24304585; PMCID: PMC6269971.
- Joseph B., Jini D. Antidiabetic effects of Momordica charantia (bitter melon) and its medicinal potency. Asian Pac. J. Trop. Dis. 2013. 3(2). 93-102. doi: 10.1016/S2222-1808(13)60052-3. PMCID: PMC4027280.
- Singh J., Cumming E., Manoharan G., Kalasz H., Adeghate E. Medicinal chemistry of the anti-diabetic effects of momordica charantia: active constituents and modes of actions. Open Med. Chem. J. 2011. 5 (Suppl. 2). 70-7. doi: 10.2174/1874104501105010070.
- Zahn R., Perry N., Perry E., Mukaetova-Ladinska E.B. Use of herbal medicines: Pilot survey of UK users’ views. Complement. Ther. Med. 2019. 44. 83-90. doi: 10.1016/j.ctim.2019.02.007.
- Ruiz-Noa Y., Ibarra-Reynoso L.D.R., Ruiz-Padilla A.J., Alonso-Castro A.J., Ramírez-Morales M.A., Zapata-Morales J.R., Orozco-Castellanos L.M., Solorio-Alvardo C.R., Lara-Morales A. Use of herbal medicine for diabetes mellitus in adults from the central-western region of Mexico. Prim. Care Diabetes. 2021. 15(6). 1095-1099. doi: 10.1016/j.pcd.2021.08.010.
- Bonora E. Postprandial peaks as a risk factor for cardiovascular disease: epidemiological perspectives. Int. J. Clin. Pract. Suppl. 2002. (129). 5-11. PMID: 12166607.
- Ceriello A., Genovese S. Atherogenicity of postprandial hyperglycemia and lipotoxicity. Rev. Endocr. Metab. Disord. 2016. 17(1). 111-6. doi: 10.1007/s11154-016-9341-8. PMID: 26880302.
- Gothai S., Ganesan P., Park S.Y., Fakurazi S., Choi D.K., Arulselvan P. Natural Phyto-Bioactive Compounds for the Treatment of Type 2 Diabetes: Inflammation as a Target. Nutrients. 2016. 8(8). 461. doi: 10.3390/nu8080461. PMID: 27527213; PMCID: PMC4997374.

/21.jpg)
/22.jpg)