Журнал «Здоровье ребенка» Том 18, №2, 2023
Вернуться к номеру
Прогнозування переносимості інгаляційної терапії як етап персоніфікованого підходу в лікуванні дітей, хворих на муковісцидоз
Авторы: K.V. Skriabinа, S.I. Ilchenko, A.O. Fialkovska
Dnipro State Medical University, Dnipro, Ukraine
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
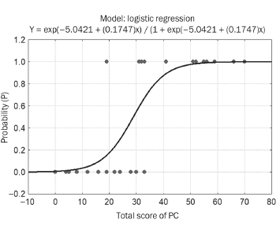
Актуальність. Враховуючи особливості базисної терапії хронічного запального бронхолегеневого процесу при муковісцидозі (МВ), що включає практично щоденні інгаляції фармакологічних препаратів (муколітики, гіпертонічні розчини хлориду натрію (ГРХН), антибіотики), на практиці актуальним є визначення їх переносимості. Мета дослідження: створення зручної для застосування в практичній медицині прогностичної шкали, що дозволяла б прогнозувати розвиток синдрому гіперреактивності бронхів у дітей із МВ, на підставі клініко-анамнестичних даних, результатів молекулярно-генетичного дослідження й інгаляційних тестів зі зростаючими концентраціями ГРХН для призначення персоніфікованого лікування. Матеріали та методи. Проаналізовано результати клініко-анамнестичних, мікробіологічних, біохімічних, молекулярно-генетичних досліджень та інгаляційних тестів зі зростаючими концентраціями ГРХН у 40 дітей із МВ. При розробці алгоритму прогнозування застосовували кореляційний аналіз, ROC-аналіз, метод бінарної логістичної регресії, методики Вальда і Кульбака. Результати. Створено дві прогностичні моделі, що можуть використовуватися на різних етапах надання медичної допомоги. Для амбулаторного етапу надання медичної допомоги хворим на МВ була побудована модель 1, що враховує клініко-анамнестичні дані, молекулярно-генетичні предиктори, а також клінічні симптоми під час інгаляційних тестів зі зростаючими концентраціями ГРХН. Ця модель також може використовуватись у дітей раннього віку, у яких неможливо провести спірометрію та оцінити показники функції зовнішнього дихання. Для етапу високоспеціалізованої медичної допомоги була створена модель 2, що включає показники спірометричних даних інгаляційних тестів зі зростаючими концентраціями ГРХН та рівня монооксиду азоту в конденсаті повітря, що видихається. Висновки. Розроблені моделі дозволяють з високою вірогідністю розрахувати ризик розвитку синдрому гіперреактивності бронхів для персоніфікованого підбору ГРХН та вибору превентивної брохолітичної терапії за потребою.
Background. Considering the features of basic therapy for chronic inflammatory bronchopulmonary process in cystic fibrosis (CF), which includes almost daily inhalation of pharmacological drugs (mucolytics, hypertonic saline (HS), antibiotics), evaluation of their tolerability is relevant in practice. The purpose of the study is to create a prognostic scale convenient for use in practical medicine, which would predict development of bronchial hyperreactivity syndrome in children with CF, based on clinical and anamnestic data, the results of molecular genetic research and inhalation tests with increasing concentrations of HS to prescribe personalized treatment. Materials and methods. The results of clinical and anamnestic, microbiological, biochemical, molecular and genetic studies and inhalation tests with increasing concentrations of HS were analyzed in 40 children with CF. The creation of the predictive algorithm was based on the application of correlation analysis, receiver operating characteristic analysis, binary logistic regression, Wald and Kullback method. Results. Two prognostic models have been created that can be used at different stages of providing medical care. Model 1 was built for the ambulatory stage of providing medical care to patients with CF, considering clinical and anamnestic data, molecular genetic predictors, as well as clinical symptoms during inhalation tests with increasing concentrations of HS. This model also can be used in young children who cannot perform spirometry to assess their external breathing function. For the highly specialized medical care, model 2 was created, which considers indicators of spirometric data of inhalation tests with increasing concentrations of HS and the level of exhaled nitric oxide. Conclusions. The developed models make it possible to calculate with high probability the risk of developing bronchial hyperreactivity to perform a personalized selection of HS and choose preventive brocholytic therapy as needed.
муковісцидоз; гіпертонічний розчин хлориду натрію; гіперреактивність бронхів; прогнозування; діти
cystic fibrosis; hypertonic solutions of sodium chloride; bronchial hyperreactivity; prognosis; children
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Cantin A.M., Hartl D., Konstan M.W., Chmiel J.F. Inflammation in cystic fibrosis lung disease: pathogenesis and therapy. J. Cyst. Fibros. 2015. 14(4). 419-430. doi: 10.1016/j.jcf.2015.03.003.
- Скрябіна К.В., Ільченко С.І., Фіалковська А.О. Гетерогенність фенотипових проявів муковісцидозу в дітей і предиктори тяжкості перебігу захворювання. Запорізький медичний журнал. 2022. 24. 6(135). 674-680. doi: 10.14739/2310-1210.2022.6.258359.
- Ільченко С.І., Фіалковська А.О., Чергінець В.І., Скрябіна К.В. Порівняння ефективності та переносимості інгаляційних гіпертонічних розчинів хлориду натрію в педіатричній практиці. Медичні перспективи. 2021. 26(1). 136-142. doi: 10.26641/2307-0404.2021.1.227953.
- Ільченко С.І., Фіалковська А.О., Скрябіна К.В., Іванусь С.Г. Реактивність бронхів на інгаляційні сольові гіпертонічні розчини у дітей з муковісцидозом. Здоров’я дитини. 2022. 17(5). 236-243. doi: 10.22141/2224-0551.17.5.2022.1523.
- Rafeey M., Jabarpoor-Bonyadi M., Vahedi L. Genotype-Phenotype Correlation for Cystic Fibrosis According to Registry Center of Cystic Fibrosis. Crescent Journal of Medical and Biological Sciences. 2020. 7(1). 124-129.
- Borak J., Lefkowitz R.Y. Bronchial hyperresponsiveness. Occup. Med. (London). 2016. 66(2). 95-105. doi: 10.1093/occmed/kqv158.
- Eyns H., Willekens J., De Schutter I., De Wachter E., Vaes P., Malfroot A. Bronchial Hyperreactivity Related to Inhalation Therapy in Cystic Fibrosis Patients. J. Pulm. Respir. Med. 2014. 4(6). doi: 10.4172/2161-105X.1000211.
- Dellon E.P., Donaldson S.H., Johnson R., Davis S.D. Safety and tolerability of inhaled hypertonic saline in young children with cystic fibrosis. Pediatr. Pulmonol. 2008. 43(11). 1100-1106. doi: 10.1002/ppul.20909.
- Уніфікований клінічний протокол первинної, вторинної та третинної медичної допомоги «Муковісцидоз»: Наказ МОЗ України № 723 від 15.07.2016 р.
- Valverde-Molina J., Sánchez-Solís M., Pastor-Vivero M.D., García-Marcos L. Association between chronic colonization or infection with Pseudomonas aeruginosa and bronchial hyperreactivity in patients with cystic fibrosis. Arch. Bronconeumol. 2008. 44(4). 180-184.
- Janahi I.A., Rehman A., Al‑Naimi A.R. Allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. Ann. Thorac. Med. 2017. 12. 74‑82. doi: 10.4103/atm.ATM_231_16.
- Wark P., McDonald V.M. Nebulised hypertonic saline for cystic fibrosis. Cochrane Database Syst. Rev. 2018. 9(9). CD001506. doi: 10.1002/14651858.CD001506.pub4.
- Levine H., Cohen-Cymberknoh M., Klein N., Hoshen M., Mussaffi H., Stafler P. et al. Reversible airway obstruction in cystic fibrosis: common, but not associated with characteristics of asthma. Journal of Cystic Fibrosis. 2016. 15(5). 652-9. doi: 10.1016/j.jcf.2016.01.003.
- Galodé F., Ladipo O., Andrieux A., Feghali H., Bui S., Fayon M. Prevalence and Determinants of Wheezing and Bronchodilatation in Children With Cystic Fibrosis: A Retrospective Cohort Study. Front Pediatr. 2022. 10. 856840. doi: 10.3389/fped.2022.856840.
- Smith S., Rowbotham N.J., Edwards C.T. Short-acting inhaled bronchodilators for cystic fibrosis. Cochrane Database Syst. Rev. 2022. 6. CD013666. doi: 10.1002/14651858.CD013666.pub2.
- Vincken S., Verbanck S., De Wachter E., Vanderhelst E. Exhaled nitric oxide in stable adult cystic fibrosis patients, during exacerbation and following CFTR-modifying treatment. Eur. Respir. J. 2019. 53. 1802259. doi: 10.1183/13993003.02259-2018.
- Smith S., Edwards C.T. Long-acting inhaled bronchodilators for cystic fibrosis. Cochrane Database Syst. Rev. 2017. 12. CD012102. doi: 10.1002/14651858.CD012102.pub2.