Журнал «Медицина неотложных состояний» Том 19, №4, 2023
Вернуться к номеру
Зв’язок механічної дисинхронії міокарда лівого шлуночка зі ступенем оклюзії коронарних артерій у хворих із коронарною хворобою серця
Авторы: Більченко О.В. (1), Мехтієва Фатма Барат кизи (1, 2), Більченко А.О. (3)
(1) — Харківський національний медичний університет МОЗ України, м. Харків, Україна
(2) — Харківська клінічна лікарня на залізничному транспорті № 1, м. Харків, Україна
(3) — ДУ «Національний інститут терапії імені Л.Т. Малої» НАМН України, м. Харків, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
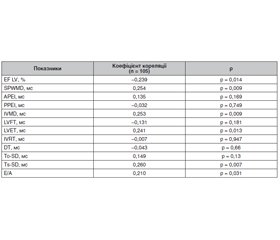
Актуальність. Поширеність хронічної серцевої недостатності (ХСН) у світі зростає, проте в розвинених країнах вона стабілізувалася завдяки ефективному лікуванню перш за все гострого коронарного синдрому (ГКС) та впровадженню стратегії реваскуляризації. За даними рандомізованих досліджень, менш ефективною вважається реваскуляризація у хворих із хронічним коронарним синдромом (ХКС) без ознак дисфункції міокарда. Відповідно, дедалі актуальнішим стає відбір потенційних кандидатів на реваскуляризацію, і одним з перспективних методів оцінки систолічної та діастолічної функцій лівого шлуночка вважається оцінка механічної та електричної дисинхронії міокарда. Мета дослідження: оцінити зв’язок механічної дисинхронії міокарда зі ступенем оклюзії коронарних артерій (КА) у хворих з коронарною хворобою серця, яким проводилася процедура реваскуляризації. Матеріали та методи. У дослідження було включено 134 хворі із ХКС, яким проводилася процедура реваскуляризації. Показаннями для реваскуляризації були інфаркт міокарда у 35 хворих і хронічні коронарні синдроми у 99 хворих. За результатами коронароангіографії хворі були поділені на 3 групи: 12 хворих з незміненими КА (1-ша група), 17 хворих з атеросклеротичним ураженням КА без ознак оклюзії (2-га група) та 105 хворих з оклюзією КА (3-тя група), серед яких 10 мали оклюзію менше ніж 50 %, 26 — від 50 до 80 %, 36 — більше ніж 80 %, 33 хворих мали повну оклюзію хоча б однієї коронарної артерії. Усім хворим проводилося визначення параметрів механічної дисинхронії міокарда (ДМ) ультразвуковим методом. Результати. У першій групі 3 хворі (25 %) мали механічну ДМ, у другій — 4 хворі (23,5 %). У групі з оклюзією коронарних артерій 42 хворих (40 %) мали механічну ДМ, але серед хворих із повною оклюзією КА половина мала ознаки ДМ. Показник затримки активації задньобічної стінки лівого шлуночка (SPWMD) не відрізнявся вірогідно у групах порівняння, проте вірогідно зростав у хворих із повною оклюзією КА до 64,8 ± 43,2 мс порівняно з 40,8 ± 13,1 мс у групі хворих із незміненими КА (р < 0,05). Зв’язок показника затримки активації задньобічної стінки лівого шлуночка (SPWMD) зі ступенем оклюзії КА підтверджувався також даними кореляційного аналізу (r = 0,254, p = 0,009). Також за рахунок вірогідного зростання часу передвигнання в аорту (APEI) у групі хворих з повною оклюзією КА до 125,1 ± 35,4 мс (р < 0,05) вірогідно збільшилась інтервентрикулярна механічна затримка (IVМD) до 61,3 ± 40,5 мс порівняно з 33,4 ± 3,4 мс у хворих із незміненими КА (р < 0,05). Час наповнення лівого шлуночка (LVFT) був вірогідно меншим у групі хворих із повною оклюзією КА порівняно з групами хворих із неповною оклюзією КА та хворими з незмінними КА (47,3 ± 10,4 проти 54,2 ± 5,7 мс відповідно, р < 0,05), тоді як час вигнання з лівого шлуночка (LVET) не відрізнявся вірогідно між групами порівняння, проте мав вірогідну кореляцію зі ступенем оклюзії КА (r = 0,241, p = 0,013). Час уповільнення потоку раннього наповнення шлуночків (DT), час від початку комплексу QRS до початку пікової систолічної швидкості (To) не відрізнялися вірогідно, тоді як час до піку систолічної швидкості (Ts) був вірогідно більшим у групі з повною оклюзією КА (32,6 ± 8,5 мс) та мав вірогідну кореляцію зі ступенем оклюзії КА (r = 0,26, p = 0,007). Висновки. Таким чином, третина хворих із ХКС, включених у дослідження, мали ДМ, проте при повній оклюзії КА частота виявлення ДМ значно збільшувалась і діагностувалась у половини хворих. У хворих із повною оклюзією КА ДМ проявлялася вірогідною затримкою активації задньобічної стінки лівого шлуночка, збільшенням часу передвигнання в аорту та, як наслідок, вірогідним збільшенням інтервентрикулярної механічної затримки. Також у групі хворих з повною оклюзією КА виявлено збільшення часу до піку систолічної швидкості. ДМ, пов’язана з діастолічною дисфункцією ЛШ, виявлена у групі хворих з повною оклюзією КА, яка проявлялася скороченням часу наповнення лівого шлуночка.
Background. The prevalence of chronic heart failure in the world is increasing; however, it is stabilizing in developed countries. One of the reasons for this stabilization is an improvement of acute coronary syndrome treatment and revascularization. Revascularization in patients with chronic coronary syndromes without signs of the left ventricular dysfunction is less effective. One of the promising methods for assessing left ventricular dysfunction is the detection of electrical and mechanical dyssynchrony of the myocardium (DM). However, mechanical dyssynchrony of the myocardium has not been sufficiently studied in patients with coronary artery (CA) disease. The purpose was to assess the relationship between mechanical myocardial dyssynchrony and the degree of coronary artery occlusion in patients with coronary artery disease who underwent revascularization. Materials and methods. One hundred and thirty-four patients with coronary artery disease (35 with myocardial infarction and 99 with chronic coronary syndromes) who underwent coronary angiography and revascularization of coronary arteries were included in the study. According to the results of coronary angiography, patients were divided into 3 groups: 12 had unchanged CA (group 1), 17 had atherosclerotic lesions of CA without signs of occlusion (group 2), and 105 patients were with CA occlusion. Among those with CA occlusion, 10 people had an occlusion of less than 50 %, 26 patients had occlusion from 50 to 80 %, 36 had more than 80 %, and 33 patients had complete occlusion of at least one coronary artery. In all patients, parameters of mechanical DM were determined by ultrasound method. Results. In the first group, 3 patients (25 %) had mechanical DM, in the second — 4 patients (23.5 %), in the group with coronary artery occlusion, 42 patients (40 %) had mechanical DM. In the group with complete CA occlusion, mechanical DM was detected in 18 (53 %) cases. Septal to posterior wall motion delay (SPWMD) did not differ significantly in the comparison groups; however, it increased significantly to 64.8 ± 43.2 ms in patients with complete CA occlusion compared with 40.8 ± 13.1 ms in the group with unchanged CA (p < 0.05). SPWMD had a significant correlation with the degree of CA occlusion (r = 0.254, p = 0.009). The interventricular mechanical delay increased significantly, to 61.3 ± 40.5 ms compared with 33.4 ± 3.4 ms in patients with unchanged CA (p < 0.05). Left ventricular filling time was significantly shorter in the group with complete CA occlusion compared to the patients with incomplete CA occlusion and those with unchanged CA (47.3 ± 10.4 ms vs. 54.2 ± 5.7 ms, respectively; p < 0.05). Left ventricular ejection time was not significantly different between comparison groups, but correlated significantly with the degree of CA occlusion (r = 0.241, p = 0.013). The early ventricular time deceleration, the time from the beginning of the QRS complex to the beginning of the peak systolic velocity did not differ significantly. The time to the peak systolic velocity was significantly longer in the group with complete CA occlusion (32.6 ± 8.5 ms), and had a significant correlation with the degree of CA occlusion (r = 0.26, p = 0.007). Conclusions. A third of patients with chronic coronary syndrome included in the study had DM. In the group with complete CA occlusion, the frequency of DM detection increased significantly and was diagnosed in half of cases. In patients with complete CA occlusion, DM manifested itself in a significant SPWMD, an increase in the period of pre-ejection into the aorta and, as a result, a significant increase in the interventricular mechanical delay. An increase in the time to peak systolic velocity was also found in the group of patients with complete CA occlusion. DM associated with left ventricular diastolic dysfunction was detected in a group of patients with complete CA occlusion and manifested itself in a reduced left ventricular filling time.
коронарна хвороба серця; реваскуляризація; хронічна серцева недостатність; дисинхронія міокарда; обструкція коронарних артерій; систолічна функція; діастолічна функція
coronary artery disease; revascularization; chronic heart failure; myocardial dyssynchrony; coronary artery obstruction; systolic function; diastolic function
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Savarese G., Becher P.M., Lund L.H., et al. Global burden of heart failure: a comprehensive and updated review of epidemiology. Cardiovasc. Res. 2023. 118. 3272-3287. doi: 10.1093/cvr/cvac013.
- Rosano G.M.C., Seferovic P., Savarese G., et al. Impact analysis of heart failure across European countries: an ESC-HFA position paper. ESC Hear Fail. 2022. 9. 2767-2778. doi: 10.1002/ehf2.14076.
- McDonagh T.A., Metra M., Adamo M., et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur. Heart J. 2021. 42. 3599-3726. doi: 10.1002/ejhf.2333.
- Maron D.J., Hochman J.S., Reynolds H.R., et al. Initial Invasive or Conservative Strategy for Stable Coronary Disease. N. Engl. J. Med. 2020. 382. 1395-1407. doi: 10.1056/NEJMoa1915922.
- Perera D., Clayton T., O’Kane P.D., et al. Percutaneous Revascularization for Ischemic Left Ventricular Dysfunction. N. Engl. J. Med. 2022. 387. 1351-1360. doi: 10.1056/NEJMoa2206606.
- Kirtane A.J. REVIVE-ing a Weak Heart — Details Matter. N. Engl. J. Med. 2022. 387. 1426-1427. doi: 10.1056/NEJMe2210183.
- Fudim M., Dalgaard F., Fathallah M., et al. Mechanical dyssynchrony: How do we measure it, what it means, and what we can do about it. J. Nucl. Cardiol. 2021. 28. 2174-2184. doi: 10.1007/s12350-019-01758-0.
- Monge García M.I., Jian Z., Hatib F., et al. Relationship between intraventricular mechanical dyssynchrony and left ventricular systolic and diastolic performance: An in vivo experimental study. Physiol. Rep. 11. Epub ahead of print 17 February 2023. doi: 10.14814/phy2.15607.
- Fudim M., Fathallah M., Shaw L.K., et al. The prognostic value of diastolic and systolic mechanical left ventricular dyssynchrony among patients with coronary artery disease and heart failure. J. Nucl. Cardiol. 2020. 27. 1622-1632. doi: 10.1007/s12350-019-01843-4.
- Hämäläinen H., Corovai A., Laitinen J., et al. Myocardial ischemia and previous infarction contribute to left ventricular dyssynchrony in patients with coronary artery disease. J. Nucl. Cardiol. 2021. 28. 3010-3020. doi: 10.1007/s12350-020-02316-9.
- Karuzas A., Rumbinaite E., Verikas D., et al. Accuracy of three-dimensional systolic dyssynchrony and sphericity indexes for identifying early left ventricular remodeling after acute myocardial infarction. Anatol. J. Cardiol. 2019. 22. 13-20. doi: 10.14744/AnatolJCardiol.2019.02844.
- Jalkh K., AlJaroudi W. Left ventricular mechanical dyssnchrony: A potential new marker for 3-vessel CAD. J. Nucl. Cardiol. Epub ahead of print 2 March 2023. doi: 10.1007/s12350-023-03232-4.
- Fujito H., Yoda S., Hatta T., et al. Prognostic value of the normalization of left ventricular mechanical dyssynchrony after revascularization in patients with coronary artery disease. Heart Vessels. 2022. 37. 1395. 1410. doi: 10.1007/s00380-022-02045-8.
- Fujito H., Yoda S., Hatta T., et al. Prognostic significance of left ventricular dyssynchrony assessed with nuclear cardiology for the prediction of major cardiac events after revascularization. Intern. Med. 2021. 60. 3679-3692. doi: 10.2169/internalmedicine.6995-20.
- Liu J., Fan R., Li C.L., et al. Predictive value of left ventricular dyssynchrony for short-term outcomes in three-vessel disease patients undergoing coronary artery bypass grafting with preserved or mildly reduced left ventricular ejection fraction. Front Cardiovasc. Med. 9. Epub ahead of print 17 November 2022. doi: 10.3389/fcvm.2022.1036780.
- Zhang H., Shi K., Fei M., et al. A Left Ventricular Mechanical Dyssynchrony-Based Nomogram for Predicting Major Adverse Cardiac Events Risk in Patients with Ischemia and No Obstructive Coronary Artery Disease. Front Cardiovasc. Med. 9. Epub ahead of print 18 March 2022. doi: 10.3389/fcvm.2022.827231.
- Vassiliki’ Cousoumbas G., Casella G., Di Pasquale G. What is the role of coronary revascularization to recover the contractility of the dysfunctional heart? Eur. Hear J. Suppl. 2023. 25. B75-B78. doi: 10.1093/eurheartjsupp/suad072.
- Neumann F.J., Sousa-Uva M., Ahlsson A., et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. EuroIntervention. 2020. 14. 1435-1534. doi: 10.4244/EIJY19M01_01.
- Towashiraporn K. Current recommendations for revascularization of non-infarct-related artery in patients presenting with ST-segment elevation myocardial infarction and multivessel disease. Front Cardiovasc. Med. 9. Epub ahead of print 11 August 2022. doi: 10.3389/fcvm.2022.969060.
- Edvardsen T., Asch F.M., Davidson B., et al. Non-invasive imaging in coronary syndromes: Recommendations of the European Association of Cardiovascular Imaging and the American Society of Echocardiography, in collaboration with the American Society of Nuclear Cardiology, Society of Cardiovascular Computed Tomography, and Society for Cardiovascular Magnetic Resonance. Eur. Heart J. Cardiovasc. Imaging. 2022. 23. E6-E33. doi: 10.1093/ehjci/jeab244.
- Hämäläinen H., Laitinen T.M., Hedman M., et al. Cardiac remodelling in association with left ventricular dyssynchrony and systolic dysfunction in patients with coronary artery disease. Clin. Physiol. Funct. Imaging. 2022. 42. 413-421. doi: 10.1111/cpf.12780.
- Hamdy R.M., Osama H., Fereig H.M. Evaluation of Cardiac Mechanical Dyssynchrony in Heart Failure Patients Using Current Echo-Doppler Modalities. J. Cardiovasc. Imaging. 2022. 30. 307-319. doi: 10.4250/jcvi.2022.0061.
- Liu X., Li W., Zhou X., et al. Clinical Outcomes of Left Bundle Branch Area Pacing in Comparison with Right Ventricular Septal Pacing in Patients with High Ventricular Pacing Ratio ≥40%. Int. J. Gen. Med. 2022. 15. 4175-4185. doi: 10.2147/IJGM.S360522.
- Mirolo A., Chaumont C., Auquier N., et al. Left bundle branch area pacing in patients with baseline narrow, left, or right bundle branch block QRS patterns: insights into electrocardiographic and echocardiographic features. Europace. 2023. 25. 526-535. doi: 10.1093/europace/euac223.
- Zhang W., Huang J., Qi Y., et al. Cardiac resynchronization therapy by left bundle branch area pacing in patients with heart failure and left bundle branch block. Hear Rhythm. 2019. 16. 1783-1790. doi: 10.1016/j.hrthm.2019.09.006.
- Togashi I., Sato T. Conduction system pacing: Current status and prospects. J. Cardiol. 2023. 81. 413-419. doi: 10.1016/j.jjcc.2023.01.011.
- Tamaki Y., Iwano H., Murayama M., et al. Application of an echocardiographic scoring system of left ventricular filling pressure to diagnose acute heart failure in patients complaining dyspnea. J. Cardiol. Epub ahead of print April 2023. doi: 10.1016/j.jjcc.2023.04.016.