Журнал «Медицина неотложных состояний» Том 19, №6, 2023
Вернуться к номеру
Дослідження впливу різних комбінацій нейропротекторів на біохімічні маркери запалення, показники ендотеліальної дисфункції та апоптозу в пацієнтів з ішемічними інсультами
Авторы: Карімулін Р.Ф., Семененко А.І.
Вінницький національний медичний університет ім. М.І. Пирогова, м. Вінниця, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
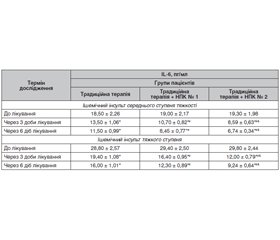
Актуальність. Збереження та відновлення нейронів у зоні ішемічної напівтіні шляхом розробки нових методів нейропротекції є одним із актуальних питань сучасної медицини. Мета: вивчити вплив різних комбінацій нейропротекторів, що відрізняються за механізмом дії, шляхом аналізу маркерів запалення, ендотеліальної дисфункції та апоптозу в сироватці крові пацієнтів з ішемічним інсультом. Матеріали та методи. Рандомізоване проспективне контрольоване дослідження застосування нейропротекторних комплексів (НПК): НПК № 1 (церебролізин + мексидол) та НПК № 2 (церебролізин + цитиколін) — проводили у пацієнтів з ішемічним інсультом середнього ступеня тяжкості та тяжкого ступеня, які були рандомно поділені на групи: 1) група порівняння — отримували традиційну терапію; 2) пацієнти поряд з традиційним лікуванням отримували НПК № 1; 3) пацієнти на тлі традиційного лікування отримували НПК № 2. Лабораторні дослідження з визначення інтерлейкіну-6 (ІL-6), ендотеліну-1 та каспази-8 у сироватці крові проводили в динаміці: на 1-шу, 4-ту та 7-му добу. Результати. За протизапальною активністю схема терапії, яка включала призначення НПК № 2, перевершувала в 1,6–2,1 раза (р < 0,01) стандартне лікування, а також в 1,2–1,4 раза (р < 0,05) традиційне лікування, поєднане із застосуванням НПК № 1. Схема терапії, яка включала НПК № 2, за ендотеліопротекторною активністю та антиапоптотичним ефектом перевершувала відповідно в 1,8–3,5 та 1,5–2,3 раза (р < 0,01) лише стандартне лікування, а також в 1,2–1,5 та 1,2–1,3 раза (р < 0,05) традиційне лікування, поєднане із застосуванням НПК № 1. Висновки. Застосування НПК № 2 (церебролізин + цитиколін) для лікування ішемічних інсультів середнього та тяжкого ступенів у поєднанні з традиційною терапією показало найбільш виражену та вірогідно ефективну нейропротекторну дію (p < 0,05).
Background. Preservation and restoration of neurons in the ischemic penumbra by developing new methods for neuroprotection is one of the urgent issues of modern medicine. The purpose was to study the effect of different combinations of neuroprotectors with different mechanisms of action by analyzing markers of inflammation, endothelial dysfunction, and apoptosis in the blood serum of patients with ischemic stroke. Materials and methods. A randomized prospective controlled study was conducted on the use of neuroprotective complexes (NPC): NPC 1 (cerebrolysin + mexidol) and NPC 2 (cerebrolysin + citicoline), in patients with moderate and severe ischemic stroke. They were randomly divided into groups: 1) comparison group — standard therapy; 2) NPC 1 along with standard treatment; 3) NPC 2 against the background of standard treatment. Laboratory studies on assessing interleukin-6, endothelin-1 and caspase-8 in blood serum were performed in dynamics, on days 1, 4 and 7. Results. In terms of anti-inflammatory activity, the therapy scheme, which included the administration of NPС 2, was 1.6–2.1 times (p < 0.01) ahead of standard treatment, as well as 1.2–1.4 times (p < 0.05) — of standard treatment combined with NPC 1. The regimen, which included NPC 2, in terms of endothelium protection and antiapoptotic effect exceeded standard treatment alone by 1.8–3.5 and 1.5–2.3 times (p < 0.01), respectively, as well as by 1.2–1.5 and 1.2–1.3 times (p < 0.05) — standard treatment combined with the use of NPС 1. Conclusions. The use of NPС 2 (cerebrolysin + citicoline) for the treatment of moderate and severe ischemic strokes in combination with standard therapy showed the most pronounced and reliable neuroprotective effect (p < 0.05).
ішемічний інсульт; інтерлейкін-6; ендотелін-1; каспаза-8
ischemic stroke; interleukin-6; endothelin-1; caspase-8
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Platz T. Evidence-based guidelines and clinical pathways in stroke rehabilitation: an international perspective. Front. Neurol. 2019. № 10. Р. 200-208. doi: 10.3389/fneur.2019.00200.
- Powers W.J., Rabinstein A.A., Ackerson T. et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke: A guideline for healthcare professionals from the American Heart Association. American Stroke Association. Stroke. 2019. № 50. Р. 344-418. doi: 10.1161/STR.0000000000000211.
- Orellana-Urzúa S., Rojas I., Líbano L., Rodrigo R. Pathophysiology of ischemic stroke: role of oxidative stress. Curr. Pharm. Des. 2020. № 8. Р. 2174-2174. doi: 10.2174/1381612826666200708133912.
- Ali A., Shah F.A., Zeb A. et al. NF-κB Inhibitors Attenuate MCAO Induced Neurodegeneration and Oxidative Stress — A Reprofiling Approach. Front. Mol. Neurosci. 2020. № 13. Р. 33-38. doi: 10.3389/fnmol.2020.00033. eCollection 2020.
- Jenny N.S., Callas P.W., Judd S.E. et al. Inflammatory cytokines and ischemic stroke risk: The REGARDS cohort. Neurology. 2019. № 92(20). Р. 2375-2384. doi.org/10.1212/WNL.0000000000007416.
- Pawluk H., Woźniak A., Grześk G. et al. The Role of Selected Pro-Inflammatory Cytokines in Pathogenesis of Ischemic Stroke. Clin. Interv. Aging. 2020. № 15. Р. 469-484. doi: 10.2147/CIA.S233909.
- Alfieri D.F., Lehmann M.F., Flauzino T. et al. Immune-Inflammatory, Metabolic, Oxidative, and Nitrosative Stress Biomarkers Predict Acute Ischemic Stroke and Short-Term Outcome. Neurotox Res. 2020. № 38(2). Р. 330-343. doi: 10.1007/s12640-020-00221-0.
- Vila N., Castillo J., Davalos A. et al. Proinflammatory cytokines and early neurological worsening in ischemic stroke. Stroke. 2000. 31. 10. P. 23252329. doi: 10.1161/01.str.31.10.2325.
- Choi J.I., Ha S.K., Lim D.J. et al. S100ss, Matrix Metalloproteinase-9, D-dimer, and Heat Shock Protein 70 Are Serologic Biomarkers of Acute Cerebral Infarction in a Mouse Model of Transient MCA Occlusion. J. Korean Neurosurg. Soc. 2018. № 61(5). Р. 548-558. doi: 10.3340/jkns.2017.0200.
- Sarvari S., Moakedi F., Hone E. et al. Mechanisms in blood-brain barrier opening and metabolism-challenged cerebrovascular ischemia with emphasis on ischemic stroke. Metab. Brain Dis. 2020. № 35(6). Р. 851-868. doi: 10.1007/s11011-020-00573-8.
- Al-Ali F., Elias J.J., Filipkowski D.E., Faber J.E. Acute ischemic stroke treatment. Part 1: patient selection «the 50% barrier and the capillary index score». Front. Neurol. 2015. № 22 (6). Р. 83-89. doi: 10.3389/fneur.2015.00083.
- Lambert M.A., Belch J.J. Medical management of critical limb ischemia: where do we stand today? J. Intern. Med. 2013. № 274 (4). P. 295-307. doi: 10.1111/joim.12102.
- Van der Worp H.B., Macleod M.R., Bath P.M. et al. EuroHYP-1: European multicenter, randomized, phase III clinical trial of therapeutic hypothermia plus best medical treatment vs. best medical treatment alone for acute ischemic stroke. Int. J. Stroke. 2014. № 9 (5). Р. 642-645. doi: 10.1111/ijs.12294.
- Ormstad H., Aass H.C., Amthor K.F. et al. Serum cytokine and glucose levels as predictors of poststroke fatigue in acute ischemic stroke patients. J. Neurol. 2011. № 258. Р. 670-6. doi: 10.1007/s00415-011-5962-8.
- Miller A.H., Haroon E., Raison C.L., Felger J.C. Cytokine targets in the brain: impact on neurotransmitters and neurocircuits. Depress Anxiety. 2013. 30(4). 297-306. doi: 10.1002/da.22084.
- Go A.S., Mozaffarian D., Roger V.L. et al. Heart disease and stroke statistics — 2014 update: a report from the American Heart Association. Circulation. 2014. № 129. Р. 28-292. doi: 10.1161/01.cir.0000441139.02102.80.
- Becker K.J. Inflammation and the silent sequelae of stroke. Neurotherapeutics. 2016. № 13(4). Р. 801-10. doi: 10.1007/s13311-016-0451-5.
- Zgavc T., Hu T.T., Van de Plas B. et al. Proteomic analysis of global protein expression changes in the endothelin-1 rat model for cerebral ischemia: rescue effect of mild hypothermia. Neurochem. Int. 2013. № 63 (5). Р. 379-388. doi: 10.1016/j.neuint.2013.07.011.
- Sharma R., Gowda H., Chavan S. et al. Proteomic Signature of Endothelial Dysfunction Identified in the Serum of Acute Ischemic Stroke Patients by the iTRAQ-Based LC-MS Approach. J. Proteome Res. 2015. № 14 (6). Р. 2466-2479. doi: 10.1021/pr501324n.
- Broughton B.R., Reutens D.C., Sobey C.G. Apoptotic mechanisms after cerebral ischemia. Stroke. 2009. № 40. Р. 331-339. doi: 10.1161/strokeaha.108.531632.
- Eldadah B.A., Faden A.I. Caspase pathways, neuronal apoptosis, and CNS injury. J. Neurotrauma. 2000. № 17. Р. 811-829. doi: 10.1089/neu.2000.17.811.