Журнал «Медицина неотложных состояний» Том 19, №7, 2023
Вернуться к номеру
Фібриляція передсердь у ранньому постабляційному періоді: причини виникнення і лікування
Авторы: Пророк С.Ю.
Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Широке впровадження катетерного лікування при фібриляції передсердь призвело до значного зростання пулу пацієнтів, яким виконується ця процедура. Розуміння особливостей перебігу хвороби у ранньому періоді після катетерного лікування є важливою складовою системного лікування таких хворих, що поліпшує як безпосередні результати, так і віддалені. Цей проміжок часу отримав назву «сліпий період», становить 3 міс. і зазвичай може супроводжуватися повторними або навіть більш частими епізодами аритмії. У цій публікації розглядаються сучасні підходи і методи ведення та лікування пацієнтів з фібриляцією передсердь саме у сліпому періоді.
The widespread introduction of catheter-based treatment for atrial fibrillation has led to a significant increase in the number of patients undergoing this procedure. Understanding the disease characteristics in the early period following catheter-based treatment is an important component of the systemic treatment of such patients, which improves both immediate and long-term outcomes. This time interval is referred to as the blanking period, it lasts for 3 months and may usually be accompanied by recurrent or even more frequent arrhythmia episodes. This publication discusses modern approaches and methods for managing and treating patients with atrial fibrillation specifically during the blanking period.
аритмії; фібриляція передсердь; абляція; катетерна деструкція; антиаритмічна терапія
arrhythmias; atrial fibrillation; ablation; catheter-based treatment; antiarrhythmic therapy
Вступ
Фібриляція передсердь у ранньому постабляційному періоді
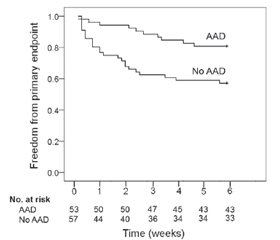
Роль антиаритмічної терапії у ранньому постабляційному періоді
/7.jpg)
Електрична кардіоверсія у сліпому періоді
Висновки
- Chugh S.S., et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014. 129(8). 837-847.
- Colilla S., et al. Estimates of current and future incidence and prevalence of atrial fibrillation in the U.S. adult population. Am. J. Cardiol. 2013. 112(8). 1142-1147.
- Dorian P., et al. The impairment of health-related quality of life in patients with intermittent atrial fibrillation: implications for the assessment of investigational therapy. J. Am. Coll. Cardiol. 2000. 36(4). 1303-1309.
- Wijffels M.C., et al. Atrial fibrillation begets atrial fibrillation. A study in awake hronically instrumented goats. Circulation. 1995. 92(7). 1954-1968.
- Walters T.E., et al. Progression of atrial remodeling in patients with high-burden atrial fibrillation: Implications for early ablative intervention. Heart Rhythm. 2016. 13(2). 331-339.
- Hindricks, et al., ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial G. fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. European Heart Journal. 2021 Feb 1. 42. Iss. 5. 373-498.
- Calkins H., et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation 1547-5271/© 2017 HRS; EHRA, a registered branch of the ESC; ECAS; JHRS and APHRS; and SOLAECE.
- Pappone C., et al. Circumferential radiofrequency ablation of pulmonary vein ostia: A new anatomic approach for curing atrial fibrillation. Circulation. 2000. 102(21). 2619-2628.
- Pappone C., et al. Catheter ablation of paroxysmal atrial fibrillation using a 3D mapping system. Circulation. 1999. 100(11). 1203-1208.
- Arentz T., et al. Small or large isolation areas around the pulmonary veins for the treatment of atrial fibrillation? Results from a prospective randomized study. Circulation. 2007. 115(24). 3057-3063.
- O’Donnell D., et al. Delayed cure despite early recurrence after pulmonary veinisolation for atrial fibrillation. Am. J. Cardiol. 2003. 91(1). 83-85.
- Jiang H., et al. Predictors of early recurrence and delayed cure after segmental pulmonary vein isolation for paroxysmal atrial fibrillation without structural heart disease. J. Interv. Card. Electrophysiol. 2006. 15(3). 157-163.
- Richter B., et al. Frequency of recurrence of atrial fibrillation within 48 hours after ablation and its impact on long-term outcome. Am. J. Cardiol. 2008. 101(6). 843-847.
- Vasamreddy C.R., et al. Predictors of recurrence following catheter ablation ofatrial fibrillation using an irrigated-tip ablation catheter. J. Cardiovasc. Electrophysiol. 2004. 15(6). 692-697.
- Bertaglia E., et al. Predictive value of early atrial tachyarrhythmias recurrence after circumferential anatomical pulmonary vein ablation. Pacing Clin. Electrophysiol. 2005. 28(5). 366-371.
- Willems S., et al. Redefining the blanking period after cathe-ter ablation for paroxysmal atrial fibrillation: insights from the
- ADVICE (Adenosine Following Pulmonary Vein Isolation to Target Dormant Conduction Elimination) trial. Circ. Arrhythm. Electrophysiol. 2016. 9(8).
- Reddy V.Y., et al. Balloon catheter ablation to treat paroxysmal atrial fibrillation: what is the level of pulmonary venous isolation? Heart Rhythm. 2008. 5(3). 353-360.
- Saliba W., et al. Atrial fibrillation ablation using a robotic catheter remote controlsystem: initial human experience and long-term follow-up results. J. Am. Coll. Cardiol. 2008. 51(25). 2407-2411.
- Hsieh M.H., et al. Alterations of heart rate variability after radiofrequency catheterablation of focal atrial fibrillation originating from pulmonary veins. Circulation. 1999. 100(22). 2237-2243.
- Fenelon G., Brugada P. Delayed effects of radiofrequency energy: mechanismsand clinical implications. Pacing Clin. Electrophysiol. 1996. 19(4 Pt 1). 484-489.
- Natale A., et al. Catheter ablation approach on the right side only for paroxysmalatrial fibrillation therapy: long-term results. Pacing Clin. Electrophysiol. 2000. 23(2). 224-233.
- Gerstenfeld E.P., et al. Mechanisms of organized left atrial tachycardias occurringafter pulmonary vein isolation. Circulation. 2004. 110(11). 1351-1357.
- Hindricks G. et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. European Heart Journal. 2020. 42. 373498 ESC GUIDELINES. doi: 10.1093/eurheartj/ehaa612.
- Roux J.F., et al. Antiarrhythmics After Ablation of Atrial Fibrillation (5A Study). Circulation. 2009. 120(12). 1036-1040.
- Leong-Sit P., et al. Antiarrhythmics after ablation of atrial fibrillation (5A Study): six-month follow-up study. Circ. Arrhythm. Electrophysiol. 2011. 4(1). 11-14.
- Duytschaever M., et al. PulmOnary vein isolation With vs. without continued antiarrhythmic Drug trEatment in subjects with Recurrent Atrial Fibrillation (POWDER AF): results from a multicentre randomized trial. Eur. Heart. J. 2018. 39. 14291437.
- Valembois L., et al. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation. Cochrane Database Syst. Rev. 2019. 9. CD005049.
- Kazuaki Kaitani, et al. Оn behalf of the EAST-AF Trial Investigators Efficacy of Antiarrhythmic Drugs Short-Term Use After Catheter Ablation for Atrial Fibrillation (EAST-AF) trial. European Heart Journal. 2016. 37. 610-618. doi: 10.1093/eurheartj/ehv501.
- Climent V.E., et al. Effects of pretreatment with intravenous flecainide on efficacy of external cardioversion of persistent atrial fibrillation. Pacing Clin. Electrophysiol. 2004. 27. 368372.
- Mussigbrodt A., et al. Vernakalant-facilitated electrical cardioversion: comparison of intravenous vernakalant and amiodarone for drug-enhanced electrical cardioversion of atrial fibrillation after failed electrical cardioversion. Europace. 2016. 18. 5156.
- Singh S.N., et al. Systematic electrocardioversion for atrial fibrillation and role of antiarrhythmic drugs: a substudy of the SAFE-T trial. Heart Rhythm. 2009. 6. 152155.
- Oral H., et al. Facilitating transthoracic cardioversion of atrial fibrillation with ibutilide pretreatment. N. Engl. J. Med. 1999. 340. 18491854.
- Baman T.S., et al. Time to cardioversion of recurrent atrial arrhythmias after catheter ablation of atrial fibrillation and long-term clinical outcome. J. Cardiovasc. Electrophysiol. 2009. 20(12). 1321-1325.
- Malasana G., et al. A strategy of rapid cardioversion minimizes the significance of early recurrent atrial tachyarrhythmias after ablation for atrial fibrillation. J. Cardiovasc. Electrophysiol. 2011. 22(7). 761-766.
- Sponga S., et al. Role of an aggressive rhythm control strategy on sinus rhythm maintenance following intra-operative radiofrequency ablation of atrial fibrillation in patients undergoing surgical correction of valvular disease. J. Cardiol. 2012. 60(4). 316-320.
- Sairaku A., et al. Learning curve for ablation of atrial fibrillation in mediumvolume centers. J. Cardiol. 2011. 57(3). 263-268.
- Sairaku A., et al. How many electrical cardioversions should be applied for repetitive recurrences of atrial arrhythmias following ablation of persistent atrial fibrillation? Europace. 2011. 13(12). 1703-1708.
- Voskoboinik A., et al. A comparison of early versus delayed elective electrical cardioversion for recurrent episodes of persistent atrial fibrillation: a multi-center study. Int. J. Cardiol. 2019. 284. 3337.