Вступ
Виразковий коліт (ВК), хронічне прогресуюче автоімунне запальне захворювання слизової оболонки (СО) товстої кишки, є актуальною проблемою дитячої гастроентерології, медико-соціальна значимість якої визначається неконтрольованим ростом його поширеності серед дитячого населення в усіх країнах світу, високим ризиком тяжких ускладнень, ранньою інвалідизацією [1–4].
Серед багатьох актуальних напрямків цієї важливої проблеми недостатньо висвітленими на сьогодні залишаються питання ефективності базисної терапії ВК на всіх етапах надання пацієнтам медичної допомоги.
Міжнародними й вітчизняними протоколами лікування ВК у дітей чітко сформульовані його принципи, а саме використання препаратів 5-АСК (месалазин) при легких і середньотяжких формах хвороби як для індукційної, так і для підтримуючої терапії; системних кортикостероїдів (преднізолон, метилпреднізолон) — для індукційної терапії високоактивних форм ВК; тіопуринів (азатіоприн, 6-меркаптопурин) — з метою підтримки стійкої ремісії, антагоністів фактора некрозу пухлини альфа (інфліксимаб, адалімумаб) — за відсутності ефекту від призначення кортикостероїдів.
Головною метою лікування ВК є досягнення стійкої ремісії шляхом загоєння слизової оболонки кишечника. Доведено, що відсутність або неповне її відновлення вірогідно підвищують ризик рецидиву хвороби, низьку резистентність до потенціальних тригерів запального процесу, погіршують прогноз перебігу захворювання і якість життя пацієнтів [9–11].
Як загоювання СО товстої кишки слід розцінювати такий її стан, який як макроскопічно, так і гістологічно еквівалентний такому в здорової людини [10].
Для оцінки стану слизової оболонки кишечника запропоновано низку клініко-лабораторних, інструментальних і гістологічних маркерів, до яких у педіатричній практиці належать індекс клінічної активності ВК (PUCAI), лабораторні показники (швидкість осідання еритроцитів (ШОЕ), тромбоцитоз, С-реактивний білок (СРБ), фекальний кальпротектин), ендоскопічні індекси (Rachmilewitz, Мейо), гістологічні маркери (шкала І.В. Василенко) [12, 24].
Останнім часом прогнозування стабільної ремісії ВК пов’язують з відновленням резистентності слизового бар’єра кишечника, порушеної внаслідок структурно-функціональних змін пре- і епітеліальних ланцюгів слизового бар’єра товстої кишки, зменшення синтезу і щільності слизу, які забезпечують її толерантність до антигенів різної етіології та захист проти патогенної та умовно-патогенної мікрофлори кишечника [4, 14–16].
Відомо, що міцність СО товстої кишки забезпечується різними факторами, серед яких важливу роль відіграють такі компоненти слизу, як секреторні (MUC2), мембраноасоційовані (MUC4) муцини, сімейство трефоїлових факторів, а саме інтестинальний трефоїловий фактор 3 (TFF3) [4, 18–20].
Секреторний муцин, який продукується келихоподібними клітинами слизової оболонки кишечника, є основним структурним компонентом внутрішнього шару слизу, що покриває епітеліальну вистилку товстої кишки. Трансмембранні муцини (MUC1, MUC4, MUC12 та ін.) формують щільний шар на апікальній поверхні епітеліальних клітин, підсилюючи захисні властивості слизового бар’єра кишечника [14, 16, 21, 28].
Ще одним важливим фактором захисту СО кишечника є інтестинальний трефоїловий фактор 3, який виявляється в місцях локалізації муцинів і бере участь не тільки в резистентності епітеліального бар’єра, але й у регенерації слизової оболонки товстої кишки шляхом зміцнення зв’язків глікопротеїнових муцинів слизового бар’єра [17, 25].
За даними літератури і власними дослідженнями, у хворих на ВК у періоді загострення встановлено зниження спроможності епітеліоцитів до синтезу слизу, втрата його щільності, низька експресія основних компонентів слизу секреторних і мембраноасоційованих муцинів і TFF3 [4, 5, 9, 19, 26, 28].
Враховуючи, що в доступній нам педіатричній літературі ми не знайшли публікацій щодо стану епітеліального бар’єра СО кишечника в динаміці лікування дітей з ВК, наводимо власне спостереження, метою якого була оцінка стану кишкового бар’єра при ВК за показниками MUC2, MUC4, TFF3 у слизовій оболонці товстої кишки.
Пацієнт Ц., 12 років (історія хвороби № 3133), надійшов у відділення старшого дитинства ДУ «Інститут пе–діатрії, акушерства та гінекології ім. академіка О.М. Лук’янової НАМН України» зі скаргами на абдомінальний біль, зниження апетиту, неоформлені випорожнення з домішками крові, слизу частотою 7–8 разів на добу з нічними епізодами, субфебрилітет, втрату маси тіла до 4 кг за останній місяць, швидку втомлюваність, слабкість.
Anamnesis vitae. Дитина друга в сім’ї, народився в строк, вага при народженні 4200 г, зріст 52 см. На грудному вигодуванні знаходився до 2 років, перший прикорм овочевий із 6 місяців. Зростав і розвивався за віком, щеплення згідно з календарем. Зі слів матері, дитина часто хворіла на гострі бронхіти, спостерігалась алергічна реакція на хліб, мед. Сімейний анамнез обтяжений онкологічними хворобами (рак шлунка в бабусі з боку матері).
Anamnesis morbid. Хворіє 3 роки; захворів гостро після перенесеної гострої респіраторної вірусної інфекції; дебют захворювання характеризувався частими рідкими випорожненнями з домішками крові й слизу, абдомінальними болями, субфебрилітетом, болями в попереково-крижовому відділі, зниженням маси тіла; пацієнт лікувався амбулаторно: антибактеріальна терапія, ферментні препарати, пробіотики — без позитивної динаміки, що обґрунтувало звернення дитини у відділення старшого дитинства з метою обстеження і встановлення діагнозу.
За сукупністю клініко-анамнестичних даних, результатів лабораторних, ендоскопічних, морфологічних досліджень, проведених відповідно до затвердженого МОЗ України протоколу діагностики та лікування запальних захворювань кишечника (ЗЗК), діагностовано: виразковий коліт, тотальний, період загострення, висока активність. Залізодефіцитна анемія I ступеня.
Об’єм лікувальних заходів включав модулен в індивідуальному дозуванні, метилпреднізолон per os 40 мг/добу (з розрахунку 1 мг/кг маси тіла), месалазин 3 г/добу, тардиферон (1 пігулка на добу), кальцимін (1 пігулка на добу).
У подальшому протягом двох років загострення хвороби на тлі підтримуючої терапії месалазином з розрахунку 30 мг/кг маси тіла спостерігались двічі на рік. Тригер захворювання встановлено не було. Курс системних кортикостероїдів у дозі 1,5 мг/кг маси тіла per os у поєднанні з месалазином у дозі 60 мг/кг маси тіла в періоді загострення з поступовим зниженням його дози до 30 мг/кг проводився лише один раз, що було обґрунтовано високою активністю клініко-ендоскопічних і морфологічних ознак виразкового коліту.
Під час прийому системних кортикостероїдів часто відзначалися болі в попереково-крижовому відділі хребта. Була проведена денситометрія, діагностовано остеопороз I ступеня. Рекомендовано носіння ортопедичного корсета, прийом препарату кальцію — кальций-Д3 нікомед 250 мг 3 рази на добу.
Status praesens objectives. При огляді загальний стан хворого середньої тяжкості, дитина у свідомості, на огляд реагує адекватно. Шкірні покриви бліді, сухі, видимі слизові оболонки звичайного кольору, периферичні лімфовузли не збільшено. Пацієнт астенічної статури, постава сутула, носить ортопедичний корсет упродовж 6 місяців. Підшкірно-жировий шар, тургор тканин знижений, вага 28 кг, зріст 129 см (індекс маси тіла 18,5 кг/м2).
Перкуторно над легенями ясний легеневий звук, аускультативно — дихання везикулярне, межі серця відповідають віковій нормі, тони ритмічні, ясні. Язик обкладено білим нальотом, живіт симетричний, незначно здутий, бере участь в акті дихання; видимої перистальтики й контурів петель кишечника на передній черевній стінці немає. При пальпації живіт болючий переважно в правій клубовій ділянці, ділянки товстої кишки пальпаторно звичайних властивостей. Печінка біля краю реберної дуги, селезінка не пальпується. Випорожнення кашоподібні (6–7 тип за Брістольською шкалою) з домішками крові, 6 раз на добу, з нічними позивами до одного разу. Сечовипускання достатнє.
Індекс клінічної активності хвороби (PUCAI) становив 55 балів, що відповідало середньотяжкому ступеню активності.
Лабораторні дослідження. Загальний аналіз крові: Нb — 90 г/л; ШОЕ — 22 мм/год; лейкоцити — 16 × 109/л; тромбоцити — 693 × 109/л; нейтрофіли паличкоядерні — 10 %. Коагулограма: протромбіновий час — 11,2 с; активність протромбіну за Квіком — 94,9; міжнародне нормалізоване співвідношення — 1,10; фібриноген — 4,36 г/л; фібрин — 20 мг; активний частковий тромбопластиновий час — 33,0 с; СРБ — 32 мг/л, р-ANCA — 1 : 80, фекальний кальпротектин — 800 мкг/г.
За даними ультразвукового дослідження (УЗД) органів черевної порожнини діагностовано ознаки реактивних змін паренхіми печінки, тканини підшлункової залози, наявність мезентеріальних лімфатичних вузлів у правій здухвинній і параумбілікальній ділянці розміром до 14 мм звичайної структури. УЗД кишечника: ознаки запальних змін стінок кишечника, мезаденіту.
Результати денситометрії: структурно-функціональний стан кісткової тканини 0,645–2,3, зниження кісткової маси.
За результатами фіброколоноілеоскопії діагностовано характерні ознаки запально-деструктивного процесу слизової оболонки товстої кишки: набряк, гіперемія, контактна кровоточивість, змазаний судинний рисунок, наявність виразок, ерозій; ендоскопічний індекс Rachmilewitz становив 10 балів, що відповідало високій активності запалення.
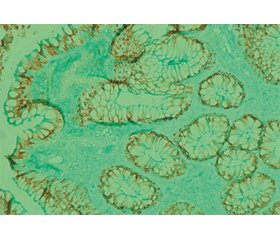
При гістологічному дослідженні біоптатів СО товстої кишки виявлені типові критерії її ураження — гіпотрофія СО, наявність ерозій, крипт-абсцесів, порушення архітектоніки крипт, зменшення кількості келихоподібних клітин, фіброз строми. Гістологічна активність за шкалою І.В. Василенко відповідала високому ступеню.
Імуногістохімічне дослідження експресії MUC2 і MUC4 виявило відсутність забарвлення вакуоль келихоподібних клітин на фоні помірного забарвлення цитоплазми (рис. 1, 2).
Експресія TFF3 спостерігалася в келихоподібних клітинах у вигляді слабкого забарвлення (1 бал) вакуоль з поширеністю 2 бали (рис. 3).
Пацієнт отримував таке лікування: індивідуальний лікувальний стіл (безмолочний, аглютеновий) з урахуванням уподобань хворої дитини, повноцінну ізокалорійну лікувальну суміш по 250 мл 2 рази на добу між прийомами їжі; системні кортикостероїди (метилпреднізолон з розрахунку 1,5 мг/кг маси тіла 3 тижні з поступовим зниженням на 5–2,5 мг щотижня до повної відміни); препарати 5-АСК із розрахунку 40 мг/кг, протианемічні препарати (мальтофер 5 мл на добу per os), інгібітори протонної помпи (омез 20 мг на добу), прокінетики (мотиліум 3 пігулки на добу, 7 днів), антибіотики (метронідазол 80 мл в/в 2 рази на добу), пробіотики (ентерожерміна 1 флакон 2 рази на добу); вітамінно-мінеральні комплекси.
Пацієнт виписаний на двадцяту добу перебування у відділенні з позитивною клініко-лабораторною динамікою.
Повторно дитина надходить у відділення через 6 місяців безперервного лікування, яке включало системні кортикостероїди з поступовим зниженням дози протягом 3 місяців, тіопурини в дозі 75 мг на добу, ферментні, протианемічні препарати, пробіотики за показаннями.
За даними комплексного обстеження пацієнта стійкої ремісії хвороби не було досягнуто — клінічні ознаки відповідали мінімальному ступеню активності (PUCAI — 30 балів), ендоскопічні — помірному (індекс Rachmilewitz — 6 балів); мали місце маркери гостроти запального процесу — лейкоцитоз (13,8 × 109/л), тромбоцитоз (670 × 109/л), СРБ — 16,1 мг/л, фекальний кальпротектин — 500 мкг/г.
При гістологічному дослідженні біоптатів СО товстої кишки на фоні хронічного запального процесу з ознаками гіпотрофії, порушення архітектоніки крипт, зменшення кількості келихоподібних клітин були виявлені прояви активності запального процесу — ерозії в слизових оболонках, виражена дифузна запальна інфільтрація власної пластинки з наявністю еозинофілів і нейтрофілів.
Не було встановлено і нормалізації показників епітеліального бар’єра СО кишечника — експресія MUC2 була відсутня в більшості вакуоль келихоподібних клітин; експресія MUC4, як і до лікування, характеризувалася відсутністю забарвлення вакуоль келихоподібних клітин (0 балів); експресія TFF3 у келихоподібних клітинах спостерігалася у вигляді помірного (2 бали) і вираженого (3 бали) в низці випадків забарвлення їх вакуоль (рис. 4–6).
/64.jpg)
Отже, дані катамнестичного спостереження пацієнта з тривалим хронічним рецидивуючим перебігом ВК засвідчили відсутність досягнення ремісії захворювання, що підтверджувалось як наявністю клініко-лабораторної та ендоскопічної активності ВК, так і відсутністю відновлення порушених структурно-функціональних змін СО кишечника та її епітеліального бар’єра. А саме: зберігалася деструкція його муцинового прошарку, особливо за рахунок щільного компонента, сформованого MUC4, що поряд з відсутністю експресії MUC2 у поверхневому епітелії та порушенням взаємозв’язку між TFF3 і муцинами може розглядатися як одна з патогенетичних ланок прогресування хвороби, вагомий фактор ризику розвитку більш глибоких деструктивних змін слизової оболонки, предиктор клінічного рецидиву.
Обговорення
Наведений клінічний випадок довготривалого перебігу ВК у дитини підтверджує існуючу точку зору щодо визначення даної патології як надзвичайно тяжкого запального захворювання кишечника, яке потребує не лише постійного динамічного моніторингу клініко-лабораторних, ендоскопічних і гістологічних даних, але й оцінки стану епітеліального бар’єра товстої кишки як важливого прогностичного маркера прогресування хвороби.
Обґрунтуванням доцільності проведення дослідження слугували дані літератури відносно висвітлення ролі цитопротективного бар’єра СО шлунково-кишкового тракту в патогенезі хвороб органів травлення.
Натепер завдяки численним клініко-експериментальним роботам сформувалося чітке уявлення про епітеліальний бар’єр СО товстої кишки, який складається зі шару слизу, глікокаліксу і власної епітеліальної висилки і створює міцний бар’єр для бактерій і великих молекул, бере участь в регуляції імунних реакцій і коменсальної мікрофлори.
Сьогодні увага дослідників прикута до вивчення стану шарів кишкового слизу, а саме розрідженого, що складається зі щільної сітчастої мережі MUC2 і захищає від мікробної інвазії, ендо- та екзогенних подразників. Не меншу значимість у захисті СО кишечника мають розташовані в апікальних мембранах епітеліальних клітин MUC4 — основні компоненти надмембранного комплексу, що бере участь у створенні клітинних контактів. Крім муцинів до складу слизу входять трефоїлові пептиди (в слизу товстої кишки — TFF3), які відповідають за еластичні властивості слизу.
Згідно з отриманими нами даними, у дитини з довготривалим рецидивуючим перебігом ВК у періоді загострення хвороби встановлено суттєвий дефект захисного бар’єра кишечника, на що вказувало зменшення загальної кількості келихоподібних клітин, відсутність експресії як синтезуючих, так і мембраноасоційованих муцинів на тлі недостатньої компенсаторної експресії трефоїлового фактора (TFF3). Важливо, що встановлені зміни визначених муцинів і трефоїлового пептиду збіглися з клініко-ендоскопічною та морфологічною активністю ВК упродовж всього терміну спостереження за хворим і дали підставу вважати, що встановлена проникність СО кишечника була значущим фактором у підтримці й рецидивуванні запального процесу.
Отже, отримані результати свідчать, що тривалий перебіг ВК у нашого пацієнта супроводжувався суттєвими змінами як розрідженого, так і щільного шарів слизу, аж до їх виснаження за відсутності компенсаторних механізмів захисту епітеліального бар’єра. Втрата толерантності до бактеріальних, харчових та інших антигенів, порушення складу мікробіому, дефекти імунних реакцій хворої дитини як наслідок деструкцій захисних факторів СО товстої кишки можуть розглядатися як важливий ланцюг патофізіологічного процесу при ВК у дітей.
Отримані дані свідчать на користь суттєвої ролі порушень захисного бар’єра СО кишечника в патогенезі ВК у дитячому віці й обґрунтовують доцільність використання показників стану епітеліального бар’єра також як маркера оптимізації тактики лікування хронічних рецидивуючих форм ВК, а саме вибору терміну призначення препаратів біологічної терапії.
Наведені в статті імуногістохімічні дослідження є надзвичайно дорогим обстеженням, яке в Україні ще не може бути впроваджене як один із ключових методів діагностики стану слизового бар’єра при ЗЗК. У зв’язку з цим для оцінки стану резистентності епітеліального бар’єра товстої кишки можна рекомендувати використання PAS-реакції та реакції з альціановим синім pH 2,5. Результати реакції оцінюються залежно від ступеня забарвлення епітеліальних клітин і визначаються кількістю плюсів: + — слабо виражена інтенсивність забарвлення; ++ — помірно виражене забарвлення; +++ — виражене забарвлення. Слабо або помірно виражене забарвлення вказує на зменшення синтезу слизу, втрату його в’язкопружності.
Висновки
1. Наведений клінічний випадок демонструє складності лікування дитини з рецидивуючим перебігом виразкового коліту, що було зумовлено суттєвим порушенням епітеліального бар’єра СО товстої кишки, який сприяв його проникності, втраті толерантності СО щодо різноманітних антигенів, пролонгації змін мікробіоти кишечника, дерегуляції місцевої імунної відповіді.
2. Вивчення стану епітеліального бар’єра СО кишечника в динаміці лікування ВК показало, що порушення захисної його функції може бути одним з факторів, що сприяють прогресуванню запального процесу.
3. Опис спектра гістологічних та імуногістохімічних змін СО товстої кишки в дітей з виразковим колітом у періоді загострення і в катамнезі допоможе практикуючим лікарям своєчасно оптимізувати тактику лікування пацієнтів, зменшити ризик ускладнень, поліпшити прогноз хвороби.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Внесок авторів. Денисова М.Ф. — аналіз отриманих даних, написання тексту; Букулова Н.Ю. — концепція і дизайн дослідження, збирання матеріалу; Арчакова Т.М. — обробка гістологічних даних та аналіз.
Отримано/Received 02.11.2023
Рецензовано/Revised 15.11.2023
Прийнято до друку/Accepted 24.11.2023
/63.jpg)
/64.jpg)

/63_2.jpg)