Журнал «Медицина неотложных состояний» Том 19, №8, 2023
Вернуться к номеру
Оптимізація консервативного лікування пацієнтів з тяжкою серцевою недостатністю шляхом застосування гемосорбції
Авторы: Денисюк К.В.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
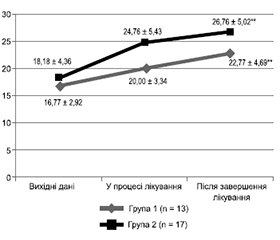
Актуальність. Серцева недостатність (СН) — це складна кардіологічна патологія, яка є основною причиною госпіталізації серед дорослих та характеризується високою летальністю. Дилатаційна кардіоміопатія (ДКМП) є найпоширенішою причиною СН, і вона може мати летальний результат вже через декілька років після появи перших симптомів. Велика кількість пацієнтів із СН залишаються рефрактерними до медикаментозної терапії, незважаючи на її постійний розвиток та удосконалення. Метою цього дослідження є порівняння ефективності консервативного лікування пацієнтів з тяжкою СН, що виникла на фоні ДКМП, із застосуванням медикаментозної терапії та її комбінації з курсом гемосорбції (ГС). Матеріали та методи. Проаналізовано результати лікування 30 пацієнтів з тяжкою СН на фоні ДКМП (NYHA III–IV, фракція викиду лівого шлуночка (ФВ ЛШ) < 30 %). Пацієнти групи 1 (n = 13; NT-proBNP 4546,23 ± 3265,01 пг/мл; ФВ ЛШ 16,77 ± 2,92 %; кінцево-діастолічний об’єм (КДО) ЛШ 261,31 ± 60,60 мл, кінцево-систолічний об’єм (КСО) ЛШ 214,85 ± 49,44 мл) отримували медикаментозну терапію згідно з локальними протоколами. У групі 2 (n = 17; NT-proBNP 3974,49 ± 3550,17 пг/мл; ФВ ЛШ 18,18 ± 4,36 %; КДО ЛШ 261,12 ± 79,96 мл, КСО ЛШ 212,06 ± 71,67 мл) медикаментозне лікування було доповнене курсом із 3 процедур ГС із застосуванням гранульованого делігандинізуючого гемосорбенту. Результати. Пацієнти обох груп дослідження відмітили поліпшення самопочуття та зменшення вираженості симптомів захворювання. Рівень NT-proBNP знизився до 2609,92 ± 1465,14 пг/мл (р < 0,01) у групі 1 до 975,35 ± 511,55 пг/мл (р < 0,05) у групі 2. ФВ ЛШ зросла до 22,77 ± 4,69 % та 26,76 ± 5,02 % відповідно по групах (р < 0,01). У пацієнтів групи 1 показники КДО ЛШ та КСО ЛШ змінились до 262,22 ± 40,92 мл та 211,33 ± 35,22 мл відповідно. У пацієнтів групи 2 відзначене суттєве зменшення КДО ЛШ до 228,94 ± 73,16 мл та КСО ЛШ до 170,88 ± 60,28 мл (р < 0,01). Висновки. Застосування ГС у комплексі з медикаментозною терапією в пацієнтів з тяжкою СН на фоні ДКМП сприяє поліпшенню клінічного стану пацієнтів та систолічної функції ЛШ.
Background. Heart failure (HF) is a complex cardiac pathology that is the main cause of hospitalisation among adults and is characterised by a high mortality. Dilated cardiomyopathy (DCM) is the most common cause of HF, and it can be fatal within a few years after the first symptoms appear. Many patients with HF remain refractory to medical therapy, despite its constant development and improvement. The study aims to compare the effectiveness of conservative treatment of patients with severe HF that occurred on the background of DCM using drug therapy and its combination with a course of hemosorption (HS). Materials and methods. We analysed treatment outcomes in 30 patients with severe HF against DCM (New York Heart Association class III–V, left ventricular ejection fraction (LV EF) < 30 %). Patients in group 1 (n = 13; N-terminal fragment of brain natriuretic peptide precursor (NT-pro BNP) 4,546.23 ± ± 3,265.01 pg/ml; LV EF 16.77 ± 2.92 %; LV end-diastolic volume (EDV) 261.31 ± 60.60 ml, LV end-systolic volume (ESV) 214.85 ± 49.44 ml) received drug therapy according to local protocols. In group 2 (n = 17; NT-pro BNP 3,974.49 ± 3,550.17 pg/ml; LV EF 18.18 ± 4.36 %; LV EDV 261.12 ± 79.96 ml, LV ESV 212.06 ± 71.67 ml), medical treatment was supplemented with a course of 3 HS procedures using granular deligandizing hemosorbent. Results. Patients in both study groups noted an improvement in well-being and a decrease in the severity of symptoms. The level of NT-pro BNP decreased to 2,609.92 ± 1,465.14 pg/ml (p < 0.01) in group 1 and to 975.35 ± 511.55 pg/ml (p < 0.05) in group 2. LV EF increased to 22.77 ± 4.69 % and 26.76 ± 5.02 %, respectively, in the groups (p < 0.01). In patients of group 1, LV EDV and LV ESV changed to 262.22 ± 40.92 ml and 211.33 ± 35.22 ml, respectively. In group 2, there was a significant decrease in LV EDV to 228.94 ± 73.16 ml and LV ESV to 170.88 ± 60.28 ml (p < 0.01). Conclusions. The use of HS in combination with drug therapy for severe HF on the background of DCM improves the clinical status of patients and LV systolic function.
гемосорбція; дилатаційна кардіоміопатія; серцева недостатність; мозковий натрійуретичний пептид
hemosorption; dilated cardiomyopathy; heart failure; brain natriuretic peptide
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- McDonagh T.A., Metra M., Adamo M. et al. ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur. Heart J. 2021 Sep 21. 42(36). 3599-3726. doi: 10.1093/eurheartj/ehab368.
- Lippi G., Sanchis-Gomar F. Global epidemiology and future trends of heart failure. AME Med. J. 2020. 5. 15. doi: 10.21037/amj.2020.03.03.
- Rosano G.M.C., Seferovic P., Savarese G., et al. Impact analysis of heart failure across European countries: an ESC-HFA position paper. ESC Heart Fail. 2022. 9(5). 2767-2778. doi: 10.1002/ehf2.14076.
- Jones N.R., Roalfe A.K., Adoki I., Hobbs F.D.R., Taylor C.J. Survival of patients with chronic heart failure in the community: a systematic review and meta-analysis. Eur. J. Heart Fail. 2019. 21(11). 1306-1325. doi: 10.1002/ejhf.1594.
- Patil S., Shah M., Patel B., Agarwal M., Ram P., Alla V.M. Readmissions Among Patients Admitted with Acute Decompensated Heart Failure Based on Income Quartiles. Mayo Clin. Proc. 2019. 94(10). 1939-1950. doi: 10.1016/j.mayocp.2019.05.027.
- Virani S.S., Alonso A., Benjamin E.J., et al. Heart Disease and Stroke Statistics-2020 Update: A Report from the American Heart Association. Circulation. 2020. 141(9). e139-e596. doi: 10.1161/CIR.0000000000000757.
- Chandra S., Saraf S., Chaudhary G., et al. Prevalence and trends of occult coronary artery disease in patients with dilated cardiomyopathy. Am. J. Cardiovasc. Dis. 2020. 10(5). 557-563. PMID: 33489458; PMCID: PMC7811921.
- Schultheiss H.P., Fairweather D., Caforio A.L.P. et al. Dilated cardiomyopathy. Nat. Rev. Dis. Primers. 2019. 5. 32. doi: 10.1038/s41572-019-0084-1.
- GBD 2015 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016. 388(10053). 1545-1602. doi: 10.1016/S0140-6736(16)31678-6.
- Ponikowski P., Voors A.A., Anker S.D., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology. Developed with the special contribution of the Heart Failure Association of the ESC. Eur. J. Heart Fail. 2016. 18(8). 891-975. doi: 10.1002/ejhf.592.
- Omote K., Verbrugge F.H., Borlaug B.A. Heart Failure with Preserved Ejection Fraction: Mechanisms and Treatment Strategies. Annu. Rev. Med. 2022. 73. 321-337. doi: 10.1146/annurev-med-042220-022745.
- Castiglione V., Aimo A., Vergaro G., Saccaro L., Passino C., Emdin M. Biomarkers for the diagnosis and management of heart failure. Heart Fail Rev. 2022. 27(2). 625-643. doi: 10.1007/s10741-021-10105-w.
- Yancy C.W., Jessup M., Bozkurt B., et al. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017. 136(6). e137-e161. doi: 10.1161/CIR.0000000000000509.
- Mascolo A., di Mauro G., Cappetta D., et al. Current and future therapeutic perspective in chronic heart failure. Pharmacol. Res. 2022. 175. 106035. doi: 10.1016/j.phrs.2021.106035.
- Groenewegen A., Rutten F.H., Mosterd A., Hoes A.W. Epidemiology of heart failure. Eur. J. Heart Fail. 2020. 22(8). 1342-1356. doi: 10.1002/ejhf.1858.
- Dogan G., Hanke J., Puntigam J., Haverich A., Schmitto J.D. Hemoadsorption in cardiac shock with bi ventricular failure and giant-cell myocarditis: A case report. Int. J. Artif Organs. 2018. 41(8). 474-479. doi: 10.1177/0391398818777362.
- Ameling S., Bhardwaj G., Hammer E., et al. Changes of myocardial gene expression and protein composition in patients with dilated cardiomyopathy after immunoadsorption with subsequent immunoglobulin substitution [published correction appears in Basic Res. Cardiol. 2017 Jul. 112(4). 40]. Basic Res. Cardiol. 2016. 111(5). 53. doi: 10.1007/s00395-016-0569-y.
- Ohlow M.A., Brunelli M., Schreiber M., Lauer B. Therapeutic effect of immunoadsorption and subsequent immunoglobulin substitution in patients with dilated cardiomyopathy: Results from the observational prospective Bad Berka Registry. J. Cardiol. 2017. 69(2). 409-416. doi: 10.1016/j.jjcc.2016.07.014.
- Rosano G.M.C., Seferovic P., Savarese G., et al. Impact analysis of heart failure across European countries: an ESC-HFA position paper [published correction appears in ESC Heart Fail. 2023 Jun. 10(3). 2143]. ESC Heart Fail. 2022. 9(5). 2767-2778. doi: 10.1002/ehf2.14076.
- Metra M., Tomasoni D., Adamo M., et al. Worsening of chronic heart failure: definition, epidemiology, management and prevention. A clinical consensus statement by the Heart Failure Association of the European Society of Cardiology. Eur. J. Heart Fail. 2023. 25(6). 776-791. doi: 10.1002/ejhf.2874.
- Altinier A., Paldino A., Gigli M., Pappalardo A., Sinagra G. Current Management and Treatment. In: Sinagra G., Merlo M., Pinamonti B., eds. Dilated Cardiomyopathy: From Genetics to Clinical Management. Cham (CH): Springer; May 18, 2019. 199-215.
- Mebazaa A., Solal A.C., Colombo P. Assessing and treating congestion in acute decompensated heart failure: are we seeing the light at the end of the tunnel? European Heart Journal. 2023. 44(1). 51-53. doi: 10.1093/eurheartj/ehac680.
- Kępińska K., Adamczak D.M., Kałużna-Oleksy M. Advanced heart failure: A review. Adv. Clin. Exp. Med. 2019. 28(8). 1143-1148. doi: 10.17219/acem/103669.
- Cavusoglu Y., Tahmazov S., Murat S., Akay O.M. Immunoadsorption therapy in refractory heart failure patients with dilated cardiomyopathy: a potential therapeutic option. Rev. Assoc. Med. Bras. 1992. 2023. 69(1). 90-96. doi: 10.1590/1806-9282.20220784.
- Bian R.T., Wang Z.T., Li W.Y. Immunoadsorption treatment for dilated cardiomyopathy: A PRISMA — compliant systematic review and meta-analysis. Medicine (Baltimore). 2021. 100(26). e26475. doi: 10.1097/MD.0000000000026475.
- Seferović P.M., Polovina M., Bauersachs J., et al. Heart failure in cardiomyopathies: a position paper from the Heart Failure Association of the European Society of Cardiology. Eur. J. Heart Fail. 2019. 21(5). 553-576. doi: 10.1002/ejhf.1461.
- Iannaccone G., Scacciavillani R., Del Buono M.G., et al. Weathering the Cytokine Storm in COVID-19: Therapeutic Implications. Cardiorenal Med. 2020. 10(5). 277-287. doi: 10.1159/000509483.
- Ronco C., Reis T., De Rosa S. Coronavirus Epidemic and Extracorporeal Therapies in Intensive Care: si vis pacem para bellum. Blood Purif. 2020. 49(3). 255-258. doi: 10.1159/000507039.
- Iannaccone G., Scacciavillani R., Del Buono M.G., et al. Weathering the Cytokine Storm in COVID-19: Therapeutic Implications. Cardiorenal Med. 2020. 10(5). 277-287. doi: 10.1159/000509483.