Журнал «Медицина неотложных состояний» Том 20, №1, 2024
Вернуться к номеру
Інтегрований підхід до лікування інфекційного ендокардиту, ускладненого гострою серцевою недостатністю, з використанням інтраопераційної гемосорбції
Авторы: Колтунова Г.Б.
ДУ «Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
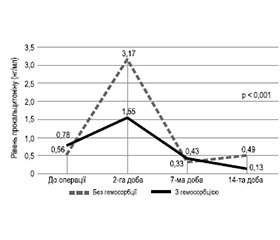
Актуальність. Гемосорбція відіграє одну з ключових ролей у лікуванні інфекційного ендокардиту. Частота реєстрації інфекційного ендокардиту становить 3–7 випадків на 100 000 осіб за рік, а рівень внутрішньолікарняної смертності коливається від 14 до 22 % за рахунок гострої серцевої недостатності, яка реєструється в 19–73 % пацієнтів з інфекційним ендокардитом і є одним з показань до екстреного хірургічного втручання. Використання гемосорбції є багатообіцяючою стратегією, яка має потенціал для поліпшення загального лікування і результатів у складному перебігу інфекційного ендокардиту, ускладненого гострою серцевою недостатністю. Мета: аналіз ефективності застосування інтраопераційної гемосорбції у хворих на інфекційний ендокардит, ускладнений гострою серцевою недостатністю. Матеріали та методи. У дослідження були включені клінічні дані 100 хворих, прооперованих в умовах штучного кровообігу з приводу активного інфекційного ендокардиту з 01.01.2020 до 31.12.2020. Серед загальної когорти пацієнтів у 25 випадках в інтраопераційному періоді проводилась гемосорбція з використанням гемоперфузійних картриджів. Був проведений аналіз клінічних характеристик і біохімічних показників у хворих на інфекційний ендокардит залежно від інтраопераційного застосування гемосорбції. Результати. Виявлено вірогідні відмінності між групами за тривалістю інотропної та вазопресорної підтримки. Тривалість інфузії добутаміну в групі хворих без гемосорбції була вірогідно більшою — 59,4 ± 6,2 год порівняно з 38,2 ± 2,7 год у групі хворих на інфекційний ендокардит, оперованих з використанням інтраопераційної гемосорбції (р = 0,047). Використання норадреналіну на періопераційному етапі також мало більшу тривалість у групі хворих без гемосорбції — 39,4 ± 8,2 год (р = 0,053). Зменшилась тривалість штучної вентиляції легень у хворих на інфекційний ендокардит — 16,1 ± 0,9 год порівняно з 19,3 ± 1,2 год у групі хворих без гемосорбції (р = 0,091). При застосуванні гемосорбції відбулось радикальне зменшення рівнів С-реактивного протеїну і прокальцитоніну на всіх етапах дослідження. Висновки. Наше дослідження показало, що гемосорбція може бути ефективною стратегією в лікуванні інфекційного ендокардиту, поліпшуючи перебіг раннього післяопераційного періоду і динаміку маркерів запалення.
Background. Hemoadsorption plays a pivotal role in the treatment of infectious endocarditis. The incidence of infectious endocarditis is reported at 3–7 cases per 100,000 individuals annually, with an in-hospital mortality rate ranging from 14 to 22 %. This is mainly attributed to acute heart failure, observed in 19 to 73 % of patients with infectious endocarditis, necessitating urgent surgical intervention. Hemoadsorption presents a promising strategy with a potential to improve overall treatment and outcomes in infectious endocarditis complicated by acute heart failure. The purpose was to assess the efficacy of intraoperative hemoadsorption in patients with infectious endocarditis complicated by acute heart failure. Materials and methods. The research included clinical data from 100 patients who underwent surgery for active infectious endocarditis using cardiopulmonary bypass between January 1, 2020, and December 31, 2020. In 25 cases from the general cohort, intraope-rative hemoadsorption was performed with the use of hemoperfusion cartridges. Analysis of clinical characteristics and biochemical data was conducted in patients with infectious endocarditis based on the intraoperative application of hemoadsorption. Results. Significant differences were observed between groups in the duration of inotropic and vasopressor support. The duration of dobutamine infusion in the group without hemoadsorption was significantly longer — 59.4 ± 6.2 hours compared to 38.2 ± 2.7 hours in patients with infectious endocarditis who were operated using intraoperative hemoadsorption (p = 0.047). Norepinephrine in the perioperative period was also used longer in the group without hemoadsorption — 39.4 ± 8.2 hours (p = 0.053). The duration of mechanical ventilation in patients with infectious endocarditis was reduced — 16.1 ± 0.9 hours compared to 19.3 ± 1.2 hours in the group without hemoadsorption (p = 0.091). With the application of hemoadsorption, there was a radical decrease in the levels of C-reactive protein and procalcitonin at all stages of the study. Conclusions. Our study suggests that hemoadsorption can be an effective strategy in the treatment of infectious endocarditis, improving the course of the early postoperative period and the dynamics of inflammatory markers.
медіатори запалення; сепсис; гемосорбція; N-кінцевий мозковий натрійуретичний пропептид B-типу; симпатоміметична підтримка; гемофільтрація
inflammatory mediators; sepsis; hemoadsorption; N-ter-minal pro-B-type natriuretic peptide; inotropic support; hemofiltration
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Habib G., Lancellotti P., Antunes M.J., Bongiorni M.G., Casalta, J.P., Del Zotti F. et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur. Heart J. 2015. 36. 3075-3128.
- Sy R.W., Kritharides L. Health care exposure and age in infective endocarditis: results of a contemporary population-based profile of 1536 patients in Australia. European Heart Journal. August 2010. Vol. 31. Issue 15. P. 1890-1897. https://doi.org/10.1093/eurheartj/ehq110.
- Selton-Suty С., Célard М., Le Moing V., Doco-Lecompte Т., Chirouze С., Iung В. et al. On behalf of the AEPEI Study Groupa, Preeminence of Staphylococcus aureus in Infective Endocarditis: A 1-Year Population-Based Survey. Clinical Infective Diseases. 2012. Vol. 54, Issue 9. P. 1230-1239. https://doi.org/10.1093/cid/cis199.
- Bannay A., Hoen B., Duval X., Obadia J.F., Selton-Suty C., Le Moing V. et al.; AEPEI Study Group. The impact of valve surgery on short- and long-term mortality in left-sided infective endocarditis: do differences in methodological approaches explain previous conflicting results? Eur. Heart J. 2011 Aug. 32(16). 2003-15. doi: 10.1093/eurheartj/ehp008. Epub 2009 Feb 9. PMID: 19208650.
- Momtazmanesh S., Saeedi Moghaddam S., Malakan Rad E., Azadnajafabad S., Ebrahimi N., Mohammadi E. et al. Global, regional, and national burden and quality of care index of endocarditis: the global burden of disease study 1990–2019. Eur. J. Prev. Cardiol. 2022 May 27. 29(8). 1287-1297. doi: 10.1093/eurjpc/zwab211. PMID: 34897404.
- Chen H., Zhan Y., Zhang K., Gao Y., Chen L., Zhan J., Chen Z., Zeng Z. The Global, Regional, and National Burden and Trends of Infective Endocarditis From 1990 to 2019: Results From the Global Burden of Disease Study 2019. Front. Med. (Lausanne). 2022 Mar 9. 9. 774224. doi: 10.3389/fmed.2022.774224. PMID: 35355601; PMCID: PMC8959916.
- Delgado V., Marsan N.A., de Waha S., Bonaros N., Brida М., Burri Н. et al.; ESC Scientific Document Group. 2023 ESC Guidelines for the management of endocarditis: Developed by the task force on the management of endocarditis of the European Society of Cardiology (ESC) Endorsed by the European Association for Cardio-Thoracic Surgery (EACTS) and the European Association of Nuclear Medicine (EANM). European Heart Journal. 2023. Vol. 44. Issue 39. P. 3948-4042. https://doi.org/10.1093/eurheartj/ehad193.
- Kuijpers J.M., Koolbergen D.R., Groenink M., Peels K.C.H., Reichert C.L.A., Post M.C. et al. Incidence, risk factors, and predictors of infective endocarditis in adult congenital heart disease: focus on the use of prosthetic material. Eur. Heart. J. 2017 Jul 7. 38(26). 2048-2056. doi: 10.1093/eurheartj/ehw591. PMID: 28065906.
- Kiefer T., Park L., Tribouilloy C., Cortes C., Casillo R., Chu V. et al. Association between valvular surgery and mortality among patients with infective endocarditis complicated by heart failure. JAMA. 2011 Nov 23. 306(20). 2239-47. doi: 10.1001/jama.2011.1701. PMID: 22110106; PMCID: PMC5030065.
- Lalani T., Chu V.H., Park L.P., Cecchi E., Corey G.R., Durante-Mangoni E. et al.; International Collaboration on Endocarditis — Prospective Cohort Study Investigators. In-hospital and 1-year mortality in patients undergoing early surgery for prosthetic valve endocarditis. JAMA Intern. Med. 2013 Sep 9. 173(16). 1495-504. doi: 10.1001/jamainternmed.2013.8203. Erratum in: JAMA Intern. Med. 2013 Oct 28. 173(19). 1846. PMID: 23857547.
- López J., Sevilla T., Vilacosta I., García H., Sarriá C., Pozo E. et al. Clinical significance of congestive heart failure in prosthetic valve endocarditis. A multicenter study with 257 patients. Rev. Esp. Cardiol. (Engl. Ed). 2013 May. 66(5). 384-90. doi: 10.1016/j.rec.2012.10.022. Epub 2013 Feb 22. PMID: 24775821.
- Nadji G., Rusinaru D., Rémadi J.P., Jeu A., Sorel C., Tribouilloy C. Heart failure in left-sided native valve infective endocarditis: characteristics, prognosis, and results of surgical treatment. Eur. J. Heart Fail. 2009 Jul. 11(7). 668-75. doi: 10.1093/eurjhf/hfp077. PMID: 19553397.
- Pericàs J.M., Hernández-Meneses M., Muñoz P., Martínez-Sellés M., Álvarez-Uria A., de Alarcón A. et al.; Spanish Collaboration on Endocarditis — Grupo de Apoyo al Manejo de la Endocarditis Infecciosa en España (GAMES). Characteristics and Outcome of Acute Heart Failure in Infective Endocarditis: Focus on Cardiogenic Shock. Clin. Infect. Dis. 2021 Sep 7. 73(5). 765-774. doi: 10.1093/cid/ciab098. PMID: 33560404.
- Siciliano R.F., Gualandro D.M., Bittencourt M.S., Paixão M., Marcondes-Braga F., Soeiro A.M. et al. Biomarkers for prediction of mortality in left-sided infective endocarditis. Int. J. Infect. Dis. 2020 Jul. 96. 25-30. doi: 10.1016/j.ijid.2020.03.009. Epub 2020 Mar 10. PMID: 32169690.
- Wei X.B., Liu Y.H., He P.C., Yu D.Q., Zhou Y.L., Tan N., Chen J.Y. Prognostic value of N-terminal prohormone brain natriuretic peptide for in-hospital and long-term outcomes in patients with infective endocarditis. Eur. J. Prev. Cardiol. 2017 May. 24(7). 676-684. doi: 10.1177/2047487316686436. Epub 2017 Jan 9. PMID: 28067531.
- Lalani T., Chu V.H., Park L.P., Cecchi E., Corey G.R., Durante-Mangoni E. et al.; International Collaboration on Endocarditis — Prospective Cohort Study Investigators. In-hospital and 1-year mortality in patients undergoing early surgery for prosthetic valve endocarditis. JAMA Intern. Med. 2013 Sep 9. 173(16). 1495-504. doi: 10.1001/jamainternmed.2013.8203. Erratum in: JAMA Intern. Med. 2013 Oct 28. 173(19). 1846. PMID: 23857547.
- MacCallum N.S., Finney S.J., Gordon S.E., Quinlan G.J., –Evans T.W. Modified criteria for the systemic inflammatory response syndrome improves their utility following cardiac surgery. Chest. 2014 Jun. 145(6). 1197-1203. doi: 10.1378/chest.13-1023. PMID: 24576975.
- Crawford T.C., Magruder J.T., Grimm J.C., Suarez-Pierre A., Sciortino C.M., Mandal K. et al. Complications After Cardiac Operations: All Are Not Created Equal. Ann. Thorac. Surg. 2017 Jan. 103(1). 32-40. doi: 10.1016/j.athoracsur.2016.10.022. Epub 2016 Nov 22. PMID: 27884410.
- Bustamante J., Arévalo A., Tamayo E., Sarria C., Aguilar-Blanco E.M., Heredia M. et al. Cytokine profiles linked to fatal outcome in infective prosthetic valve endocarditis. APMIS. 2014 Jun. 122(6). 526-9. doi: 10.1111/apm.12189. Epub 2013 Sep 30. PMID: 24106887.
- Ronco C., Bellomo R. Hemoperfusion: technical aspects and state of the art. Crit. Care. 2022 May 12. 26(1). 135. doi: 10.1186/s13054-022-04009-w. PMID: 35549999; PMCID: PMC9097563.
- Honoré P.M., De Bels D., Barreto Gutierrez L., Spapen H.D. Hemoadsorption therapy in the critically ill: solid base but clinical haze. Ann. Intensive Care. 2019 Jan 31. 9(1). 22. doi: 10.1186/s13613-019-0491-1. PMID: 30706173; PMCID: PMC6355888.
- Santer D., Miazza J., Koechlin L., Gahl B., Rrahmani B., Hollinger A. et al. Hemoadsorption during Cardiopulmonary Bypass in Patients with Endocarditis Undergoing Valve Surgery: A Retrospective Single-Center Study. J. Clin. Med. 2021 Feb 3. 10(4). 564. doi: 10.3390/jcm10040564. PMID: 33546164; PMCID: PMC7913197.
- Martin-Loeches I., Nunnally M.E., Hellman J., Lat I., Martin G.S., Jog S. et al. Surviving Sepsis Campaign: Research Opportunities for Infection and Blood Purification Therapies. Crit. Care Explor. 2021 Sep 7. 3(9). e0511. doi: 10.1097/CCE.0000000000000511. PMID: 34514420; PMCID: PMC8425836.
- Rampino T., Gregorini M., Perotti L., Ferrari F., Patto-nieri E.F., Grignano M.A. et al. Hemoperfusion with CytoSorb as Adjuvant Therapy in Critically Ill Patients with SARS-CoV2 Pneumonia. Blood Purif. 2021. 50(4-5). 566-571. doi: 10.1159/000511725. Epub 2020 Nov 12. PMID: 33181508; PMCID: PMC7705939.
- Tetta C., Cavaillon J.M., Schulze M., Ronco C., Ghezzi P.M., Camussi G. et al. Removal of cytokines and activated complement components in an experimental model of continuous plasma filtration coupled with sorbent adsorption. Nephrol. Dial. Transplant. 1998 Jun. 13(6). 1458-64. doi: 10.1093/ndt/13.6.1458. PMID: 9641176.