Журнал "Гастроэнтерология" Том 58, №1, 2024
Вернуться к номеру
Гістологічні зміни слизової оболонки стравоходу при ахалазії
Авторы: Бабій О.М., Шевченко Б.Ф., Милостива Д.Ф., Гайдар Ю.А., Пролом Н.В., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
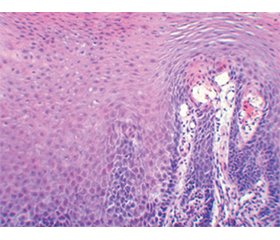
Актуальність. Морфологічні зміни слизової оболонки (СО) стравоходу залежать від типу ахалазії стравоходу (АС). При І і ІІ типах АС морфологічні зміни малопомітні, але при ІІІ і ІV типах чітко простежуються дистрофічні зміни. АС може переходити від одного типу до іншого. В основному це стосується патологічного переходу від запалення до фіброзу. Мета: дослідити гістологічні й морфометричні відмінності СО стравоходу залежно від типу АС. Матеріали та методи. Досліджено 51 біопсійний матеріал СО стравоходу у хворих на АС. Розподіл біоптатів для гістоморфометричної характеристики змін СО стравоходу при АС виконували за рентгенологічною класифікацією Японського товариства стравоходу (2017). Для вивчення загальної гістологічної структури СО стравоходу зрізи біоптатів товщиною 5–7 мкм виконували за допомогою ротаційного мікротома РМ60-ЕКА, забарвлення проводили за стандартною методикою гематоксилін-еозином, забарвлення на фіброз — за методикою Слінченка. Для морфометричного дослідження зрізи фотографували за допомогою світлового мікроскопа XSZ-21 (Україна) і виміряли за допомогою програмного забезпечення Image J.45S (USA). Результати. При гістологічному дослідженні розвиток структурних змін у СО стравоходу на тлі АС в 24,1 % випадків при ІІІ типі супроводжувався міграцією еозинофілів у власну пластинку, у 100 % — атрофією епітелію. Щільна лімфоплазмоцитарна інфільтрація відмічалася в усіх хворих з ІІІ і IV типами АС, а також у 93,3 % пацієнтів з ІІ типом, тоді як при І типі АС ця ознака діагностована у 20 % випадків (р = 0,005 і р = 0,0001 порівняно з ІІ і ІІІ типами АС). Балонна дистрофія виявлена при ІІ типі АС у 20 % пацієнтів, при ІІІ типі — у 57,1 % і при IV типі — в 100 % хворих. Явища фіброзу в СО стравоходу спостерігалися при ІV типі АС. В усіх хворих з IV типом АС і 86,2 % пацієнтів з ІІІ типом АС відзначалось потовщення базального шару плоского епітелію СО стравоходу, тоді як при І і ІІ типах воно спостерігалося лише у 20 і 13,3 % відповідно (р = 0,007 і р < 0,001 порівняно з ІІІ типом АС). Розширення міжклітинного простору виявлено в 100 % випадків при ІІ, ІІІ і ІV типах АС, а при І типі — лише в 40 % випадків (р = 0,009 і р = 0,0017 порівняно з ІІ і ІІІ типами АС). За даними морфометричного дослідження найбільший показник висоти плоского епітелію визначено при ІV типі АС — 343,40 мкм проти 325,45 мкм при І типі АС (р = 0,028). Висота базального шару була найменшою при ІІ типі АС (близько 40 мкм) і найбільшою при IV типі АС (близько 50 мкм), р = 0,074. Збільшення міжклітинного простору на 41,6 % відзначено при прогресуванні АС (р = 0,001). Висота сосочків найменша при ІІ типі АС — 125,05 мкм і найбільша при IV типі АС — 134,70 мкм (р = 0,006). Висновки. Усі типи АС супроводжуються езофагітом, при гістологічному дослідженні якого встановлено збільшення висоти базального шару, висоти сосочків, розширення міжклітинного простору, балонну дистрофію, фіброзні зміни власної пластинки, лімфоплазмоцитарну й еозинофільну інфільтрацію СО стравоходу, які прогресують залежно від типу АС. Морфометричні дослідження СО стравоходу щодо збільшення висоти епітелію (р = 0,028), висоти сосочків (р = 0,006), висоти базального шару (р = 0,074), розширення міжклітинного простору (р = 0,001) дозволяють встановити тип АС.
Background. Morphological changes in the esophageal mucosa (EM) depend on the type of esophageal achalasia (ЕA). In types I and II of ЕA, morphological changes are subtle, but in types III and IV, dystrophic changes are clearly visible. ЕA can transform from one type to another. This mainly concerns the pathological transition from inflammation to fibrosis. The purpose is to investigate the histological and morphometric differences of the EM depending on the type of ЕA. Materials and methods. We studied 51 biopsy specimens of the EM in patients with ЕA. The distribution of biopsies for histo-morphometric characterisation of changes in the EM in ЕA was used according to the radiological classification of the Japanese Society of the Esophagus (2017). To study the general histological structure of the EM, biopsy sections of 5–7 μm thickness were cut using a rotary microtome RM60-ECA, stained with hematoxylin-eosin according to the standard method, and staining for fibrosis was performed according to the Mallory-Slinchenko method. For morphometric study, the sections were photographed using a light microscope XSZ-21 (Ukraine) and measured with the Image J.45S software (USA). Results. In histological examination, the development of structural changes in the EM on the background of ЕA in 24.1 % of cases of type III was accompanied by migration of eosinophils into the lamina propria, and in 100 % — by epithelial atrophy. Dense lymphoplasmacytic infiltration was noted in all patients with types III and IV of ЕA, as well as in 93.3 % of patients with type II, whereas in type I of ЕA, this sign was diagnosed in 20 % of cases (p = 0.005 and p = 0.0001 compared with types II and III of ЕA). Ballooning degeneration was detected in 20 % of patients with EA type II, in 57.1 % with type III and in 100 % of patients with type IV. Fibrosis in the EM was observed only in ЕA type IV. Thickening of the basal layer of the squamous epithelium of the EM was noted in all patients with type IV ЕA and 86.2 % with type III ЕA, while in types I and II, it was observed in only 20 and 13.3 % of cases, respectively (p = 0.007 and p < 0.001 compared with type III ЕA). Expansion of the intercellular space was detected in 100 % of patients with types II, III and IV, and in only 40 % with type I (p = 0.009 and p = 0.0017 compared with types II and III ЕA). According to the morphometric study, the squamous epithelial height was largest in type IV ЕA — 343.40 μm versus 325.45 μm in type I ЕA (p = 0.028). The height of the basal layer was the lowest in type II ЕA (about 40 µm) and the largest in type IV ЕA (about 50 µm) (p = 0.074). An increase in the intercellular space by 41.6 % was noted with the progression of ЕA (p = 0.001). The height of the papillae is the lowest in type II ЕA — 125.05 μm and the largest in type IV ЕA — 134.70 μm (p = 0.006). Conclusions. All types of AE are accompanied by esophagitis, histological examination of which revealed an increase in the height of the basal layer, papillae height, expansion of the intercellular space, balloon degeneration, fibrous changes in the lamina propria, lymphoplasmacytic and eosinophilic infiltration of the EM that progress depending on the type of ЕA. Morphometric studies of the EM in terms of increasing the height of the epithelium (p = 0.028), the height of the papillae (p = 0.006), the height of the basal layer (p = 0.074), and the expansion of the intercellular space (p = 0.001) allow to detect the type of ЕA.
ахалазія стравоходу; слизова оболонка стравоходу; гістологічний і морфометричний аналіз
esophageal achalasia; esophageal mucosa; histological and morphometric analysis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Patel C.K., Kahrilas P.J., Hodge N.B. et al. RNA-sequencing reveals molecular and regional differences in the esophageal mucosa of achalasia patients. Scientific Reports. 2022. 12(1). 20616. doi: 10.1038/s41598-022-25103-7.
- Zhang B., Wang Y., Liao Y. et al. Advances in The Diagnosis and Treatment of Achalasia of The Cardia: a Review. Journal of Translational Internal Medicine. 2021. 9(1). 24-31. doi: 10.2478/jtim-2021-0009.
- Li M.Y., Wang Q.H., Chen R.P., Su X.F., Wang D.Y. Pathogenesis, clinical manifestations, diagnosis, and treatment progress of achalasia of cardia. World Journal of Clinical Cases. 2023. 11(8). 1741-1752. doi: 10.12998/wjcc.v11.i8.1741.
- Montoro-Huguet M.A. Dietary and Nutritional Support in Gastrointestinal Diseases of the Upper Gastrointestinal Tract (I): Esophagus. Nutrients. 2022. 14(22). 4819. doi: 10.3390/nu14224819.
- Nabi Z., Ramchandani M., Chavan R., Basha J., Reddy M., Darisetty S., Reddy N.D. Double tunnel technique reduces technical failure during POEM in cases with severe submucosal fibrosis. Endo–scopy International Open. 2021. 9(9). E1335-E1341. doi: 10.1055/a-1499-6817.
- Sato H., Takahashi K., Nakajima N. et al. Full-layer mucosal histology in achalasia: Histological epithelial wave is characteristic in “pinstripe pattern”-positive achalasia. Journal of Neurogastroentero–logy and Motility. 2018. 30(1). doi: 10.1111/nmo.13168.
- Feng X., Linghu E., Chai N., Ding H. New endoscopic classification of esophageal mucosa in achalasia: A predictor for submucosal fibrosis. Saudi Journal of Gastroenterology. 2018. 24(2). 122-128. doi: 10.4103/sjg.SJG_459_17.
- Arcerito M., Jamal M.M., Perez M.G., Kaur H., Sundahl A., Moon J.T. Esophageal Achalasia: From Laparoscopic to Robotic Heller Myotomy and Dor Fundoplication. Journal of the Society of Laparoscopic & Robotic Surgeons. 2022. 26(3). e2022.00027. doi: 10.4293/JSLS.2022.00027.
- Cappell M.S., Stavropoulos S.N., Friedel D. Updated Systema–tic Review of Achalasia, with a Focus on POEM Therapy. Digestive Diseases and Sciences. 2020. 65(1). 38-65. doi: 10.1007/s10620-019-05784-3.
- Pomenti S., Blackett J.W., Jodorkovsky D. Achalasia: Diag–nosis, Management and Surveillance. Gastroenterology Clinics of North America. 2021. 50(4). 721-736. doi: 10.1016/j.gtc.2021.07.001.
- Montgomery E.A., Canto M.I., Srivastava A. Evaluation and reporting of biopsies from the columnar-lined esophagus and gastro-esophageal junction (GEJ). Ann Diagn Pathol. 2019. 39. 111-7. DOI: 10.1016/j.anndiagpath.2019.02.012.
- Tsunokake J., Taniyama Y., Fujishima F. et al. Thoracoscopic esophagectomy for esophageal carcinoma after peroral endoscopic myo–tomy for esophageal achalasia: a case report. Surgical Case Reports. 2021. 7(1). 186. doi: 10.1186/s40792-021-01270-z.
- Gillies C.L., Farrukh A., Abrams K.R., Mayberry J.F. Risk of esophageal cancer in achalasia cardia: A meta-analysis. JGH Open. 2019. 3(3). 196-200. doi: 10.1002/jgh3.12132.
- Döhla M., Leichauer K., Gockel I. et al. Characterization of esophagealin flammationin patients with achalasia. A retrospective immunohistochemical study. Human Pathology. 2019. 85. 228-234. doi: 10.1016/j.humpath.2018.11.006.
- Lee B.E., Kim G.H., Shin N., Park D.Y., Song G.A. Histopathological Analysis of Esophageal Mucosa in Patients with Achalasia. Gut and Liver. 2021. 15. 713-722. doi.org/10.5009/gnl20195
- Kim A.J.S., Ong S., Kim J.H., Lee H.S., Yoon J.S., Hur D.Y. Morphologic Changes in Esophageal Body Movement During Bolus Transport After Peroral Endoscopic Myotomy in Type III Achalasia. J Neurogastroenterol Motil. 2022. 28(1). 131-144. doi: 10.5056/jnm21020.
- Frieling T., Heise J., Kreysel C., Blank M., Hemmerlein B., Beccu L., Kuhlbusch-Zicklam R. Eosinophilic esophagitis and achalasia — just a coincidence? Zeitschrift Fur Gastroenterologie. 2019. 57(2). 151-155. English. doi: 10.1055/a-0808-5043.
- Ghisa M., Laserra G., Marabotto E. et al. Achalasia and obstructive motor disorders are not un common in patients with eosino–philic esophagitis. Clinical Gastroenterology and Hepatology. 2021. 19(8). 1554-1563. doi: 10.1016/j.cgh.2020.07.056.
- Schizas D., Syllaios A., Vailas M. et al. Eosinophilic Esopha–gitisand Achalasia: Two Distinct Nosologic Entitiesora Possible Etiopathogenic Association? Digestive Diseases and Sciences. 2021. 39(6). 553-560. doi: 10.1159/000515520.
- Nelson M., Zhang X., Genta R.M. et al. Lower esophageal sphincter muscle of patients with achalasia exhibits profound mast cell degranulation. Journal of Neurogastroenterology and Motility. 2021. 33(5). e14055. doi: 10.1111/nmo.14055.
- Matsubara H., Ando N., Omura N., Kashiwagi H. Descriptive Rules for Achalasia of the Esophagus, June 2012: 4th Edition. Japan Esophageal Society. Esophagus. 2017. 14. 275-289. DOI: 10.1007/s10388-017-0589-1.
- Fuller A.D., Karami A.L., Kabir M.F. et al. Eosinophilic esophagitis-associated epithelial remodeling may limit esophageal carcinogenesis. Front Allergy. 2023. 4. 1086032. doi: 10.3389/falgy.2023.1086032.
- Ustaoglu A., Woodland P. Sensory phenotype of the oesopha–geal mucosa in gastro-oesophageal reflux disease. International Journal of Molecular Sciences. 2023. 24(3). 2502. doi: 10.3390/ijms24032502.
- Teng Y.Y., Zou M.L., Zhou X.J. et al. Novel prospects for scarless wound healing: The roles of myofibroblasts and adipocytes. Journal of Cellular and Molecular Medicine. 2022. 26(20). 5113-5121. doi: 10.1111/jcmm.17535
- Schuster R., Younesi F., Ezzo M., Hinz B. The Role of Myofibroblasts in Physiological and Pathological Tissue Repair. Cold Spring Harbor Perspectives in Biology. 2023. 15(1). a041231. doi: 10.1101/cshperspect.a041231.
- Mota R.C.L., deMoura E.G.H., de Moura D.T.H., Bernardo W.M., de Moura E.T.H., Brunaldi V.O., Sakai P., Thompson C.C. Risk factors for gastroesophageal reflux after POEM for achalasia: a systematic review and meta-analysis. Surgical Endoscopy. 2021. 35(1). 383-397. doi: 10.1007/s00464-020-07412-y.
- Visaggi P., Ghisa M., Marabotto E., Venturini A., Stefani Donati D., Bellini M., Savarino V., de Bortoli N., Savarino E. Esopha–geal dysmotility in patients with eosinophilic esophagitis: pathogenesis, assessment tools, monomeric characteristics, and cli–nical implications. Esophagus. 2023. 20(1). 29-38. doi: 10.1007/s10388-022-00964-z.
- Spechler S.J., Konda V., Souza R. Can Eosinophilic Esopha–gitis Cause Achalasia and Other Esophageal Motility Disorders? The American Journal of Gastroenterology. 2018. 113(11). 1594-1599. doi: 10.1038/s41395-018-0240-3.
- Zhao W., Wang B., Zhang L., Jin H. Eosinophils Infiltrationin Esophageal Muscularis Propria Induces Achalasia-like Esopha–geal Motility Disorderin Mice. Biomolecules. 2022. 12(12). 1865. doi: 10.3390/biom12121865.
- Chai C., Krishnan U. Dysmotility in Eosinophilic Esophagitis. Front Pediatr. 2022. 10. 853754. doi: 10.3389/fped.2022.853754.