Цереброваскулярна патологія — актуальна медико-соціальна проблема сучасного суспільства, яка має глобальний характер через значну поширеність, високу летальність та інвалідизацію хворих [1]. Лідируюче місце в структурі цереброваскулярних захворювань посідає інсульт, поширеність якого у світі становить від 150 до 200 на 100 тис. населення щорічно. Інсульт міцно утримує другу позицію серед причин смертності та першу — серед причин інвалідності пацієнтів [4].
Одними з інвалідизуючих наслідків інсульту є хронічні порушення свідомості (ХПС) та когнітивні розлади. Поширеність ХПС, згідно з епідеміологічними дослідженнями, становить від 0,2 до 3,4 випадку на 100 тис. осіб для вегетативного стану (ВС) і близько 1,5 випадку на 100 тис. осіб для стану мінімальної свідомості (СМС) [2, 3]. Когнітивна дисфункція виявляється у 40–70 % пацієнтів, які перенесли інсульт, у 17,7 % із них вона досягає рівня деменції [5–7]. ХПС та порушення когнітивних функцій негативно впливають на результат захворювання та ускладнюють проведення реабілітаційних заходів [8].
Сучасною стратегією, яка дозволяє відновити свідомість та когнітивні функції після інсульту, є призначення нейростимуляторів, серед яких найбільшу ефективність та безпеку має амантадину сульфат.
Порушення свідомості після інсульту
Свідомість — адекватне сприйняття навколишнього світу і власного «я» (повне орієнтування в просторі, часі, власній особистості), здатність до продуктивної взаємодії з навколишнім світом і пізнавальної діяльності. Свідомість включає дві необхідні складові: рівень неспання і змістовну, пізнавальну (когнітивну) діяльність.
Для підтримки неспання необхідна збережена функція великих півкуль головного мозку і висхідної ретикулярної активуючої системи (ВРАС), яка являє собою велику мережу ядер і сполучних шляхів, що охоплюють верхні відділи моста, середнього мозку і задні відділи проміжного мозку. Через дисфункцію ВРАС або обох півкуль головного мозку відбувається пригнічення свідомості. Це може бути спричинено вогнищевими ураженнями у верхній частині стовбура мозку внаслідок безпосереднього ураження ВРАС або двобічного ушкодження півкуль головного мозку. При великому однобічному вогнищі з локалізацією в одній півкулі (інфаркт у басейні лівої середньої мозкової артерії) порушення свідомості виникає в тому випадку, коли в протилежній півкулі є раніше сформовані вогнища або стиснення набряком головного мозку [14].
Тяжким порушенням свідомості є кома, що визначається як патологічний стан «незбудливої відсутності реакції», для якої характерна повна втрата здатності пізнавати довкілля і себе за допомогою усвідомленості. Механізм розвитку коми полягає в погіршенні постачання кисню, що, у свою чергу, змінює церебральний метаболізм і перешкоджає збудливості нейронів та/або синаптичній функції [10].
Після коми, як правило, розвиваються хронічні порушення свідомості — вегетативний стан та стан мінімальної свідомості [9]. Вегетативний стан, або синдром неспання без реакції (unresponsive wakefulness syndrome), — це клінічний стан, який характеризується відсутністю у пацієнта ознак цілеспрямованої поведінки, які свідчили б про усвідомлення пацієнтом власної особистості або навколишньої дійсності [9, 11]. У роботі J.T. Giacino et al. та метааналізі X. Li et al. [14] рекомендовано діагностувати ВС за наявності наступних критеріїв:
— відсутність ознак усвідомлення пацієнтом власної особистості або навколишньої дійсності, а також відсутність здатності пацієнта взаємодіяти з оточуючими;
— відсутність стійких, відтворюваних, цілеспрямованих або довільних поведінкових реакцій на зорові, слухові, тактильні або больові стимули;
— відсутність ознак того, що пацієнт розуміє мову і сам може говорити;
— зміна циклів «сон — неспання» не обов’язково відповідає часу доби;
— функції автономної (вегетативної) нервової системи, які контролюються гіпоталамусом і стовбуром мозку, збережені на рівні, достатньому для підтримки життя пацієнта в умовах надання йому медичної допомоги;
— відсутність контролю функції тазових органів;
— частково або повністю збережені рефлекси, які забезпечуються черепними нервами (реакція зіниці на світло, корнеальний, окулоцефалічний, окуловестибулярний, глотковий рефлекси), та спінальні рефлекси.
Стан мінімальної свідомості супроводжується тяжким порушенням свідомості, при якому мають місце виражені, хоча і мінімальні, часто нестійкі ознаки цілеспрямованої поведінки, що свідчать про усвідомлення пацієнтом власної особистості або навколишньої дійсності [9, 11, 12]. СМС діагностується при виявленні однієї або декількох наступних ознак [12, 14]:
— виконання простих інструкцій;
— відповіді типу «так/ні» за допомогою жестів або слів (незалежно від правильності відповіді);
— наявність розбірливої вербалізації;
— цілеспрямована поведінка, включаючи рухи або емоційні реакції, які відзначаються у відповідь на стимули і не можуть бути обумовлені тільки несвідомими, рефлекторними реакціями;
— звуки або жести, які відзначаються безпосередньо у відповідь на поставлені запитання або команди;
— спроби дотягнутися до предметів, відповідно до напрямку і відстані до нього;
— фіксація погляду, що виникає безпосередньо у відповідь на рух об’єкта або значущий для пацієнта стимул.
Таким чином, ключовою відмінністю СМС від ВС є елементи усвідомленої поведінки. Його ознаки можуть бути слабо вираженими, іноді ледь помітними, і виявлятися не постійно, а періодично, проте вони повинні бути відтворюваними і досить вираженими, щоб відрізнити їх від рефлекторних, несвідомих дій. Для підвищення точності діагностики рекомендовано застосовувати стандартизовані нейроповедінкові шкали, тому що при довільному огляді ймовірність помилкової діагностики становить від 15 до 43 % [15, 16].
Додаткові методи дослідження відіграють допоміжну роль у діагностиці ХПС. На сьогодні немає переконливих даних, що дозволяють рекомендувати використання того чи іншого методу дослідження для встановлення рівня свідомості в повсякденній практиці [17, 18]. Однак деякі нейрофізіологічні методи дослідження можуть надавати певну користь у діагностиці ХПС. До них належать: виявлення рухової реакції на інструкції за допомогою електроміографії [47], що може бути корисним для диференціації СМС і ВС; ЕЕГ-моніторинг, зокрема під час сну (наявність ознак REM-сну і повільнохвильового сну може свідчити на користь наявності ознак мінімальної свідомості) [19–21]; реєстрація викликаних потенціалів (компоненти aδ-LEP N2P2 і C-LEP) у відповідь на стимуляцію лазером [22] та розрахунок індексу складності пертурбацій (PCI > 0,31) за даними ТМС-ЕЕГ також сприяють диференціації СМС і ВС [49].
Зміни уваги і пильності (вігільності) у постінсультних пацієнтів
Більше ніж третина пацієнтів, які перенесли інсульт, відчувають зниження когнітивних функцій, включно з дефіцитом уваги, що негативно позначається на результаті захворювання і призводить до порушення повсякденної активності [25].
Увага — це спрямованість свідомості на певний об’єкт, процес відбору найбільш важливої інформації із зовнішнього і внутрішнього середовища.
Необхідною основою для перебігу процесів уваги є настороженість, пильність (вігільність), а також вибірковість уваги. Настороженість являє собою стан загального неспання, який зумовлює швидку й адекватну реакцію людини на будь-який раптовий запит на дію. Настороженість може підвищувати ефективність уваги на короткий період завдяки висхідним (тобто зовнішнім стимулам) або низхідним процесам (внутрішнім чинникам). Стійка увага, або пильність (вігільність), — це психологічна здатність людини зосередити увагу на нових враженнях, тобто «зберігати зосереджену увагу на подразниках упродовж тривалих періодів часу» [10].
Вибірковість обробки інформації, яку забезпечує увага, проявляється як в сприйнятті інформації ззовні, так і в мисленні і рухових процесах. У людини може виникати велика кількість асоціацій, проте вона фокусується лише на небагатьох, необхідних для її мети, і ігнорує інші, що заважають її мисленню. Потенційно вона може зробити велике число всіляких рухів, але робить лише деякі доцільні з них. Таким чином, увага забезпечує здійснення виборчих програм дій і постійний контроль над їх перебігом. Відповідно, оцінюючи увагу, говорять про неї не тільки як про процес (вибірковість), але і як про стан (зосередженість, поглибленість) [24].
Результати численних досліджень свідчать, що функції уваги можуть бути вибірково порушені залежно від ділянки ураження тканин головного мозку [25, 27]. У роботі J.W. Sturm et al. [29] з використанням методів нейровізуалізації встановлено, що до процесів стійкої уваги залучені мережі нейронів ділянок кори та підкірки в межах правої півкулі мозку. S. Spaccavento et al. [27] повідомляють, що за складніші функції уваги — вибіркову, виконавчу та часову зосередженість відповідає ліва півкуля головного мозку.
У пацієнтів з кортикальним інсультом дефіцит уваги обумовлений безпосереднім ураженням кори головноРисунок 1. Статус респондера/нереспондера залежно від уведеного нейростимулятора го мозку, переважно лобової і потиличної ділянки [25, 26]. У дослідженні P. Malik et al. виявлено, що при підкірковому інсульті порушується пильність. Учасники з найнижчими результатами психомоторного тестування на вігільність мали ураження променевого вінця, внутрішньої капсули, блідої кулі та таламуса. Автори дослідження дійшли висновку, що пильність залежить від цілісності підкіркових структур та їхніх зв’язків із кірковими ділянками мозку [26].
За результатами дослідження Murakamiet et al. [28], локалізація ураження в зоні від таламуса до базальних гангліїв на домінантному боці була пов’язана з продуктивністю виконання тесту на увагу, що свідчить про велику мультимодальну нейронну мережу, яка відповідає за увагу, із залученням таламуса і базальних гангліїв.
Крім того, за даними інших досліджень, важливу роль у когнітивних процесах відіграє задня поясна ділянка кори. Ця зона головного мозку відіграє центральну роль у підтримці внутрішнього пізнання, а також у регулюванні фокусу уваги. Крім того, активність цієї ділянки змінюється залежно від стану збудження, отже, взаємодія задньої поясної частини кори з іншими зонами мозку може бути важливою для формування свідомості.
Амантадину сульфат відновлює свідомість та поліпшує когнітивні функції після інсульту
Амантадин був синтезований в 1966 році як противірусний засіб для лікування грипу А2. Надалі його ефективність була продемонстрована при хворобі Паркінсона, злоякісному нейролептичному синдромі, викликаному лікарськими засобами, екстрапірамідному руховому синдромі, розладах свідомості та когнітивних порушеннях.
Амантадину сульфат активно стимулює виділення дофаміну з нейрональних депо, зменшує зворотне захоплення дофаміну, збільшує щільність та змінює конфігурацію постсинаптичних дофамінергічних рецепторів, що забезпечує відновлення свідомості та поліпшення когнітивних функцій [30, 31]. Амантадин блокує NMDA-глутаматні рецептори, завдяки чому перериває наростання викиду глутамату та пригнічує глутаматну ексайтотоксичність, тим самим захищає мозок від вторинного ішемічного пошкодження при інсульті [28, 29]. Він є інгібітором кальмодулінзалежной фосфодіестерази-1, за рахунок чого здійснює нейропротективну дію, та блокатором нікотинових рецепторів, що забезпечує протисудомний ефект [35].
Амантадин підвищує рівень глутатіону — потужного антиоксиданту, який захищає нейрони від шкідливого впливу токсичних агентів і вільних радикалів [30]. Він здатний зменшувати активацію мікроглії, індукує експресію гліального нейротрофічного фактора в мікроглії та астроглії, що сприяє виживанню і диференціюванню нейронів [34], інгібує запальну активацію мікроглії шляхом зменшення вироблення запальних цитокінів (інтерферон γ і фактор некрозу пухлини α), тим самим захищає нейрони від пошкодження [32, 33].
У низці досліджень показано, що лікування амантадином сприяє пробудженню та більш активній участі пацієнтів у ранній реабілітації. У дослідженні А.М. Leclerc et al. [31], яке тривало 3,7 року, порівнювали ефективність амантадину та/або модафінілу. У дослідження було включено 87 пацієнтів, з яких 41 (47 %) мав внутрішньомозковий крововилив (ВМК), 29 (33 %) — ішемічний інсульт (ІІ) та 17 (20 %) — субарахноїдальний крововилив (САК). Усі нейростимулятори призначалися в середньому через 7 днів після інсульту (діапазон 1–27 днів) для лікування сонливості (77 % осіб), невиконання команд (32 %), без розплющування очей (28 %) або за низької оцінки за шкалою коми Глазго (17 %). Найпоширеніша початкова доза становила 100 мг двічі на день як для амантадину (86 %), так і для модафінілу (54 %).
Серед 79 пацієнтів, включених в аналіз клінічної ефективності, 42 пацієнти відповіли на лікування, з них 34/62 отримували монотерапію амантадином і 8/24 отримували амантадин і модафініл. Жоден пацієнт, який отримував монотерапію модафінілом, не реагував на лікування (рис. 1).
Середній час від початку прийому нейростимуляторів до відповіді на лікування становив 3 дні. Респондери частіше виписувалися додому або для проходження реабілітації порівняно з нереспондерами (90 проти 62 %; рис. 2). Із 72 (83 %) пацієнтів, які підлягали виписці з лікарні, 63 було рекомендовано продовжити лікування нейростимуляторами.
Таким чином, у цьому дослідженні було встановлено, що застосування амантадину в перший тиждень після інсульту поліпшує свідомість у 55 % пацієнтів. Респондерів, які відповіли на терапію, частіше виписували додому або скеровували для проходження курсу реабілітації.
L. Rühl et al. [40] оцінювали вплив амантадину на свідомість у пацієнтів з нетравматичним ушкодженням головного мозку. У дослідженні взяли участь 294 пацієнти з ВМК, ІІ та САК, серед яких 84 отримували амантадин.
Результати дослідження продемонстрували переваги амантадину (рис. 3): вже на 5-й день лікування поліпшення свідомості спостерігалося у 86,9 % пацієнтів із групи амантадину, що значно перевершувало групу контролю (54 %). На 10-й день терапії ці показники становили 91,7 та 67 % відповідно. Повний вихід із несвідомого стану на 5-й та 10-й день лікування відмічався у 78,6 та 82,1 % хворих із групи амантадину, із групи контролю — у 49 та 59 % відповідно.
У двох дослідженнях, проведених Gao et al., було доведено, що призначення амантадину сульфату може бути корисним для лікуванні наслідків цереброваскулярних подій. У ретроспективному когортному дослідженні було продемонстровано, що амантадин прискорює відновлення свідомості у пацієнтів з персистуючим вегетативним станом після тяжкого крововиливу у мозок порівняно з контрольною групою (50 та 33,3 % відповідно) [36]. У другому дослідженні призначення амантадину у дозі 200 мг/добу викликало повне відновлення свідомості у 71,3 % пацієнтів, у 28,7 % відбувався перехід із ВС у СМС [37].
/2_1.jpg)
У дослідженні E.F. Akcil et al. [39] пацієнтів після субарахноїдального крововиливу рандомізували на дві групи. Учасники однієї групи отримували тільки стандартне лікування (хірургічні втручання та терапію антиконвульсантами), другої групи — на додаток до стандартного лікування приймали амантадин (по 200 мг на добу впродовж 30 днів). За даними спостереження протягом шести місяців, додавання амантадину до схеми стандартного лікування сприяло ефективнішому відновленню нейрокогнітивних функцій.
Ефективність і безпека призначення амантадину при порушенні пильності (вігільності) у пацієнтів з ішемією мозку була показана в дослідженні W. Gehlen [38]. У ньому взяли участь 52 пацієнти, які протягом 9 днів отримували інфузії амантадину в дозі 200 мг 1 раз на день. У 92 % пацієнтів лікування було визнано ефективним, а переносимість була оцінена як дуже хороша або хороша в 96 % випадків.
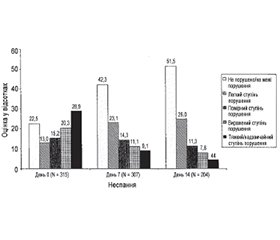
У багатоцентровому дослідженні J. Jorg et al. [35] вивчалася функціональна незалежність та пильність (вігільність) при призначенні 200 мг амантадину сульфату протягом 14 днів. У дослідженні взяли участь 316 пацієнтів, із яких 152 (48,1 %) мали інсульт, 49 (15,6 %) — мультиінфарктний синдром, 39 (12,3 %) — травматичне пошкодження мозку, 22 (7 %) — субарахноїдальний крововилив, 121 (38,3 %) — інші діагнози.
Функціональна незалежність оцінювалася за допомогою шкали FIM (міра функціональної незалежності). Поліпшування цього показника починалося вже на 3-й день лікування і тривало надалі — з 44,3 (день 0) до 62,7 (день 14) (рис. 4).
Пильність (вігільність) та активність пацієнтів оцінювалися за шкалою WVAR (Wuppeftal Vigilance and Drive Disorder Rating). Після лікування амантадину сульфатом ступінь порушення вігільності зменшувався за всіма оцінюваними параметрами — просторового сприйняття, неспання, уваги, орієнтації, пам’яті, мови, спілкування, настрою, активності, відповідної поведінки, емоційності, готовності до співпраці та соціальної взаємодії (рис. 5).
Для оцінки ступеня захворювання використовувалася шкала «Клінічне глобальне враження» (CGI). Після лікування амантадином було встановлено зниження тяжкості захворювання та поліпшення стану. Якщо до лікування 55,8 % пацієнтів мали тяжкий або вкрай тяжкий стан, то після призначення амантадину сульфату на 7-й і 14-й день терапії ці показники знизилися до 38,5 і 35,3 % відповідно. При цьому на 7-й і 14-й день збільшилася кількість хворих, що мали помірний ступінь тяжкості захворювання — з 5,2 до 16,2 та 25 % відповідно.
До кінця дослідження ефективність терапії амантадину сульфатом продемонстрована у 87,4 % пацієнтів, дуже добра переносимість — у 92,6 %, що свідчить про сприятливе співвідношення ризик/користь. На думку авторів дослідження, підвищення вігільності та активності за допомогою амантадину сульфату і пов’язане з цим поліпшення функціональної незалежності пацієнтів призводять до скорочення термінів госпіталізації і більш раннього початку реабілітації.
На сьогодні планується дослідження ANNES [41], у якому буде проводитися оцінка ефективності амантадину у пацієнтів з персистуючою комою. У цьому дослідженні візьмуть участь 43 пацієнти із відділення інтенсивної терапії з балами за шкалою коми Глазго < 8. Амантадин буде вводитися внутрішньовенно в дозі 100 мг протягом 5 днів. Первинною кінцевою точкою буде поліпшення щонайменше на 3 бали за шкалою GCS. Якщо протягом перших 48 годин учасники не будуть реагувати на терапію (збільшення менше ніж на 3 бали або зменшення за шкалою GCS), доза амантадину буде подвоюватися з третього по п’ятий день. Вторинні цілі дослідження: за допомогою ЕЕГ належить продемонструвати, що амантадин поліпшує пильність.
Очікується, що в умовах помірного ризику лікування значна кількість пацієнтів отримає користь від застосування амантадину завдяки підвищенню пильності (підвищення GCS не менше ніж на 3 бали), що врештірешт призведе до поліпшення реабілітаційного потенціалу та функціонального неврологічного результату.
Рекомендації щодо призначення амантадину при інсульті та ЧМТ
За рекомендаціями Американської академії неврології, пацієнтам з порушенням свідомості — ВС або СМС протягом 4–16 тижнів після травми слід призначати амантадин по 100–200 мг два рази на день для прискорення функціонального відновлення і зниження ступеня інвалідності на ранніх стадіях ЧМТ (рівень В). Ці дані також можуть бути екстрапольовані на порушення свідомості нетравматичного генезу, зокрема після інсульту [45].
Міністерство охорони здоров’я Канади рекомендує амантадин як засіб для прискорення пробудження і підвищення свідомості, прискорення темпів функціонального відновлення в осіб у вегетативному стані або стані мінімальної свідомості після травматичного/нетравматичного ушкодження головного мозку [39]. У бразильських рекомендаціях пацієнтам з персистуючим ВС або СМС також рекомендується призначення амантадину в перші 4–16 тижнів після ЧМТ для прискорення функціонального відновлення [42].
Рекомендації щодо лікування хронічних порушень свідомості (Китай, 2021) свідчать, що амантадин має
церебральну нейрогенну протизапальну, антиексайтотоксичну дію та активує селективний неврологічний дофамінергічний шлях [42]. Великі дослідження показали позитивні поведінкові ефекти амантадину у пацієнтів з тривалими порушеннями свідомості у дозі 200 мг двічі на день [42].
Згідно з настановами Французького товариства фізичної та реабілітаційної медицини (SOFMER, 2016) рекомендовано застосовувати в комплексному лікуванні пацієнтів із травматичним ураженням головного мозку амантадин для зменшення ознак апатії та мотиваційних розладів, поліпшення процесу прийняття рішень [10].
Для підвищення пильності у пацієнтів після коми різної етіології амантадину сульфат призначається протягом 3–5 днів внутрішньовенно в добовій дозі 200 мг. Залежно від клінічного перебігу лікування може бути продовжено пероральними лікарськими формами протягом 4 тижнів у дозі 200 мг на добу. У пацієнтів з хворобами нирок та зниженням швидкості клубочкової фільтрації доза амантадину може бути знижена, а інтервал прийому препарату змінений.
Амантадину сульфат, як правило, безпечний, добре переноситься пацієнтами. Поширеними побічними ефектами є запаморочення, сухість у роті, нудота, запор, інсомнія.
Протипоказаннями до призначення амантадину є підвищена чутливість до компонентів препарату, тяжка некомпенсована серцева недостатність, кардіоміопатія, міокардит, аритмія, тяжка ниркова недостатність.
Висновки
— Одними з інвалідизуючих наслідків інсульту є хронічні порушення свідомості та когнітивні розлади, які негативно впливають на результат захворювання та ускладнюють проведення реабілітаційних заходів.
— Сучасною стратегією відновлення свідомості, поліпшення уваги та пильності є використання амантадину сульфату, який активно стимулює виділення дофаміну з нейрональних депо, зменшує зворотне захоплення дофаміну, збільшує щільність та змінює конфігурацію постсинаптичних дофамінергічних рецепторів, що забезпечує відновлення свідомості і функціональної активності пацієнтів з інсультом.
— Завдяки блокаді NMDA-глутаматних рецепторів амантадину сульфат перериває наростання викиду глутамату та пригнічує глутаматну ексайтотоксичність, тим самим захищає мозок від вторинного ішемічного пошкодження при інсульті, що поліпшує прогноз захворювання і збільшує реабілітаційний потенціал.
— Численні клінічні дослідження демонструють ефективність та безпечність застосування амантадину сульфату у пацієнтів, які перенесли інсульт. Доведено, що його використання забезпечує корекцію порушень свідомості, уваги і вігільності, спряє ранній виписці зі стаціонару та ранньому початку реабілітаційних заходів.
— Американська асоціація неврологів (2018 р.) рекомендує пацієнтам з ЧМТ та ХПС призначення амантадину в дозі 100–200 мг на добу протягом 4–16 тижнів для прискорення функціонального відновлення і зниження ступеня інвалідності (рівень В). Ці дані також можуть бути екстрапольовані на порушення свідомості нетравматичного генезу, зокрема після інсульту.
Список литературы
1. Krishnamurthi R.V., Moran A.E., Feigin V.L., Barker-Collo S. et al. Stroke Prevalence, Mortality and Disability-Adjusted Life Years in Adults Aged 20-64 Years in 1990-2013: Data from the Global Bur-den of Disease 2013 Study. Neuroepidemiology. 2015;45(3):190-202. doi: 10.1159/000441098.
2. Feigin V.L., Forouzanfar M.H., Krishnamurthi R., Men-sah G.A., Connor M., Bennett D.A., et al. Global and Regional Bur-den of Stroke during 1990-2010: Findings from the Global Burden of Disease Study 2010. The Lancet. 2010;383:245-255. https://doi. org/10.1016/S0140-6736(13)61953-4.
3. Van Erp W., Lavrijsen J., van de Laar F., Vos P., Lau-reys S., Koopmans R. The vegetative state/unresponsive wakefulness syndrome: a systematic review of prevalence studies. Eur. J. Neurol. 2014;21(11):1361-8.
4. Зозуля І.С., Цимбалюк В.І., Зозуля А.І. Інсульт: стратегія і тактика надання медичної допомоги. Український медичний часопис. 2012. № 5 (91). ІХ-Х.
5. Henon H., Durieu I., Guerouaou D., et al. Poststroke dementia: incidence and relationship to prestroke cognitive decline. Neurology. 2001;57:1216-1222.
6. Pendlebury S.T., Rothwell P.M. Prevalence, incidence, and factors associated with prestrike and post-stroke dementia: a systematic review and meta-analysis. Lancet Neurol. 2009;8:1006-1018.
7. Lesniak M., Bak T., Czepiel W. et al. Frequency and prognostic value of cognitive disorders in stroke patients. Dement Geriatr Cognitive Disord. 2008;4(26):356-63.
8. Sibolt G., Curtze S., Melkas S., Putaala J., Pohjasvaara T., Kaste M., Karhunen P.J., Oksala N.K., Erkinjuntti T. Poststroke dementia is associated with recurrent ischaemic stroke. J. Neurol. Neurosurg. Psychiatry. 2013;84:722-6.
9. Giacino J.T., Katz D.I., Schiff N.D., et al. Practice guidelineupdate recommendations summary: Disorders of consciousness. Neuro-logy. 2018;91(10):450-60. DOI: 10.1212/WNL.0000000000005926.
10. Тріщинська М.А. Можливості лікування розладів уваги у пацієнтів після інсульту. Інсульт. 2024. № 1.
11. Multi-Society Task Force on PVS. Medical Aspects of the Persistent Vegetative State. New England Journal of Medicine. 1994;330(21):1499-508. DOI: 10.1056/NEJM199405263302107.
12. Giacino J.T., Ashwal S., Childs N., et al. The minimal-ly conscious state: definition and diagnostic criteria. Neurology. 2002;58(3):349-53. DOI: 10.1212/wnl.58.3.349.
13. Li X., Li C., Hu N., Wang T. Music interventions for disorders of consciousness: A systematic review and meta-analysis. J Neurosci Nurs. 2020;52(4):146-151. doi: 10.1097/JNN.0000000000000511.
14. Maiese К. Overview of Coma and Impaired Consciousness. https://www.msdmanuals.com/ru/professional.
15. Childs N.L., Mercer W.N., Childs H.W. Accuracy of diagnosis of persistent vegetative state. Neurology. 1993;43(8):1465-7. DOI: 10.1212/WNL.43.8.1465.
16. Schnakers C., Vanhaudenhuyse A., Giacino J., et al. Diag-nostic accuracy of the vegetative and minimally conscious state: clini-cal consensus versus standardized neurobehavioral assessment. BMC Neurol. 2009;9:35. DOI: 10.1186/1471-2377-9-35.
17. Kondziella D., Bender A., Diserens K., et al. European Academy of Neurology guideline on the diagnosis of coma and other disorders of consciousness. Eur J Neurol. 2020;27(5):741-56. DOI: 10.1111/ene.14151.
18. Royal College of Physicians. Prolonged disorders of conscious-ness following sudden onset brain injury: National clinical guidelines. London: RCP, 2020.
19. Forgacs P.B., Conte M.M., Fridman E.A., et al. Preserva-tion of electroencephalographic organization in patients with impaired consciousness and imaging-based evidence of command-following. Ann Neurol. 2014;76(6):869-79. DOI: 10.1002/ana.24283.
20. de Biase S., Gigli G.L., Lorenzut S., et al. The importance of polysomnography in the evaluation of prolonged disorders of con-sciousness: sleep recordings more adequately correlate than stimulus-related evoked potentials with patients’ clinical status. Sleep Med. 2014;15(4):393-400. DOI: 10.1016/j.sleep.2013.09.026.
21. Pavlov Y.G., Gais S., Müller F., et al. Night sleep in patients with vegetative state. J Sleep Res. 2017;26(5):629-40. DOI: 10.1111/jsr.12524.
22. Naro A., Russo M., Leo A., et al. Cortical Responsiveness to Nociceptive Stimuli in Patients with Chronic Disorders of Conscious-ness: Do C-Fiber Laser Evoked Potentials Have a Role? Ward LM, ed. PLoS One. 2015;10(12):e0144713. DOI: 10.1371/journal. pone.0144713.
23. Casarotto S., Comanducci A., Rosanova M., et al. Stratifica-tion of unresponsive patients by an independently validated index of brain complexity. Ann Neurol. 2016;80(5):718-29. DOI: 10.1002/ana.24779.
24. Психофізіологія (не)довільної уваги. https://scorcher.ru/neuro/neuro_sys/focused_attention/focused_attention2.php.
25. Schnakers C., Vanhaudenhuyse A., Giacino J., Ventura M., Boly M., Majerus S., Moonen G., Laureys S. Diagnostic accuracy of the vegetative and minimally conscious state: Clinical consen-sus versus standardized neurobehavioral assessment. BMC Neurol. 2009;9:35.
26. Malik P., Muir R., Black S., Gao F., Swartz R., Mur-ray B., Boulos M. Impaired Performance on the Psychomotor Vigi-lance Task After Minor Stroke. Neurorehabil Neural Repair. 2018 Nov;32(11):999-1007. doi: 10.1177/1545968318804415. Epub 2018 Oct 24.
27. Spaccavento S., Marinelli C.V., Nardulli R., Macchitella L., Bivona U., Piccardi L., Zoccolotti P., Angelelli P. Attention Deficits in Stroke Patients: The Role of Lesion Characteristics, Time from Stroke, and Concomitant Neuropsychological Deficits. Behavioural Neurology. 2019;1-11. https://doi.org/10.1155/2019/7835710/.
28. Murakami M., Vicente M.I., Costa G.M., Mainen Z.F. Neu-ral antecedents of self-initiated actions in secondary motor cortex. Nature Neuroscience. 2014;17:1574-1582.
29. Sturm J.W., Donnan G.A., Dewey H.M., Macdonell R.A., Gilligan A.K., Srikanth V., et al. Quality of life after stroke: the north East Melbourne stroke incidence study (NEMESIS). Stroke. 2004;35:2340-5. doi: 10.1161/01.STR.0000141977.18520.3b.
30. Meythaler J.M., Brunner R.C., Johnson A., Novack T.A. Amantadine to improve neurorecovery in traumatic brain injury-asso-ciated diffuse axonal injury: a pilot double-blind randomized trial. J Head Trauma Rehabil. 2002;17(4):300-313.
31. Leclerc А.М., Riker R.R., Brown C.S., May T., Nocella K., Cote J., Eldridge A., Seder D.J. Amantadine and Modafinil as Neuro-stimulants Following Acute Stroke: A Retrospective Study of Intensive Care Unit Patients. Neurocrit Care. 2021;34(1):102-111.
32. Kubera M. et al. Inhibitory effects of amantadine on the pro-duction of pro-infammatory cytokines by stimulated in vitro human blood. Pharmacol Rep. 2009;PR 61:1105-1112.
33. Kim J.H., et al. Microglia-inhibiting activity of Parkinson’s disease drug amantadine. Neurobiol Aging. 2012;33:2145-2159.
34. Ossola B., Schendzielorz N., Chen S.H., Bird G.S., Tuo-minen R.K., Mannisto P.T., Hong J.S. Amantadine protects dopamine neurons by a dual action: reducing activation of microglia and inducing expression of GDNF in astroglia. Neuropharmacology. 2011;61:574-582.
35. Danysz W., Dekundy A., Scheschonka A., Riederer P. Amantadine: reappraisal of the timeless diamond-target updates and novel therapeutic potentials. J Neural Transm (Vienna). 2021 Feb;128(2):127-169. doi: 10.1007/s00702-021-02306-2.
36. Gao Y., Zhang Y., Li Z., Ma L., Yang J. Persistent vegetative state after severe cerebral hemorrhage treated with amantadine: a retrospective controlled study. Medicine (Baltimore). 2020;99:e21822. https://doi.org/10.1097/MD.0000000000021822.
37. Gao Y., Ma L., Liang F., Zhang Y., Yang L., Liu X., Yang J. The use of amantadine in patients with unresponsive wakefulness syn-drome after severe cerebral hemorrhage. Brain Inj. 2020;34:1084-1088. https://doi.org/10.1080/02699052.2020.1780315/.
38. Gehlen W. Vigilance Enhancement in Transitory Syndromic. Neurologie Psychiatrie. 1993;5:301-303.
39. Akcil E.F., Dilmen O.K., Vehid H., Tunalı Y. Functions After Subarachnoid Haemorrhage? A Preliminary Study. Turk J Anaesthe-siol Reanim. 2018;46(2):100-107. doi: 10.5152/TJAR.2018.20280.
40. Rühl L., Kuramatsu J.B., Sembill J.A., Kallmünzer B., Madzar D., Gerner S.T., et al. Amantadine treatment is associated with improved consciousness in patients with non-traumatic brain injury. J Neurol Neurosurg Psychiatry. 2022;93(6):582-587. doi: 10.1136/jnnp-2021-327408.
41. Hofmann A., Blum C., Single C., Adeyemi K., Schwarz P., Siokas V., et al. Amantadine for NeuroenhaNcement in acutE patients Study — a protocol for a prospective pilot proof of concept phase IIb study in intensive and intermediate care unit patients (ANNES). BMC Neurology. 2023; Article number: 308.
42. Ontario Neurotrauma Foundation. Clinical Practice Guideline for the rehabilitation of adults with moderate to severe TBI 2017.
43. Anghinah R., Amorim R.L.O., Paiva W.S., Schmidt M.T, Ianof J.N. Traumatic brain injury pharmacological treatment: reco-mmendations. Arq Neuropsiquiatr. 2018;76:100-103.
44. Li Yusheng, He Jianghong, Yang Bing, Zhang Hui, Yang Zhonghua, Fu Jianhui, et al. Clinical diagnosis guidelines and neu-rorestorative treatment for chronic disorders of consciousness (2021 China version). Journal of Neurorestoratology. 2021;9:50-59.
45. Prolonged disorders of consciousness following sudden onset brain injury: National clinical guidelines. Royal College of Physicians. 2020.
UA-PKMZ-PUB-062024-030

/1_1.jpg)
/2_1.jpg)