Международный эндокринологический журнал Том 21, №1, 2025
Вернуться к номеру
Ішемічний інфаркт головного мозку з геморагічною трансформацією: особливості змін перифокальної тканини залежно від інтервалу хвороби та фонової і супутньої патології
Авторы: Поспішіль Ю.О., Фаліон Р.І., Малик О.Р., Бєкєтова Ю.І., Пшик Р.С., Дроник І.С.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
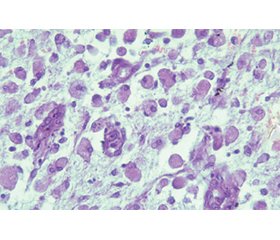
Актуальність. Геморагічне перетворення ділянки головного мозку з некрозом є поширеним ускладненням ішемічного інфаркту. У літературі є низка розбіжностей щодо клінічної класифікації та критеріїв візуалізації такого інфаркту, що, безперечно, утруднює діагностику. Важливим моментом у перебігу ішемічного інфаркту з геморагічною трансформацією (ІшІнф з ГТ) є супутні та фонові розлади, зокрема гіпертонічна хвороба і цукровий діабет, які впливають на цілісність нейросудинної одиниці й гематоенцефалічного бар’єра. Мета: вивчення особливостей патоморфологічних змін у перифокальній зоні тканини головного мозку в різні інтервали від початку ІшІнф з ГТ у пацієнтів з фоновою та супутньою патологією. Матеріали та методи. Вибрали 18 історій хвороби, опрацювали клінічні симптоми, супутні та фонові хвороби, а також трупний матеріал пацієнтів віком 35–82 роки з ІшІнф з ГТ. Матеріал досліджували згідно з класифікацією стадій інфаркту мозку (Mena H. et al.), виділяючи три інтервали: фаза 1 — гострі пошкодження нейронів (1–3-й день), фаза 2 — гостра організація (4–7-й день), фаза 3 — хронічна організація (> 7 днів). Для гістологічного дослідження вилучили шматочки тканини мозку (1,5 × 1,5 см) у прилеглій до інфаркту зоні. Препарати виготовляли за стандартною методикою, зрізи забарвлювали гематоксиліном і еозином. Статистичну обробку результатів виконували за допомогою пакета Statistica for Windows 6.0 (StatSoft, USA). Результати. Під час дослідження пацієнтів з ІшІнф з ГТ з’ясували наявність як ізольованого гострого пошкодження нейронів, так і поєднання обох його варіантів. Окрім гострих змін нейронів, у значній частині випадків виявляли нейрони з хронічними змінами, corpora amilacea та вогнища з випадінням нейронів (статистично значуща відмінність для ділянок із випадінням нейронів між першою і другою фазами та між першою і третьою фазами — р1–2 < 0,05 і р1–3 < 0,05), що свідчило про тяжкий ступінь порушення кровопостачання в тканині головного мозку. Ознаки початку реактивного астрогліозу і неоангіогенезу були вже в першій фазі ІшІнф з ГІ, і надалі відзначалося збільшення частоти таких ознак у другій і третій фазах хвороби (р1–2 < 0,05 і р1–3 < 0,05 для астрогліозу і р1–3 < 0,05 для ангіогенезу). З’ясували, що в оточуючій тканині вогнищ ішемії/реперфузії головного мозку розвивалось реактивне запалення з найбільшою кількістю нейтрофілів у першій фазі (р1–3 < 0,05) і присутністю лімфоцитів і макрофагів упродовж усіх фаз ІшІнф з ГТ. Гостре пошкодження судин мікроциркуляторного русла у вигляді трансмурального фібриноїдного некрозу стінки спостерігали в окремих випадках, у більшості зміни були у вигляді склерозу і гіалінозу. Висновки. На швидке летальне завершення ІшІнф з ГТ у пацієнта впливало поєднання гіпертонічної хвороби і цукрового діабету. Особливості мікроциркуляторного русла вказували на супутню патологію у вигляді некрозу, артеріосклерозу, артеріологіалінозу. У більшості випадків у перші три дні хвороби в перифокальній зоні спостерігались нейрони з некрозом і одночасно відбувалися процеси загоєння.
Background. Hemorrhagic transformation of brain tissue with necrosis is a common complication of ischemic stroke. There are numerous discrepancies in the literature regarding the clinical classification and imaging criteria of such strokes, which undoubtedly complicates the diagnosis. A crucial aspect in the progression of ischemic stroke with hemorrhagic transformation (IS with HT) is the presence of comorbidities and background diseases such as hypertension and diabetes mellitus that affect the integrity of the neurovascular unit and the blood-brain barrier. The purpose was to study the features of pathomorphological changes in the perifocal zone of brain tissue at different phases after the onset of IS with HT in patients with background and comorbid conditions. Materials and methods. The medical histories, clinical data, comorbidities and background diseases, and autopsy material of 18 patients aged 35–82 years with IS with HT were analyzed. The material was grouped according to the classification of stages of cerebral infarction (Mena H. et al.) into three phases: 1 — acute neuronal injury (1–3 days); 2 — acute organization (4–7 days); 3 — chronic organization (> 7 days). For histological examination, brain tissue samples (1.5 × 1.5 cm) adjacent to the infarction zone were taken. They were prepared using standard methods, and the sections were stained with hematoxylin and eosin. Statistical analysis of the results was performed using Statistica for Windows 6.0 software (StatSoft, USA). Results. The study of patients with IS with HT revealed the presence of both isolated and combined acute neuronal damage. In addition to acute neuronal changes, a significant number of cases showed neurons with chronic changes, corpora amylacea, and areas with neuron loss (a statistically significant difference for areas with neuron loss between phase 1 and phase 2 and between phase 1 and phase 3: p1–2 < 0.05 and p1–3 < 0.05), indicating severe disturbances of cerebral blood supply. Early reactive astrogliosis and neoangiogenesis were observed in phase 1 of IS with HT, with an increase in the frequency of these signs in phases 2 and 3 of the disease (p1–2 < 0.05 and p1–3 < 0.05 for astrogliosis and p1–3 < 0.05 for angiogenesis). It was found that as a result of ischemia/reperfusion in the perifocal brain tissue, reactive inflammation developed, with a predominance of neutrophils over other elements in phase 1 (p1–3 < 0.05) and the presence of lymphocytes and macrophages throughout all phases of IS with HT. Acute damage to microcirculatory vessels in the form of transmural fibrinoid necrosis of the vessel wall was observed in some cases, while in most cases, changes were in the form of sclerosis and hyalinosis. Conclusions. The rapid fatal outcome of IS with HT in patients was influenced by the combination of hypertension and diabetes mellitus. The features of the microcirculatory system indicated comorbid conditions in the form of necrosis, arteriosclerosis, arteriolar hyalinosis. In most cases, during the acute phase of the disease, coagulative and liquefactive necrosis of neurons was observed in the perifocal zone, and despite the severity of the disease, healing processes were present.
ішемічний інфаркт головного мозку; геморагічна трансформація; цукровий діабет; чинники ризику; «червоні» нейрони; «тіні» нейронів
ischemic stroke; hemorrhagic transformation; diabetes mellitus; risk factor; red neurons; neuron “shadows”
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Andrade JB de C, Mohr JP Lima FO, Barros LCM, Nepomuceno CR, Portela LB, Silva GS. Predictors of hemorrhagic transformation after acute ischemic stroke based on the experts’ opinion. Arq Neuropsiquiatr. 2020;78(7):390-396. https://doi.org/10.1590/0004-282X20200008.
- Khasanova DR, Kalinin MN, Ibatullin MM, Rakhimov ISh. The haemorrhagic transformation of cerebral infarction: Classification, pathogenesis, predictors and effect on the functional outcome. Ann Clin Exp Neurol. 2019;13(2):47-59. doi: 10.25692/ACEN.2019.2.6.
- Muscari A, Faccioli L, Lega MV, Lorusso A, Masetti M, Trossello MP, et al. Predicting hemorrhagic transformation and its timing from maximum cerebral lesion diameter in nonlacunar ische–mic strokes. Brain Behav. 2020 Jan;10(1):e01497. doi: 10.1002/brb3.1497.
- Meng N, Zhang W, Su Y, Ye Z, Qin Ch. Antiplatelet therapy may be safe in ischemic stroke patients with cerebral microbleed. J Int Med Res. 2020 Aug;48(8):4-9. doi: 10.1177/0300060520949396.
- Pashkovska N, Pashkovskyy V. Insulin resistance and stroke: mechanisms and therapeutic approaches. International Journal of Endocrinology (Ukraine). 2024;20(1):80-86. https://doi.org/–10.22141/2224-0721.20.1.2024.1367.
- Mikhaylichenko ТЕ. Morphological changes in the brain in diabetic encephalopathy. Int J Endocrinol. 2017 Nov 29;13(7):506-14. https://doi.org/10.22141/2224-0721.13.7.2017.115750.
- Honig A, Percy J, Sepehry AA, Gomez AG, Field ThS, Benavente OR. Hemorrhagic Transformation in Acute Ischemic Stroke: A Quantitative Systematic Review. Clin Med. 2022;(11):1-16. https://doi.org/–10.3390/jcm11051162.
- Zsuzsa B, Szegedi I, Kálmándi R, Tóth NK, Csiba L. Markers of coagulation and fibrinolysis predicting the outcome of acute ischemic stroke thrombolysis treatment: A review of the literature. Front Neurol. 2019 Jun 21;10:513. doi: 10.3389/fneur.2019.00513.
- Rahaman P, Del Bigio MR. Histology of Brain Trauma and Hypoxia-Ischemia. Acad Forensic Pathol. 2018 Sep;8(3):539-54. doi: 10.1177/1925362118797728.
- Kolosowska N, Keuters MH, Wojciechowski S, Keksa-Goldsteine V, Laine M, Malm T, et al. Peripheral Administration of IL-13 Induces Anti-inflammatory Microglial/Macrophage Responses and Provides Neuroprotection in Ischemic Stroke. Neurotherapeutics. 2019;16(4):1304-19. https://doi.org/10.1007/s13311-019-00761-0.
- Maestrini I, Ducroquet A, Moulin S, Leys D, Cordonnier C, Bordet R. Blood biomarkers in the early stage of cerebral ischemia. Rev Neurol (Paris). 2016 Mar;172(3):198-219. doi: 10.1016/j.neurol.2016.02.003.
- Yaghi S, Willey JZ, Cucchiara B, Goldstein JN, Gonzales NR, Khatri P, et al. Treatment and outcome of hemorrhagic transformation after intravenous alteplase in acute ischemic stroke a scientific statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2017 Dec;48(12):e343-61. doi: 10.1161/STR.0000000000000152.
- Turner RJ, Sharp FR. Implications of MMP9 for blood brain barrier disruption and hemorrhagic transformation following ische–mic stroke. Front Cell Neurosci. 2016 Mar;10:56. doi: 10.3389/fncel.2016.00056.
- Slujitoru AŞ, Enache AL, Pintea IL, Rolea E, Stocheci CM, Pop OT, et al. Clinical and morphological correlations in acute ische–mic stroke. Rom J Morphol Embryol. 2012;53(4):917-26.
- Mena He М, Zha Х. Time-dependent progression of he–morrhagic transformation after transient ischemia and its association with GPR68-dependent protection Tao Wang. Brain Hemorrhages. 2020;185-191. https://doi.org/10.1016/j.hest.2020.10.001.
- Song Q, Cheng Y, Wang Y, Liu J, Wei Ch, Liu M. Enlarged perivascular spaces and hemorrhagic transformation after acute ischemic stroke. Ann Transl Med. 2021;9(14):1126. https://doi.org/–10.21037/atm-21-1276.
- Hong L, Hsu TM, Zhang Y, Cheng X. Neuroimaging Prediction of Hemorrhagic Transformation for Acute Ischemic Stroke. Cerebrovasc Dis. 2022;51(4):542-552. doi: 10.1159/000521150. Epub 2022 Jan 13. PMID: 35026765.
- Abraham TM, Pencina KM, Pencina MJ, Fox CS. Trends in diabetes incidence: the Framingham Heart Study. Diabetes Care. 2015 Mar;38(3):482-7. doi: 10.2337/dc14-1432. Epub 2014 Dec 31. PMID: 25552418; PMCID: PMC4338506.
- Goncalves A, Su E, Muthusamy A, Zeitelhofer M, Torrente D, Nilsson I, Protzmann J, et al. Thrombolytic tPA-induced hemorrhagic transformation of ischemic stroke is mediated by PKCb phosphorylation of occluding. Blood. 28 Jul. 2022;140(4):338-400.
- Ciacciarelli A, Tessitore A, Fiume G, Curro CT, Coglitore A, Gardin A, et al. Factors associated with hemorrhagic transformation after endovascular treatment despite early recanalization. Journal of the Neurological Sciences. 2023;453:1120778. https://doi.org/10.1016/j.jns.2023.120778.
- Spronk E, Sykes G, Falcione S, Munsterman D, Joy T, Kamtchum-Tatuene J, Jickling GC. Hemorrhagic Transformation in Ischemic Stroke. Front Neurol. 2021;(12):1-15. doi: 10.3389/fneur.2021.661955.
- Sun J, Lam Ch, Christie L, Blair Ch, Li X, Werdiger F, et al. Risk factors of hemorragic transformation in acute ischae–mic stroke: A systematic review and meta-analysis. Front Neurol. 2022;14(1079205):1-15. doi: 10.3389/fneur.2023.1079205.
- Kovács KB, Bencs V, Hudák L, Oláh L, Csiba L. Hemorrha–gic Transformation of Ischemic Strokes. Int J Mol Sci. 2023;(24):1-20. https://doi.org/10.3390/ijms241814067.
- Yanga Sh-J, Lub Y-H, Huangb Y-Ch, Chand L, Tingb W-Y. Immediate CT change after thrombectomy predicting symptomatic hemorrhagic transformation. Original Article. 2023;86(9):854-858. doi: 10.1097/JCMA.0000000000000958.
- Pushie MJ, Messmer M, Sylvain NJ, Heppner J, Newton JM, Hou H, et al. Multimodal imaging of hemorrhagic transformation biomarkers in an ischemic stroke model. Metallomics. 2022;(14):1-13. https://doi.org/10.1093/mtomcs/mfac007.
- Marsh EB, Llinas RH Schneider ALC, Hillis AE, Lawrence E, Dziedzic P, Gottesman RF. Predicting Hemorrhagic Transformation of Acute Ischemic Stroke. Prospective Validation of the HeRS Score. Me–dicine January. 2016;(2):1-8. doi: 10.1097/MD.0000000000002430.
- Zhang K, Luan J, Li C, Chen M. Nomogram to predict he–morrhagic transformation for acute ischemic stroke in Western China: a retrospective analysis. BMC Neurol. 2022 Apr 26;22(1):156. doi: 10.1186/s12883-022-02678-2. PMID: 35468774; PMCID: PMC9040382.
- Fahmi RM, Elkhatib THM, Hafez HAF, Ramadan BM. Factors infuencing hemorrhagic transformation in ischemic stroke patients with atrial fbrillation: a hospital based-study. Egypt J Neurol Psy–chiatry Neurosurg. 2023;59:138. https://doi.org/10.1186/s41983-023-00739-y.
- Başkurt O. Hemorrhagic transformation of ischemic stroke in a patient with Fahr’s disease. Egyptian Journal of Neurosurgery. 2023;(38)27;1-4. https://doi.org/10.1186/s41984-023-00207-y.
- Hong JM, Kim DS, Kim M. Hemorragic transformation after ischemic stroke: mechanisms and management. Front Neurol. 2021;(703258):1-12. doi: 10.3389/fneur.2021.703258.
- Thomas SE, Plumber N, Venkatapathappa P, Gorantla V. A Review of Risk Factors and Predictors for Hemorrhagic Transformation in Patients with Acute Ischemic Stroke. International Journal of Vascular Medicine. 2021;4244267:1-12. https://doi.org/–10.1155/2021/4244267.
- Iancu A, Buleu F, Chita DS, Tutelca A, Raluca Tudor R, Brad S. Early Hemorrhagic Transformation after Reperfusion The–rapy in Patients with Acute Ischemic Stroke: Analysis of Risk Factors and Predictors. Brain Sci. 2023;(13):1-15. https://doi.org/10.3390/brainsci13050840.
- Wu Y, Chen H, Liu X, Cai X, Kong Y, Wang H, et al. A new nomogram for individualized prediction of the probability of hemorrhagic transformation after intravenous thrombolysis for ischemic stroke patients. BMC Neurology. 2020;20(426):1-9. https://doi.org/10.1186/s12883-020-02002-w.
- Jin M, Peng Q, Wang Y. Post-thrombolysis early neurological deterioration occurs with or without hemorrhagic transformation in acute cerebral infarction: risk factors, prediction model and prognosis. Heliyon. 2023;(e15620):1-9. https://doi.org/10.1016/j.heliyon.2023.e15620.