Международный эндокринологический журнал Том 21, №1, 2025
Вернуться к номеру
Дисфункція гіпоталамуса пубертатного віку: епідеміологія, чинники ризику, особливості клінічного перебігу та наслідки патології у дорослих
Авторы: Лембрик І.С., Костіцька І.О., Жиляк О.В., Сарецян Е.А., Кулинич Д.О., Шелевер С.А., Хруняк Ю.Т.
Івано-Франківський національний медичний університет, м. Івано-Франківськ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
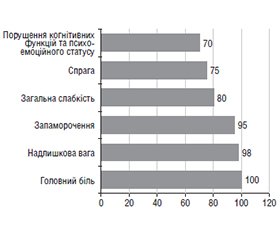
Актуальність. Дисфункція гіпоталамуса пубертатного віку належить до поширених ендокринно-обмінних захворювань, що супроводжує становлення статевої функції, стає фоном або причиною для розвитку соматичної патології з наслідками у дорослому віці. Мета: вивчити частоту, чинники ризику, особливості клінічного перебігу дисфункції гіпоталамуса та наслідки цієї патології у дорослих пацієнтів. Матеріали та методи. Проаналізовано 701 наукову працю латиницею за даними наукометричної пошукової системи PubMed та 82 джерела кирилицею за останні 10 років. Здійснено ретроспективний аналіз медичної документації та результатів лікування підлітків (n = 130; юнаки — 88 (67,7 %) та дівчата — 42 (32,3 %); середній вік — 15,10 ± 1,03 року) із дисфункцією гіпоталамуса пубертатного віку. Вивчено наслідки дисфункції гіпоталамуса пубертатного віку у дорослих пацієнтів (n = 40 пацієнтів: 28 (70,0 %) чоловіків та 12 (30,0 %) жінок, середній вік — 18,10 ± 0,03 року), які отримували медичну допомогу на клінічних базах Івано-Франківського національного медичного університету в період із січня 2014 до грудня 2024 року. Результати. Серед чинників ризику виникнення дисфункції гіпоталамуса у дітей Прикарпаття переважають стрес (90,0 %) й хронічні інфекції ЛОР-органів (83,0 %). Найбільш поширеними клінічними формами захворювання є вегетосудинна (32,0 %) та змішана (44,0 %). До основних симптомів належать головний біль (100,0 %), надлишкова вага (98,0 %) та запаморочення (95,0 %). У пацієнтів віком старше 18 років визначено прогностично несприятливі чинники, серед яких розлади харчової поведінки, зокрема синдром нічного переїдання (20,0 %), що супроводжується надлишком маси тіла (12,5 %) або ожирінням (87,5 %), а також порушенням вуглеводного обміну (предіабет — 7,5 % досліджуваних, цукровий діабет 2-го типу — 5,0 %). Особливу небезпеку становить розвиток морбідного ожиріння, яке виявлено у 30,0 % дорослих пацієнтів із дисфункцією гіпоталамуса. Висновки. Персоналізований підхід до ранньої діагностики та ведення хворих із дисфункцією гіпоталамуса дозволяє удосконалити терапевтичні алгоритми та підвищити ефективність лікування коморбідної патології у молодих пацієнтів.
Background. Pubertal hypothalamic dysfunction is a common endocrine metabolic disease that accompanies the formation of sexual function, becomes a background or cause for the development of somatic pathology with consequences in adulthood. Aim: to study the epidemiology, risk factors, and clinical features of hypothalamic dysfunction and consequences of this pathology in adults. Materials and methods. We analyzed 701 scientific papers in Latin script according to the PubMed scientometric search engine and 82 sources in Cyrillic over the past 10 years. A retrospective analysis of medical records and treatment outcomes of adolescents (n = 130; 88 (67.7 %) boys and 42 (32.3 %) girls, mean age 15.10 ± 1.03 years) with pubertal hypothalamic dysfunction was performed. The consequences of pubertal hypothalamic dysfunction were studied in adult patients (n = 40 patients: 28 (70.0 %) men and 12 (30.0 %) women, mean age 18.10 ± 0.03 years) who received medical care at the clinical bases of Ivano-Frankivsk National Medical University from January 2014 to December 2024. Results. Among the risk factors for hypothalamic pubertal syndrome in children of the Carpathian region, stress (90.0 %) and chronic infections of the ear, nose, and throat (83.0 %) prevail. The most common clinical forms of the disease are vegetative-vascular (32.0 %) and mixed (44.0 %). The main symptoms include: headache (100.0 %), overweight (98.0 %) and dizziness (95.0 %). In patients over the age of 18, prognostically unfavorable factors were identified, including eating disorders, in particular, night eating syndrome (20.0 %), accompanied by overweight (12.5 %) or obesity (87.5 %), as well as carbohydrate metabolism disorders (prediabetes in 7.5 % of subjects, type 2 diabetes in 5.0 %). A particular danger is the development of morbid obesity, which was found in 30.0 % of adult patients with hypothalamic dysfunction. Conclusions. A personalized approach to the early diagnosis and management of patients with hypothalamic dysfunction allows to improve therapeutic algorithms and increase the effectiveness of treatment of comorbid pathology in young patients.
пубертатний вік; дисфункція гіпоталамуса; ожиріння; предіабет; цукровий діабет 2-го типу
adolescence; hypothalamic dysfunction; obesity; prediabetes; type 2 diabetes
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Isakovic B, Bertoldi B, Tuvblad C, Cucurachi S, Raine A, Ba–ker L, et al. Hypothalamic-pituitary-adrenal axis responsivity during adolescence in relation to psychopathic personality traits later in life. Acta Psychol (Amst). 2023 Nov;241:104055. doi: 10.1016/j.actpsy.2023.104055. Epub 2023 Oct 27. PMID: 37866039.
- Ke X, Yuan X, Zhang Y, Wang L, Feng F, Yao Y, et al. The clinical and metabolic characteristics of children and adolescents with hypothalamic dysfunction: A single-centre study from China. Clin Endocrinol (Oxf). 2023 Jan;98(1):59-67. doi: 10.1111/cen.14814. Epub 2022 Sep 5. PMID: 35978545.
- Müller HL, Tauber M, Lawson EA, Özyurt J, et al. Hypothalamic syndrome. Nat Rev Dis Primers. 2022;8(1):24. doi: 10.1038/s41572-022-00351-z.
- Bolshova OV, Malinovska ТМ, Sprynchuk NА, Kvache–niuk DА, Lukashuk IV, Pakhomova VG, et al. Vitamin D, vitamin D-binding protein and parathyroid hormone in children and adolescents with obesity and dysfunction of the hypothalamus. Ukrainian Journal of Perinatology and Pediatrics. 2023;2(94):97-105. doi: 10.15574/PP.2023.94.97.
- Shulhai A-M, Shulhai O. Vitamin D deficiency and factors of metabolic syndrome in overweight and obese adolescents. East Ukr Med J. 2024;12(3):578-586. doi: 10.21272/eumj.2024.
- Van Santen HM, van Schaik J, van Roessel IMAA, Beckhaus J, Boekhoff S, Müller HL. Diagnostic criteria for the hypothalamic syndrome in childhood. Eur J Endocrinol. 2023 Feb 14;188(2):lvad009. doi: 10.1093/ejendo/lvad009. PMID: 36737045.
- Xu Z, Wang Y, Duan L, Yao Y, Feng F, Wang L, et al. Diagnosis and Management of Idiopathic Hypothalamic Dysfunction: A Case Series and Systematic Review. Neuroendocrinology. 2023;113(5):479-488. doi: 10.1159/000529537. Epub 2023 Feb 6. PMID: 36746124.
- Apps JR, Martinez-Barbera JP. A promising future for hypothalamic dysfunction in craniopharyngioma. Neuro Oncol. 2023;25(4):733-734. doi: 10.1093/neuonc/noac284.
- Beckhaus J, Boekhoff S, Scheinemann K, Schilling FH, Fleischhack G, Binder G, et al. Perinatally diagnosed congenital craniopharyngiomas in the KRANIOPHARYNGEOM trials. Endocr Connect. 2023 Nov 15;12(12):e230294. doi: 10.1530/EC-23-0294. PMID: 37878777; PMCID: PMC10692685.
- Hübel C, Herle M, Santos Ferreira DL, Abdulkadir M, Bryant-Waugh R, Loos RJF, et al. Childhood overeating is associated with adverse cardiometabolic and inflammatory profiles in adolescence. Sci Rep. 2021 Jun 14;11(1):12478. doi: 10.1038/s41598-021-90644-2. PMID: 34127697; PMCID: PMC8203659.
- Lebbink CA, Ringers TP, Schouten-van Meeteren AYN, van Iersel L, Clement SC, Boot AM, et al. Prevalence and risk factors of hypothalamic-pituitary dysfunction in infant and toddler childhood brain tumor survivors. Eur J Endocrinol. 2021 Sep 6;185(4):597-606. doi: 10.1530/EJE-21-0137. PMID: 34324432.
- Pankiv V, Yuzvenko T, Mykhalchyshyn G. Relationships between diabetes distress and biomarkers in people with type 1 diabetes mellitus. International Journal оf Endocrinology (Ukraine). 2024;20(8):639-642. https://doi.org/10.22141/2224-0721.20.8.2024.1472.
- Guo Y, Pei L, Li Y, Li C, Gui S, Ni M, et al. Characteristics and factors influencing hypothalamic pituitary dysfunction in patients with craniopharyngioma. Front Endocrinol (Lausanne). 2023 Jun 2;14:1180591. doi: 10.3389/fendo.2023.1180591. PMID: 37324266; PMCID: PMC10267662.
- Wallace K, Greene E, Moya-Mendez M, Freemark M, Prange L, Mikati MA. Hypothalamic-pituitary dysfunction in alternating hemiplegia of childhood. Eur J Paediatr Neurol. 2021 May;32:1-7. doi: 10.1016/j.ejpn.2021.03.007. Epub 2021 Mar 11. PMID: 33756210.
- Sophie Gibson ME, Fleming N, Zuijdwijk C, Dumont T. Where Have the Periods Gone? The Evaluation and Management of Functional Hypothalamic Amenorrhea. J Clin Res Pediatr Endocrinol. 2020;12(1):18-27. doi: 10.4274/jcrpe.galenos.2019.2019.S0178.
- Męczekalski B, Niwczyk O, Battipaglia C, Troia L, Kostrzak A, Bala G, et al. Neuroendocrine disturbances in women with functional hypothalamic amenorrhea: an update and future directions. Endocrine. 2024 Jun;84(3):769-785. doi: 10.1007/s12020-023-03619-w. Epub 2023 Dec 7. Erratum in: Endocrine. 2024 Jul;85(1):458. doi: 10.1007/s12020-024-03713-7. PMID: 38062345; PMCID: PMC11208264.
- Cornier MA. A review of current guidelines for the treatment of obesity. Am J Manag Care. 2022 Dec;28(15 Suppl):S288-S296. doi: 10.37765/ajmc.2022.89292. PMID: 36525676.
- Gromnatska N, Marushko Y, Hyshchak T, Belusova V. The method of determining abdominal obesity by waist circumfe–rence in Ukrainian children. Mìžnarodnij endokrinologìčnij žurnal. 2024;20(6):459-463. doi: 10.22141/2224-0721.20.6.2024.1443.
- Van Roessel IMAA, de Graaf JP, Biermasz NR, Charmandari E, van Santen HM. Acquired hypothalamic dysfunction in childhood: “what do patients need? ” — an Endo-ERN survey. Endocr Connect. 2023;12(10):e230147. doi: 10.1530/EC-23-0147.
- Minari TP, Araújo-Filho GM, Tácito LHB, Yugar LBT, Rubio TA, Pires AC, et al. Effects of Mindful Eating in Patients with Obesity and Binge Eating Disorder. Nutrients. 2024 Mar 19;16(6):884. doi: 10.3390/nu16060884. PMID: 38542795; PMCID: PMC10975968.
- Leme ACB, Haines J, Tang L, Dunker KLL, Philippi ST, Fisberg M, et al. Impact of Strategies for Preventing Obesity and Risk Factors for Eating Disorders among Adolescents: A Systematic Review. Nutrients. 2020 Oct 14;12(10):3134. doi: 10.3390/nu12103134. PMID: 33066501; PMCID: PMC7602154.
- Zherdova NM, Stepura OA, Kostitska IO, Mazii SI. Effect of dietary fiber intake on eating behavior in overweight and obese patients. Problems of Endocrine Pathology. 2021;78(4):20-26. doi: 10.21856/j-PEP.2021.4.03.
- Laniush FV, Urbanovych AM. Night-Eating Questionnaire (NEQ) — validation and adaptation for the Ukrainian population. Endokrynologia. 2021;26(3):311-318. doi: 10.31793/1680-1466.2021.26-3.311.
- Diniz MFHS, Beleigoli AMR, Schmidt MI, Duncan BB, Ribeiro ALP, Vidigal PG, et al. Homeostasis model assessment of insulin resistance (HOMA-IR) and metabolic syndrome at baseline of a multicentric Brazilian cohort: ELSA-Brasil study. Cad Saude Publica. 2020 Sep 2;36(8):e00072120. doi: 10.1590/0102-311X00072120. PMID: 32901702.
- Khamis AM. Pathophysiology, Diagnostic Criteria, and Approaches to Type 2 Diabetes Remission. Cureus. 2023 Jan 18;15(1):e33908. doi: 10.7759/cureus.33908. PMID: 36819346; PMCID: PMC9936340.
- Harvengt J, Gernay C, Mastouri M, Farhat N, et al. ROHHAD(NET) Syndrome: Systematic Review of the Clinical Timeline and Recommendations for Diagnosis and Prognosis. J Clin Endocrinol Metab. 2020;105(7):dgaa247. doi: 10.1210/clinem/dgaa247.
- Ramistella V, Wasniewska M, Valenzise M, Corica D, et al. A not very essential obesity: the Rohhad syndrome. Description of two cases and review of the literature. Pediatr Med Chir. 2013;35(4):187-90. doi: 10.4081/pmc.2013.40.
- Khaytin I, Victor AK, Barclay SF, Benson LA, et al. Ra–pid-onset obesity with hypothalamic dysfunction, hypoventilation, and autonomic dysregulation (ROHHAD): a collaborative review of the current understanding. Clin Auton Res. 2023;33(3):251-268. doi: 10.1007/s10286-023-00936-y.
- Şiraz ÜG, Ökdemir D, Direk G, Akın L, et al. ROHHAD Syndrome, a Rare Cause of Hypothalamic Obesity: Report of Two Cases. J Clin Res Pediatr Endocrinol. 2018;10(4):382-386. doi: 10.4274/jcrpe.0027.
- Vlasenko M. Hypothalamic Syndrome. Mìžnarodnij endokrinologìčnij žurnal. 2012 Feb 22;43(3):70-76. doi: 10.22141/2224-0721.0.3.43.2019.177184.
- Botsyurko V, Kostitska I, Didushko O, Marusyn O, Chernyavska I. Dysfunction of the hypothalamus: etiology, clinical picture, diagnosis, treatment (guidelines). Mìžnarodnij endokrinologìčnij žurnal. 2017;13(4):290-296. doi: 10.22141/2224-0721.13.4.2017.106659.
- Che Soh NAA, Yaacob NM, Omar J, Mohammed Jelani A, et al. Global Prevalence of Macroprolactinemia among Patients with Hyperprolactinemia: A Systematic Review and Meta-Analysis. Int J Environ Res Public Health. 2020;17(21):8199. doi: 10.3390/ijerph17218199.
- Xu Z, Ke X, Yuan X, Wang L, et al. Metabolic syndrome as a common comorbidity in adults with hypothalamic dysfunction. Front Endocrinol (Lausanne). 2022;13:973299. doi: 10.3389/fendo.2022.973299.
- Dong GZ, Zhang QY, Jiao YW, Ma Y, et al. The contribution of type 2 diabetes mellitus to hypothalamic inflammation and depressive disorders in young patients with obesity. Ann Transl Med. 2022;10(3):134. doi: 10.21037/atm-22-192.
- Van Schaik J, Burghard M, Lequin MH, van Maren EA, et al. Resting energy expenditure in children at risk of hypothalamic dysfunction. Endocr Connect. 2022; 11(8): e220276. doi: 10.1530/EC-22-0276.