Старіння населення — неминучий процес, що став однією з ключових рис сучасного світу. Досягнення медицини та поліпшення умов життя сприяють збільшенню тривалості життя, але водночас ведуть до зростання вікових захворювань, зокрема когнітивних порушень. Різні зміни — від легких розладів пам’яті до тяжких неврологічних станів — поступово позбавляють людину можливості повноцінно сприймати світ. Найглибшим їх проявом є деменція — синдром, що стирає спогади, порушує мислення, орієнтацію та здатність до самостійного життя. У суспільстві, що невпинно старіє, збереження ясності розуму та гідності людини в літньому віці стає не лише медичним, а й важливим соціальним завданням.
Деменція (або тяжкий нейрокогнітивний розлад), що переважно проявляється у людей похилого віку, стає все більш значущою проблемою, а випадки її раннього виникнення (до 65 років) привертають дедалі більше уваги та потребують детального вивчення [1]. Щороку у світі діагностують понад 10 мільйонів нових випадків деменції, тобто один новий випадок кожні три секунди. За офіційними даними, кількість людей із деменцією у 2020 році перевищувала 55 мільйонів, і за прогнозами, цей показник майже подвоюватиметься кожні два десятиліття: до 2030 року очікується 78 мільйонів хворих, а до 2050 року — 139 мільйонів [2]. Основний приріст припаде на країни із низьким і середнім доходом.
Більшість випадків деменції (60–70 %) пов’язана із хворобою Альцгеймера (ХА) [3]. Це нейродегенеративне захворювання, основною ознакою якого є накопичення амілоїдних бляшок і тау-клубків у мозку, що спричиняє поступове погіршення когнітивних здібностей. Оскільки ХА має прихований початок і прогресуючий характер, вона швидко перетворюється на значний глобальний виклик.
За результатами досліджень, у 2023 році загальна чисельність людей із деменцією, продромальною та доклінічною стадіями ХА оцінювалася в 32, 69 і 315 мільйонів відповідно. Сукупно це становило 416 мільйонів осіб, що відповідало 22 % населення віком від 50 років [4]. При цьому ризик виникнення захворювання подвоюється кожні 5 років після 65 років, і приблизно 50 % пацієнтів з ХА є носіями алеля ε4 аполіпопротеїну Е (APOE) [5]. Зростання поширеності деменції стає серйозним викликом для систем охорони здоров’я та соціального захисту. Пацієнти потребують постійного догляду, що лягає тягарем на родичів і медичний персонал. Витрати на лікування та підтримку хворих невпинно зростають, створюючи економічне навантаження на держави [2].
Проблему значно ускладнили виклики останніх років, зокрема пандемія SARS-CoV-2: когнітивні порушення спостерігаються у близько 20 % пацієнтів після перенесеного COVID-19 [6]. Військові дії в Україні також негативно впливають на ментальне благополуччя населення, сприяючи розвитку психічних розладів, зокрема депресії, тривожності та когнітивних порушень [7].
Стрімке збільшення кількості випадків деменції зумовлене, зокрема, збільшенням частоти факторів її розвитку, серед яких важливе місце посідає цукровий діабет (ЦД), що є одним з найпоширеніших хронічних неінфекційних захворювань і офіційно діагностований у більш ніж пів мільярда жителів нашої планети [8].
ЦД визнаний незалежним фактором, що призводить до когнітивних порушень і значно підвищує ймовірність розвитку деменції, зокрема ХА та судинної деменції [9]. З огляду на тенденцію до зростання поширеності цього захворювання, значення діабету як фактора ризику для розвитку численних ускладнень, зокрема когнітивних порушень, залишається надзвичайно актуальним [8].
За результатами останнього метааналізу 14 досліджень із залученням даних понад 47 тисяч осіб, передчасне старіння мозку спричиняють ЦД, гіпертензія та ожиріння. При цьому найбільший вплив має діабет (d = 0,275), що більше ніж удвічі перевищує ефект гіпертензії (d = 0,113) та ожиріння (d = 0,112). Це вказує на ЦД як основний фактор ризику змін у структурі мозку, які можуть призводити до когнітивного зниження та деменції [10].
Нещодавнє епідеміологічне дослідження на основі даних Global Burden of Disease засвідчило зростання поширеності ХА та інших деменцій, пов’язаних із підвищеним рівнем глюкози в крові, що спричинило значне збільшення смертності та втрати років життя з поправкою на інвалідність за останні десятиліття, особливо в країнах із високим рівнем доходу [11].
За результатами масштабних метааналізів, у осіб з ЦД ризик розвитку деменції протягом життя збільшується в середньому на 50 %, а в деяких дослідженнях цей показник сягає 91 %. Встановлено, що частота судинної деменції серед осіб із ЦД є майже удвічі вищою, ніж у загальній популяції [12], причому із суттєво більшою частотою у жінок [13].
Також зазначається значне зростання смертності серед пацієнтів з ЦД, що страждають на ХА [14].
Основну категорію осіб з когнітивними порушеннями становлять пацієнти з ЦД 2-го типу, що, з одного боку, пояснюється великим поширенням захворювання серед літніх людей (у близько 30 % осіб старше 65 років), а з іншого — прискоренням старіння мозку внаслідок зменшення утилізації ним глюкози через притаманну цьому різновиду діабету церебральну інсулінорезистентність, що створює хронічний дефіцит енергії та негативно позначається на структурі та функції головного мозку [15].
За результатами численних епідеміологічних, клінічних, нейровізуалізаційних і автопсійних досліджень при ЦД 2-го типу значно зростає частота як цереброваскулярних, так і нейродегенеративних змін у головному мозку [12, 15]. Також зазначається збільшення випадків деменції змішаного типу, зокрема поєднання судинної деменції та ХА [16]. Водночас встановлено підвищення поширеності помірних когнітивних порушень, частота яких, за окремими даними, при ЦД 2-го типу становить 45 % [17].
Встановлено, що ризик когнітивних порушень зростає вже на стадії предіабету, особливо у жінок, у яких спостерігається не лише більш ранній розвиток деменції, а й більш суттєві зміни в метаболізмі кори головного мозку [18]. Зазначається, що інсулінорезистентність нейронів призводить до їх значного пошкодження ще задовго до моменту офіційного діагностування ЦД 2-го типу [15].
До того ж порушення когнітивних функцій при ЦД перешкоджають адаптації пацієнта до захворювання, знижують рівень прихильності до лікування, ускладнюють виконання рекомендацій щодо дієти, прийому пероральних гіпоглікемізувальних засобів, інсулінотерапії, самоконтролю тощо. Це ускладнює досягнення оптимальної компенсації захворювання та збільшує ризик прогресування інвалідизуючих ускладнень, розвитку епізодів гіпоглікемії, а також підвищує серцево-судинний ризик і смертність [19].
Отже, раннє виявлення когнітивних порушень відіграє ключову роль у стратегії ведення пацієнтів із цукровим діабетом, оскільки своєчасна профілактика є найдієвішим підходом для зниження ризику розвитку деменції та підтримання когнітивного здоров’я.
В оновлених стандартах надання медичної допомоги при ЦД Американської діабетологічної асоціації (ADA, 2025) підкреслюється, що літні люди з діабетом мають підвищений ризик когнітивних порушень та потреби в інституційному догляді. Прояви можуть варіюватися від легких труднощів до втрати пам’яті та вираженого недоумства. Тому скринінг для раннього виявлення легких когнітивних порушень або деменції слід проводити для дорослих віком від 65 років під час першого візиту, щорічно та за необхідності [20].
Водночас ЦД є значущим фактором ризику деменції не тільки в осіб похилого, а й середнього віку, особливо у випадку ХА. Доведено, що ранній початок ЦД значно підвищує ймовірність розвитку деменції порівняно з його появою в літньому віці. Зокрема, кожне зниження віку дебюту на 5 років суттєво збільшує ризик когнітивних порушень у майбутньому [21]. Ця проблема набуває особливої актуальності, оскільки поширеність ЦД 2-го типу залишається високою, а захворюваність серед молоді зростає, що пов’язано із глобальним зростанням рівня ожиріння, малорухливим способом життя та незбалансованим харчуванням.
З огляду на це у стандартах ADA 2025 року зазначається, що скринінг когнітивних порушень при ЦД також має бути розглянутий незалежно від віку у разі значного погіршення клінічного стану пацієнта, зокрема через зростання труднощів з самообслуговуванням і дотриманням лікувальних рекомендацій. Це може включати помилки в дозуванні інсуліну, складнощі з підрахунком вуглеводів, пропуски прийому їжі та інсуліну, а також труднощі в розпізнаванні, запобіганні чи лікуванні гіпоглікемії. Пацієнти з позитивними результатами скринінгу на когнітивні порушення повинні пройти відповідну діагностичну оцінку, що включає направлення до фахівця з поведінкової медицини для офіційної когнітивної та нейропсихологічної діагностики [20].
Для скринінгу когнітивних порушень доступні кілька простих психодіагностичних тестів, як-от MMSE (мінітест стану психічного здоров’я), Mini-Cog (коротка шкала оцінки психічного статусу) або MoCA (Монреальська шкала оцінки когнітивних функцій), які можуть бути корисними для ідентифікації пацієнтів, що потребують нейропсихологічної оцінки, зокрема у випадку підозри на деменцію [20].
Наступним кроком після психодіагностичних тестів та збору анамнезу є клінічне обстеження, яке включає оцінку неврологічного статусу для виявлення можливих неврологічних порушень. Важливо виключити інші причини когнітивних порушень, такі як депресія, інфекційні захворювання, порушення обміну речовин або побічні ефекти ліків. Для цього проводяться лабораторні дослідження, включаючи загальний та біохімічний аналіз крові, оцінку рівня гормонів, вітамінів (B12, фолієва кислота), а також тести на сифіліс та ВІЛ [22].
Нейровізуалізація, зокрема МРТ або КТ головного мозку у поєднанні з аналізом церебральної гемодинаміки, є ключовим етапом діагностики деменції, оскільки ЦД пов’язаний із розвитком атрофічних змін у головному мозку, зокрема в корі та ключових структурах лімбічної системи, які відіграють центральну роль у когнітивних функціях [23]. Нейровізуалізаційна діагностика дозволяє виявити структурні зміни, такі як атрофія мозку, інфаркти, ураження білої речовини або наявність інших патологій (пухлини, гематоми, гідроцефалія). У випадках підозри на певний тип деменції, наприклад ХА, можуть бути рекомендовані додаткові дослідження, такі як аналіз спинномозкової рідини для визначення біомаркерів (β-амілоїд, тау-білок) [22]. У 2024 році вийшли оновлені рекомендації Робочої групи Американської асоціації Альцгеймера (Alzheimer’s Association) та Національного інституту зі старіння (NIA, США), які акцентують увагу на використанні біомаркерів для діагностики ХА. Вони рекомендують використовувати біомаркери Core 1, такі як амілоїд-ПЕТ, біомаркери цереброспінальної рідини (CSF) та фосфорильований тау-217 у плазмі, для виявлення патології на ранніх стадіях, навіть до появи клінічних симптомів. Біомаркери Core 2, включно з тау-ПЕТ та маркерами нейронального пошкодження (наприклад, NFL), допомагають уточнити стадію захворювання та прогноз [24]. Діагноз деменції встановлюється на основі міжнародних діаг–ностичних критеріїв, як-от DSM-5 або ICD-10 [22].
Отже, своєчасна діагностика, ефективне лікування та профілактика когнітивних розладів є ключовими заходами для зниження ризику деменції у пацієнтів із ЦД. Водночас, як зазначено в стандартах ADA 2025 року, попри досягнення сучасної медичної науки, на даний момент не існує ефективних методів лікування когнітивних розладів у пацієнтів з ЦД, а клінічні випробування нових засобів, зокрема антиамілоїдних моноклональних антитіл для лікування ранньої ХА, які зменшують амілоїдний тягар у мозку та уповільнюють зниження когнітивних функцій, виявили помірну результативність з незрозумілими наслідками та можливими побічними ефектами [20].
З огляду на це основним завданням на сьогодні є розробка профілактичних заходів, орієнтованих на фактори ризику та механізми розвитку когнітивних порушень при ЦД, насамперед 2-го типу.
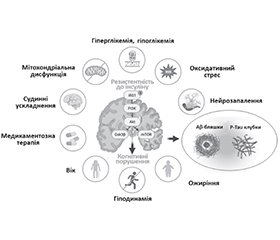
Згідно з результатами численних досліджень когнітивні порушення при ЦД 2-го типу розвиваються під впливом комплексу факторів і механізмів [25] (рис. 1). Гіперглікемія пошкоджує судини та нервові клітини, сприяючи утворенню Аβ-амілоїду. Інсулінорезистентність порушує метаболізм нейронів через дисфункцію ключових сигнальних шляхів, таких як субстрат рецептора інсуліну 1 (IRS1), фосфатидилінозитол-3-кіназа (PI3K), протеїнкіназа B (AKT) та глікогенсинтазкіназа-3β (GSK3β). Ці порушення призводять до зниження передачі сигналів інсуліну в мозку, що сприяє накопиченню тау-білка та утворенню нейрофібрилярних клубків. Крім того, дизрегуляція шляху мішені рапаміцину в клітинах (mTOR), який контролює клітинне зростання, метаболізм і автофагію, погіршує клітинний гомеостаз і сприяє накопиченню токсичних білків. Дисфункції мітохондрій знижують енергозабезпечення клітин, а оксидативний стрес пошкоджує нейрони через вільні радикали. Дія поглиблюється внаслідок формування кінцевих продуктів глікації (AGEs) та нейрозапалення. Судинні ускладнення, такі як атеросклероз і хвороба малих судин, ведуть до церебральної ішемії та гіпоксії, а гострі порушення мозкового кровообігу значно погіршують когнітивні функції. Гіпоглікемія, особливо часті або тяжкі епізоди, також може спричиняти ураження нейронів і погіршувати когнітивні функції. Старіння прискорює ці процеси, а ожиріння та низька фізична активність підсилюють запальні реакції та метаболічні порушення. Медикаментозна терапія також може мати побічні ефекти, які впливають на мозок.
Зрештою, причина когнітивних порушень при ЦД 2-го типу є багатофакторною, але ключову роль відіграє інсулінорезистентність, зокрема церебральна.
/144.jpg)
Клінічні спостереження вказують на тісний зв’язок між когнітивними порушеннями у пацієнтів з ЦД 2-го типу та підвищенням рівня інсулінорезистентності [26]. Рівень когнітивного зниження корелює не тільки з порушеннями вуглеводного обміну, а й з іншими елементами метаболічного синдрому, які виникають через інсулінорезистентність. Зокрема, останній метааналіз шести когортних досліджень із сімома вибірками, що охопили 484 994 учасники, виявив ризик щодо розвитку ХА для артеріальної гіпертензії та гіперглікемії [27]. В іншому дослідженні у пацієнтів з ХА різні ступені когнітивних порушень асоціювалися із зайвою вагою, артеріальною гіпертензією, дисліпідемією та іншими факторами. Автори зазначають, що наявність метаболічного синдрому значно збільшує імовірність прогресування когнітивних розладів від початкових стадій до деменції, а його біомаркери можуть бути корисними для оцінки швидкості погіршення когнітивних функцій [28].
Раніше вважалося, що мозок не чутливий до інсуліну, оскільки він не бере участі у поглинанні глюкози в ЦНС. Проте сучасні дослідження підтвердили, що інсулін у високих концентраціях присутній у мозку та регулює численні церебральні функції. Інсулінова сигналізація критично важлива для когнітивних процесів, адже гіпокамп і енторинальна кора, багаті на інсулінові рецептори, беруть участь у формуванні пам’яті, уваги та виконавчих функцій. Інсулін разом із інсуліноподібним фактором росту-1 не лише підтримує глюкозний метаболізм, а й чинить нейропротекторну дію, запобігаючи пошкодженням від ішемії, β-амілоїдної токсичності та окиснювального стресу. З віком його концентрація та чутливість рецепторів знижуються [29]. Порушення в будь-якій ланці інсулінового шляху можуть негативно впливати на когнітивні функції [30].
У численних роботах підтверджується зв’язок між когнітивною дисфункцією при ЦД 2-го типу та ХА, що пов’язують з інсулінорезистентністю головного мозку. Це явище сприяє нейродегенеративним процесам, що дало підстави науковцям розглядати деменцію як «діабет мозку» або «діабет 3-го типу» [29]. Підтримку цій гіпотезі надають спостереження, що у пацієнтів з ХА рівень інсуліну та кількість його рецепторів у зонах мозку, відповідальних за навчання і пам’ять, значно відрізняються від показників здорових осіб.
Порушення інсулінової сигналізації внаслідок інсулінорезистентності тісно пов’язане з аполіпопротеїном E і сприяє патологічним процесам, таким як утворення амілоїдних бляшок, що негативно впливає на когнітивні функції, зокрема на короткочасну та довготривалу пам’ять. Основні механізми цього процесу включають гіперфосфорилювання білка тау, накопичення β-амілоїду та посилення окиснювального стресу. Ці фактори призводять до мітохондріальної дисфункції, яка порушує енергетичний баланс клітин, сприяє нейрональному апоптозу та зростанню секреції прозапальних цитокінів. У результаті запускається каскад нейродегенеративних процесів, які пошкоджують структуру та функцію мозку. Зумовлена інсулінорезистентністю підвищена продукція аміліну із відкладенням його депозитів у мозку також відіграє важливу роль у розвитку когнітивних порушень [29–31].
Результати більшості досліджень переконливо доводять, що хронічна гіперглікемія, зумовлена недостатнім контролем ЦД, значно збільшує ризик розвитку і прогресування деменції [32, 34, 35]. Підвищений рівень глюкози у крові запускає низку патологічних процесів, включаючи утворення вільних радикалів, неферментативне глікозилювання білків, активацію поліолового шляху метаболізму глюкози та накопичення кінцевих продуктів глікації. Ці механізми викликають ендотеліальну дисфункцію, порушення властивостей крові та ураження дрібних судин головного мозку (церебральна хвороба малих судин). Крім того, інсулінорезистентність і підвищений рівень інсуліну в крові сприяють розвитку дисліпідемії, підвищенню артеріального тиску та атеросклерозу судин мозку. У результаті ці фактори та механізми призводять до зменшення об’єму сірої речовини, мікроструктурних змін і атрофії білої речовини та порушення когнітивних функцій [25, 29, 33].
У пацієнтів з ЦД обох типів продемонстрований тісний зв’язок рівня глікемії та глікованого гемоглобіну (HbA1c) з порушеннями вищих мозкових функцій. Зокрема, за даними дослідження ACCORD-MIND (Action to Control Cardiovascular Risk in Diabetes-Memory in Diabetes trial), підвищений рівень HbA1c пов’язаний із зниженням когнітивних функцій [32]. Проте зростання показника глікемії натще в цьому та інших дослідженнях не корелювало з погіршенням результатів психодіаг–ностичних тестів [34], тоді як високий рівень середньодобової глікемії асоціювався зі зростанням ризику деменції [35]. На думку науковців, це є свідченням негативного впливу на когнітивні функції саме хронічної гіперглікемії, а не одиничного сплеску рівня глюкози у крові.
Також з’ясовано, що зниження функціональної активності β-клітин, яке веде до недостатньої секреції інсуліну, негативно впливає на пізнавальні здібності та сприяє розвитку когнітивних порушень [36].
З іншого боку, надмірне зниження рівня глюкози в крові підвищує ризик гіпоглікемії та негативно впливає на когнітивні функції. Оскільки мозок використовує глюкозу як основне джерело енергії, постійний її дефіцит може призводити до структурних змін, зокрема до атрофії кори головного мозку та гіпокампа, які відіграють ключову роль у процесах пам’яті та навчання.
Дослідження ARIC (The Atherosclerosis Risk in Communities) виявило зв’язок між гіпоглікемією та зменшенням об’єму мозку [37]. За даними масштабного метааналізу із залученням даних понад 1,4 мільйона пацієнтів, гіпоглікемія підвищує ризик розвитку деменції у хворих на ЦД на 44 % [38]. У дослідженні ET2DS (The Edinburgh Type 2 Diabetes Study) було встановлено, що як минулі, так і нові епізоди гіпоглікемії пов’язані зі значними когнітивними порушеннями [39]. Крім того, гостра гіпоглікемія може викликати серцево-судинні кризи та порушення кровообігу через активізацію симпатоадреналової системи та гормональну дизрегуляцію. Ці процеси разом із ендотеліальною дисфункцією, окиснювальним стресом, порушенням імунної регуляції та активацією апоптозу підвищують ризик ішемії та судинних ускладнень.
Крім того, когнітивні порушення можуть значно підвищувати ризик гіпоглікемії, оскільки у пацієнтів знижується прихильність до терапії, що проявляється у недотриманні дієтичних рекомендацій або неправильному дозуванні ліків. Наприклад, результати дослідження ADVANCE продемонстрували, що тяжкі когнітивні дисфункції подвоюють імовірність розвитку гіпоглікемії [40]. До того ж порушення когнітивних функцій ускладнюють своєчасне розпізнавання симптомів гіпоглікемії, що може призвести до затримки медичної допомоги, підвищуючи ризик серйозних наслідків, зокрема падінь, серцево-судинних ускладнень та інших загрозливих для життя станів [37, 41]. Зокрема, у межах дослідження GERODIAB було встановлено, що через два роки рівень смертності серед пацієнтів із показником MMSE < 24 був удвічі вищим, ніж у тих, хто мав вищий результат тесту [41].
Таким чином, для профілактики розвитку та прогресування когнітивних порушень у пацієнтів із ЦД 2-го типу ключовим є забезпечення ефективного контролю вуглеводного обміну, зменшення інсулінорезистентності та збереження функції β-клітин. Особливу увагу слід приділяти мінімізації ризику гіпоглікемії, яка може погіршувати нейрометаболічні процеси, підвищувати ймовірність деменції та судинних ускладнень. Це досягається шляхом ретельного глікемічного контролю, індивідуалізації цільових рівнів глюкози та корекції терапії з урахуванням когнітивного статусу пацієнта.
Провідне значення у зниженні ризику розвитку деменції має модифікація способу життя. Відповідно до рекомендацій ВООЗ регулярна фізична активність, відмова від паління, обмеження вживання алкоголю, контроль маси тіла, збалансоване харчування та підтримка нормального рівня артеріального тиску, холестерину і глюкози у крові сприяють зменшенню ймовірності цього захворювання [2].
Нещодавній систематичний огляд і метааналіз визначили 61 модифікований фактор ризику деменції, серед яких ключову роль відіграють низький рівень освіти, гіпертензія, втрата слуху, недостатня фізична активність і ожиріння. Ці фактори особливо значущі для країн із низьким і середнім рівнем доходу [42]. Для підтримки когнітивних функцій важливими є інтелектуальні та емоційні навантаження, регулярні вправи на розвиток пам’яті, зокрема вивчення іноземних мов, розгадування кросвордів і головоломок, а також запам’ятовування важливих дат, телефонних номерів чи віршованих текстів.
Фізична активність має включати щоденні заняття, такі як ранкова зарядка, піші прогулянки на свіжому повітрі, плавання, легкий біг та велосипедні поїздки. Аналіз восьми клінічних випробувань за участю 884 осіб продемонстрував суттєвий вплив фізичних вправ на когнітивні функції у пацієнтів із ЦД 2-го типу та когнітивними порушеннями. Регулярна фізична активність не лише поліпшувала виконавчі функції, а й сприяла зниженню рівня HbA1c та глюкози в крові натще на 10–15 % [43]. Цьогорічний масштабний метааналіз 29 досліджень за участю 1 453 561 особи, серед яких 68 497 мали ХА, виявив, що інтенсивні фізичні навантаження зменшують ризик розвитку цього захворювання на 26 %. Дослідження взаємозв’язку між дозою фізичної активності та ефектом показало, що кожні додаткові 10 метаболічних годин вправ на тиждень сприяють зниженню ймовірності хвороби на 15 %. Найвищий рівень захисту відзначено у людей з індексом маси тіла менше 25 (зменшення ризику на 35 %), осіб віком понад 75 років (на 43 %) та тих, хто не має алеля APOE ε4 (на 28 %) [44].
Важливим аспектом є раціональне харчування, що передбачає виключення з раціону смажених, жирних та копчених страв, обмеження споживання солі та цукру, а також надання переваги овочам, фруктам, нежирним сортам м’яса та риби, кашам і кисломолочним продуктам. Необхідно забезпечити достатнє надходження вітамінів, особливо групи B. У рандомізованому контрольованому дослідженні DIRECT PLUS було виявлено, що середземноморська та «зелена» середземноморська дієти, багаті на поліфеноли, значно уповільнюють старіння мозку, зменшуючи вікову атрофію мозку на ~50 % за 18 місяців. Дослідження показало, що поліпшення контролю рівня глюкози в крові та інсулінорезистентності є ключовими факторами, які сприяють нейропротективним ефектам цих дієт. Зокрема, зниження рівня HbA1c було пов’язане зі зменшенням атрофії гіпокампа, таламуса, хвостатого ядра та мозочка [45].
Що стосується впливу факторів навколишнього середовища, то останній метааналіз продемонстрував, що забруднення повітря (дрібні тверді частинки, діоксид азоту, оксиди азоту, чадний газ), хронічний шум, змінна робота та тютюновий дим пов’язані з підвищеним ризиком загальної деменції та її підтипів, зокрема ХА і судинної деменції. На думку авторів, зменшення забруднення повітря та контроль за впливом тютюнового диму можуть бути ефективними заходами громадського здоров’я для зниження ризику деменції [46].
Також наголошується на важливості обмеження вживання алкоголю. Метааналіз із залученням результатів 17 досліджень, що охопив понад 80 тисяч осіб, показав, що помірне вживання алкоголю (до 30 г/день) було пов’язане зі зниженим ризиком когнітивних порушень, тоді як перевищення цього рівня підвищувало ризик. Для деменції найнижчий ризик спостерігався при вживанні до 15 г/день, а вищі дози збільшували ймовірність її розвитку на 23 %. Отримані результати підтверджують, що легке або помірне споживання алкоголю може мати нейропротективний ефект [47].
Особливу увагу слід приділяти нормалізації ваги, оскільки надмірна маса тіла та ожиріння можуть посилювати інсулінорезистентність, погіршувати стан судинної системи, що підвищує ризик деменції [48]. На сьогодні ожиріння середнього віку визнане ключовим модифікованим фактором ризику деменції у США, випереджаючи такі фактори, як низький рівень фізичної активності, тютюнопаління, депресія, недостатня освіта, ЦД, гіпертензія та втрата слуху [49].
Як вже зазначалося, хронічна гіперглікемія відіграє важливу роль у виникненні церебральних порушень при діабеті, тому ефективне управління рівнем глюкози є важливим для профілактики розвитку та прогресування когнітивних розладів при ЦД. Однак питання щодо переваг досягнення максимальної компенсації глікемії при ЦД 2-го типу залишається дискусійним.
Встановлено, що задовільний контроль рівня глюкози пов’язаний з менш вираженими порушеннями когнітивних функцій. Наприклад, у рамках китайського довгострокового дослідження CHARLS було виявлено, що у літніх пацієнтів з ЦД, які отримували активне лікування, когнітивні функції були кращими порівняно з людьми без діабету [50]. Водночас дослідження ACCORD MIND, проведене в 52 клінічних центрах Північної Америки за участю близько 3000 пацієнтів із ЦД 2-го типу, не показало значного поліпшення когнітивних функцій при інтенсивному контролі рівня глюкози [51]. Крім того, такий жорсткий контроль, особливо у літніх людей, може бути ризикованим через можливість виникнення гіпоглікемічних епізодів, що негативно впливають на когнітивні здібності.
Таким чином, підхід до лікування та профілактики когнітивних порушень при ЦД має бути адаптований індивідуально, щоб мінімізувати ризик як гіперглікемії, так і гіпоглікемії, а також бути ефективним у запобіганні розвитку судинних ускладнень.
Згідно зі стандартами ADA 2025 року для осіб похилого віку з когнітивними порушеннями рекомендовано встановлювати менш жорсткі цілі з контролю глікемії, зокрема підтримувати рівень HbA1c менше ніж 8,0 % [52].
Останнім часом широко вивчається вплив виду гіпо–глікемізувальної терапії на пізнавальні функції пацієнтів з різними варіантами когнітивних порушень і деменції. Оскільки результати багатьох досліджень надали переконливі докази ролі інсулінорезистентності в розвитку когнітивних порушень при ЦД 2-го типу, найбільш перспективними цукрознижувальними засобами для запобігання їх розвитку визнані препарати з групи сенситайзерів інсуліну [53].
Для пацієнтів із ЦД 2-го типу, які потребують ініціації або інтенсифікації цукрознижувальної терапії для досягнення та/або підтримки індивідуальних глікемічних цілей, найбільш широко використовуваним і традиційно рекомендованим препаратом першої лінії є метформін, який був впроваджений у клінічну практику близько 70 років тому і на сьогодні є найбільш вивченим протидіабетичним препаратом [54].
Експерти ADA зазначають, що метформін демонструє високу ефективність і безпеку, має доступну вартість, є значно поширеним і знижує ризик розвитку мікросудинних ускладнень, серцево-судинних подій і смертності. На сьогодні це єдиний препарат, рекомендований для лікування переддіабету, який разом із зміною способу життя довів свою ефективність у профілактиці ЦД 2-го типу [55].
За результатами дослідження UKPDS (UK Prospective Diabetes Study), призначення метформіну дозволяє знизити рівень глюкози у крові на 20 % та зменшити HbA1c на 1,5 %. Лікування метформіном також суттєво зменшує ризик розвитку макросудинних ускладнень, таких як смерть, пов’язана з діабетом, а також від інших причин і діабетичних ускладнень. Це єдиний препарат, який продемонстрував зниження смертності від інфаркту міокарда на 39 % та від інсульту на 41 %. Причому, за даними посттрайлового моніторингу, ефективність метформіну не зменшувалася протягом 24 років після завершення випробувань [56]. Через це метформін увійшов до переліку основних життєво важливих лікарських засобів, рекомендованих ВООЗ.
Ключовий механізм дії метформіну полягає у зменшенні глюкози, яка виробляється печінкою, що веде до зниження рівня глікемії. Він також підвищує кількість та афінність інсулінових рецепторів, активує транспортери глюкози та сприяє їх транспортуванню на клітинну мембрану. Це збільшує поглинання глюкози печінкою, м’язами та жировими клітинами, а також стимулює синтез глікогену в печінці. Метформін сповільнює всмоктування вуглеводів у шлунково-кишковому тракті, що знижує постпрандіальну глікемію. Крім того, препарат має анорексигенний ефект через вплив на метаболізм ГПП-1, який регулює харчову поведінку [54, 57].
Метформін активує АМФ-кіназу, що відіграє ключову роль у перенесенні глюкози через мембрану за допомогою GLUT4 та окисненні вільних жирних кислот, що сприяє обмеженню калорійності харчування і уповільнює біологічне старіння. Препарат також знижує рівень вільних жирних кислот, тригліцеридів, загального холестерину та атерогенних ліпопротеїнів, а також перешкоджає проникненню ліпідів в атероматозні бляшки. Він позитивно впливає на ендотеліальну функцію, діастолічну функцію серця, зменшує глікацію, окиснювальний стрес і агрегацію тромбоцитів, а також уповільнює диференціацію моноцитів у макрофаги, поліпшуючи релаксацію судин і чинячи гіпотензивний ефект [53, 54, 58]. Тривале використання метформіну пов’язане зі зниженим ризиком інсульту та полегшеним його перебігом [59].
Окрім серцево-судинних переваг, зростає кількість доказів, що свідчать про корисність метформіну при низці інших захворювань, зокрема при раку, когнітивних порушеннях і деменції. Крім того, препарат продемонстрував свою ефективність у лікуванні таких станів, як синдром полікістозних яєчників, остеопороз, пародонтит, запальні захворювання кишечника, неалкогольна жирова хвороба печінки, COVID-19, а також він має потенціал як засіб проти старіння загалом [57].
Метформін розглядається як перспективний геропротектор завдяки своїй здатності впливати на обмін речовин та клітинні процеси, пов’язані з віковими захворюваннями. Останнє дослідження, опубліковане в журналі Cell, підтверджує, що метформін уповільнює молекулярні механізми старіння та поліпшує стан тканин і органів. У дослідженні на макаках-крабоїдах довготривале введення метформіну (20 мг/кг на добу протягом 3,3 року, що відповідає 10 рокам у людей) призвело до уповільнення молекулярних годинників старіння. Наприклад, у мозку (лобова доля) вік ДНК-метилювання зменшився приблизно на 6 років, у легенях та нирках — 5 років, у печінці — 4 роки, а у шкірі — на 3 роки. Також метформін уповільнив транскриптомне старіння в різних тканинах, зокрема у мозку, де спостерігалося поліпшення стану нейронів, мікроглії, астроцитів та олігодендроцитів [60].
Геропротективна дія метформіну відбувається насамперед через активацію AMPK, що нормалізує енергетичний обмін клітин, знижує оксидативний стрес і поліпшує функцію мітохондрій. Він також активує шлях Nrf2, який регулює експресію антиоксидантних генів, таких як HO-1, NQO-1 та SOD3, що допомагає знизити рівень реактивних форм кисню (ROS). Крім того, метформін відновлює рівень H3K9me3 — маркера старіння, що сприяє уповільненню клітинного старіння [61].
У дослідженні, опублікованому в журналі Aging Cell, проведено ранжування схвалених FDA препаратів як потенційних геротерапевтичних засобів на основі їхньої ефективності у боротьбі зі старінням. Метформін — один із найбільш досліджених препаратів — займає провідну позицію серед геротерапевтичних засобів, отримавши високу оцінку 11 з 12, що підкреслює його значний потенціал у цій галузі [62]. Цьогорічне інноваційне дослідження з використанням платформи AgeXtend на основі штучного інтелекту також підтвердило геропротекторний потенціал метформіну [63].
Зараз триває понад 20 клінічних випробувань, спрямованих на вивчення геропротекторних властивостей метформіну [64]. Одним із найамбітніших проєктів є Targeting Aging with Metformin (TAME), що планує охопити понад 3000 осіб віком 65–79 років для оцінки впливу метформіну на уповільнення старіння [65].
Метформін демонструє багатогранну дію, впливаючи на ключові механізми розвитку церебральних ускладнень при ЦД. Він ефективно контролює хронічну гіперглікемію, знижує інсулінорезистентність, гіперінсулінемію та дефіцит інкретинів. Крім того, препарат позитивно впливає на ліпідний обмін, зменшує запалення судинної стінки, поліпшує ендотеліальну функцію та знижує оксидативний стрес. Метформін також запобігає порушенням реологічних властивостей крові та гострим порушенням мозкового кровообігу, маючи при цьому низький ризик виникнення гіпоглікемічних реакцій. Його протизапальна, антиоксидантна та проавтофагічна дія робить його ефективним у профілактиці нейродегенеративних ускладнень та інших неврологічних розладів [57, 58, 66]. Ці унікальні властивості метформіну зумовили зростання інтересу до його використання в лікуванні захворювань, пов’язаних із когнітивними порушеннями. Науковці активно досліджують його потенціал у поліпшенні когнітивних функцій та запобіганні нейродегенеративним процесам.
Дослідження останніх років підтверджують, що метформін має нейроспецифічні властивості, які сприяють уповільненню прогресування церебральних ускладнень при діабеті та забезпечують ноотропний ефект [67]. Препарат здатний проникати через гематоенцефалічний бар’єр і безпосередньо впливати на центральну нервову систему [68].
Нейропротективна дія метформіну зумовлена активацією AMPK-залежних шляхів та інгібуванням сигналізації mTOR у нервових клітинах. Це стимулює ангіогенез, нейрогенез, індукцію автофагії та зменшення нейрозапалення [67]. На тлі застосування препарату спостерігається збільшення нейротрофічних факторів у мозку, підвищення нейрогенезу в гіпокампі, зменшення нейронального апоптозу та оксидативного стресу. Крім того, метформін відновлює когнітивні функції шляхом пригнічення поділу мітохондрій та зниження оксидативного стресу [69].
Метформін ефективно пригнічує утворення β-амілоїду, знижує фосфорилювання та рівень тау-білків, що запобігає розвитку та прогресуванню ХА [57, 58, 68]. Дослідження показали, що препарат зменшує експресію та активність β-секретази BACE1, яка бере участь в утворенні β-амілоїду, що призводить до зниження його продукції [70]. Ці механізми сприяють поліпшенню просторової пам’яті та зменшенню втрати нейронів у експериментальних моделях.
У нещодавньому дослідженні щури з експериментальною ХА, які отримували метформін, продемонстрували поліпшення пам’яті, зниження рівня окиснювального стресу та зменшення відкладення β-амілоїду. Крім того, препарат поліпшив нейромедіаторні функції та відновив інсулінову сигналізацію, що підкреслює його потенціал у лікуванні ХА [71].
Важливою властивістю метформіну є його здатність знижувати активність ацетилхолінестерази, яка відповідає за розпад ацетилхоліну — нейромедіатора, що відіграє ключову роль у процесах навчання та пам’яті [72]. Крім того, препарат поліпшує відновлення нер–вових клітин після інсульту, пригнічуючи утворення пероксинітриту [73].
Ці дані підкреслюють значний потенціал метформіну як засобу для лікування та профілактики нейродегенеративних захворювань і когнітивних порушень, що підтверджується результатами клінічних досліджень.
Всебічний аналіз даних експериментальних і клінічних досліджень дозволив W. Cui et al. (2024) [74] запропонувати детальний огляд впливу метформіну на когнітивні функції та нейродегенеративні процеси (рис. 2).
Автори підкреслюють, що метформін демонструє значний потенціал як антидементний засіб, впливаючи як на поведінкові, так і на молекулярні аспекти функціонування мозку. На поведінковому рівні метформін сприяє поліпшенню просторової референсної пам’яті, що дозволяє краще орієнтуватися в просторі та запам’ятовувати локації об’єктів. Крім того, препарат підвищує виконавчу пам’ять, що важливо для планування та виконання складних завдань. Також відмічається збільшення локомоторної активності та поліпшення моторної координації, що свідчить про позитивний вплив на загальну рухову функцію та якість життя.
На молекулярному рівні метформін проявляє численні захисні ефекти. Він знижує рівень β-амілоїду, що є ключовим фактором у профілактиці ХА. Препарат також пригнічує апоптоз нейронів, зберігаючи цілісність нейронної мережі. Важливим механізмом є зниження інсулінорезистентності нейронів, що сприяє нормалізації метаболічних процесів у мозку. Крім того, метформін пригнічує активність ацетилхолінестерази, підвищуючи рівень ацетилхоліну, який відіграє ключову роль у процесах пам’яті та навчання. Метформін також зменшує оксидантний стрес і нейрозапалення, що захищає нейрони від пошкоджень і запальних процесів, які часто супроводжують нейродегенеративні захворювання. Препарат поліпшує мітохондріальну функцію, оптимізуючи енергетичний обмін у клітинах, що важливо для підтримання нейронної активності. Крім того, він нормалізує процеси автофагії, сприяючи видаленню пошкоджених клітинних компонентів.
Також варто додати, що препарат поліпшує ендотеліальну функцію, ліпідний обмін, що зменшує ризик атеротромботичних ускладнень і забезпечує краще кровопостачання мозку. Ці дані підкреслюють багатогранний вплив метформіну на когнітивні функції та нейродегенеративні процеси, що робить його перспективним засобом для профілактики та лікування деменції.
Останні клінічні дослідження підтверджують, що метформін має значний потенціал у зниженні ризику розвитку деменції. Цей ефект особливо виражений у пацієнтів із ЦД 2-го типу, проте дослідження також вказують на його корисність у осіб без діабету.
У пацієнтів із ЦД 2-го типу метформін демонструє значний захисний ефект щодо когнітивних порушень та деменції [25, 75–77]. Згідно з дослідженням M. Sun et al. (2024), тривале застосування метформіну асоціюється зі зниженням ризику деменції, причому цей ефект є дозозалежним. Пацієнти, які приймали високі дози препарату (≥ 1 добова доза на день), мали найбільш виражений захисний ефект зі скоригованим співвідношенням ризиків 0,34 (95% ДІ: 0,33–0,36) [75].
Метааналіз, який охопив понад 3 мільйони учасників, підтвердив, що захисний ефект метформіну щодо деменції стає очевидним приблизно через 3 роки лікування та зберігається протягом 8 років спостереження. Цей ефект був особливо виражений у західних популяціях, тоді як у східних країнах він був менш помітним [76].
Дослідження S. Zimmerman et al. (2023) підкреслило важливість тривалого застосування метформіну. У когорті з 12 220 пацієнтів, які припинили лікування метформіном, спостерігалося збільшення частоти випадків деменції незалежно від змін рівня HbA1c або застосування інсуліну. Це свідчить про те, що припинення терапії метформіном може суттєво підвищити ризик нейродегенеративних захворювань [77].
У продовженому обсерваційному дослідженні за участю 1393 пацієнтів було встановлено, що метформін особливо ефективний у зниженні ризику деменції у пацієнтів із ЦД 2-го типу, які не мають нейропсихі–атричних розладів і не вживають нестероїдних протизапальних засобів [78].
Проспективне дослідження The Sydney Memory and Ageing Study продемонструвало, що літні люди з діабетом, які приймали метформін, мали повільніше зниження когнітивних функцій і у 5,29 раза нижчий ризик розвитку деменції порівняно з тими, хто його не використовував [79]. Аналогічні тенденції були продемонстровані в масштабному обсерваційному дослідженні з даними понад 67 тисяч жителів Тайваню, у якому прийом метформіну асоціювався зі зниженням ризику розвитку деменції [80].
Існує кілька інтервенційних досліджень, які оцінюють вплив метформіну на когнітивні функції та деменцію в осіб без діабету. У плацебо-контрольованому перехресному дослідженні за участю осіб без діабету з легкими когнітивними порушеннями або легкою деменцією щоденна доза 2000 мг метформіну протягом 8 тижнів була пов’язана зі сприятливим впливом на виконавчу функцію, навчання, пам’ять та увагу [81].
У менделівському рандомізованому дослідженні, у якому взяли участь 527 138 європейців середнього віку, з яких 71 880 мали ХА, було показано, що застосування метформіну може призвести до зниження ризику ХА серед населення незалежно від наявності цукрового діабету. Основними механізмами захисного ефекту визначено вплив на мітохондріальний комплекс 1 та ген NDUFA2, які сприяють зниженню ризику деменції [82].
Метформін демонструє значний потенціал у профілактиці нейродегенеративних захворювань, зокрема ХА. Цьогорічний мережевий метааналіз, який охопив 26 рандомізованих контрольованих досліджень за участю 7361 особи, показав, що препарат є найефективнішим у зниженні рівня β-амілоїду [83]. У масштабному дослідженні, проведеному у США, при застосуванні метформіну в осіб з ЦД похилого віку (до аналізу включено дані понад 6 тисяч пацієнтів) ризик розвитку нейродегенеративних захворювань, у тому числі ХА, хвороби Хантінгтона, Паркінсона та слабоумства, через 2 роки знизився на 29 %, у період від 2 до 4 років — на 41 %, при застосуванні понад 4 роки — на 84 % порівняно з особами, які не отримували препарат [84].
Дослідження, опубліковане у Journal of Alzheimer’s Disease (2025), проаналізувало вплив різних ліків на когнітивне зниження у 15 428 пацієнтів із ХА. Використовуючи кластерний аналіз, вчені виявили, що метформін мав найсильніший позитивний вплив на когнітивні функції, збільшуючи ймовірність потрапляння до кращого когнітивного кластера у 2,08 раза (95% ДІ: 1,35–3,33) [85].
Таким чином, метформін демонструє значний захисний ефект щодо розвитку деменції у пацієнтів із ЦД 2-го типу, особливо при тривалому та регулярному застосуванні. Його дозозалежний вплив та здатність знижувати амілоїдне навантаження роблять його перспективним засобом для профілактики нейродегенеративних захворювань.
Багато дослідників наголошує на перевагах метформіну у підтримці когнітивних функцій порівняно з іншими гіпоглікемізувальними засобами, зокрема препаратами сульфонілсечовини та інсуліном (особливо при застосуванні базально-болюсних режимів). На думку науковців, це пов’язано з меншою імовірністю гіпоглікемічних епізодів, які можуть погіршувати когнітивні здібності [50, 86].
Останніми роками з’являється все більше доказів щодо позитивного впливу на мозковий метаболізм та когнітивні функції інших груп антидіабетичних препаратів, таких як агоністи рецепторів глюкагоноподібного пептиду-1, інгібітори дипептилпептидази-4 та інгібітори натрій-глюкозного котранспортера 2-го типу. Перспективним є їх комбіноване застосування з метформіном, що забезпечує синергічний ефект у профілактиці когнітивних порушень. Це досягається шляхом поліпшення інсулінової чутливості, зменшення окиснювального стресу та запалення, оптимізації метаболізму глюкози в мозку, а також зниження накопичення амілоїду та тау-білків. Такі механізми дії роблять метформін ключовим елементом у стратегіях збереження когнітивного здоров’я [53, 87, 88].
У стандартах ADA 2025 року зазначається, що в аспекті когнітивних порушень, особливо в осіб старшого віку, важливого значення набуває підвищення прихильності до лікування, зокрема шляхом спрощення схем лікування, зниження кратності призначення лікувальних засобів, оскільки пацієнти цієї категорії нерідко просто забувають про необхідність чергового прийому препарату [20]. Тому оптимальним гіпоглікемізувальним препаратом для запобігання когнітивним порушенням і їх лікування у хворих на ЦД 2-го типу є метформін у пролонгованій формі з модифікованим уповільненим вивільненням, який призначається лише один раз на добу. Окрім забезпечення прихильності пацієнтів до лікування, цей препарат має кращу переносимість, зокрема низьку частоту шлунково-кишкових розладів [89].
Сучасне медикаментозне лікування помірних когнітивних порушень та деменції при ЦД базується на індивідуалізованому підході, з урахуванням типу деменції, стадії захворювання та коморбідних станів. Основні групи препаратів включають інгібітори холінестерази (донепезил, ривастигмін, галантамін), які поліпшують когнітивні функції при ХА, деменції з тільцями Леві та змішаних формах, але можуть викликати побічні ефекти (нудота, блювання). Антагоністи NMDA-рецепторів (мемантин) використовуються для лікування помірної та тяжкої стадій хвороби Альцгеймера, зменшуючи когнітивне зниження та поведінкові порушення, часто в комбінації з інгібіторами холінестерази [90].
Моноклональні антитіла (леканемаб, адуканумаб) призначаються на ранніх стадіях хвороби Альцгеймера з підтвердженим накопиченням амілоїду. Вони знижують рівень амілоїду та уповільнюють когнітивне зниження, але мають ризик побічних ефектів (набряк мозку, мікрокрововиливи). Чи принесуть ці препарати чисту користь людям похилого віку з діабетом, ще належить визначити [20, 91].
Для лікування судинної деменції при ЦД застосовуються підходи, спрямовані на контроль артеріального тиску, ліпідного обміну та профілактику інсульту [59, 92].
Таким чином, комплексний підхід, що включає ранню діагностику, ефективний контроль глікемії, модифікацію факторів ризику та застосування сучасних лікарських засобів, є ключовим для зниження ризику розвитку деменції та підтримання когнітивного здоров’я у пацієнтів із ЦД.
Конфлікт інтересів. Не заявлений.
Внесок авторів. Пашковська Н.В. — концепція, результати огляду, написання тексту, рецензування та редагування; Пашковський В.М. — результати огляду, рецензування та редагування.
Отримано/Received 09.02.2025
Рецензовано/Revised 12.03.2025
Прийнято до друку/Accepted 20.03.2025
/148.jpg)

/144.jpg)