Журнал "Гастроэнтерология" Том 59, №2, 2025
Вернуться к номеру
Внутрішньоклітинний кальцій у підшлунковій залозі. Частина 1. Роль у фізіологічній регуляції
Авторы: Чуклін С.М. (1), Чуклін С.С. (1), Бариляк Р.В. (2)
(1) - Медичний центр Святої Параскеви, м. Львів, Україна
(2) - Львівська обласна клінічна лікарня, м. Львів, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
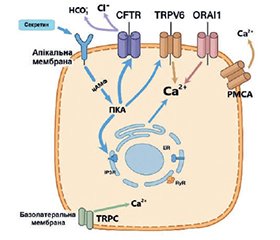
Актуальність. Підшлункова залоза є унікальним органом, що поєднує екзокринну та ендокринну функції, а внутрішньоклітинний Ca2+ є центральним вторинним месенджером, який координує ці процеси. У нормальних фізіологічних умовах Ca2+ регулює секрецію травних ферментів ацинарними клітинами, секрецію бікарбонату протоковими клітинами, а також активність зірчастих і імунних клітин, що підтримують тканинний гомеостаз. Проте кальцієва сигналізація в клітинах підшлункової залози ще залишається недостатньо дослідженою, особливо у контексті її складної міжклітинної взаємодії. Уточнення цих механізмів є важливим для глибшого розуміння регуляції секреції, енергозабезпечення клітин, антиоксидантного захисту та адаптації до фізіологічного стресу. Мета: систематизація сучасних даних щодо механізмів внутрішньоклітинної кальцієвої сигналізації в клітинах ПЗ за фізіологічних умов, а також аналіз ролі Ca2+ у функціонуванні ацинарних, протокових, зірчастих та імунних клітин як ключового регулятора секреції, метаболізму та міжклітинної взаємодії. Матеріали та методи. Аналізувалися сучасні наукові публікації в базах PubMed, Scopus та Google Scholar, що стосуються кальцієвої сигналізації в ацинарних, протокових, зірчастих та імунних клітинах підшлункової залози. Результати. У нормі кальцієві сигнали в ацинарних клітинах ініціюються через активацію рецепторів до ацетилхоліну і холецистокініну, що запускає вивільнення Ca2+ з ендоплазматичного ретикулуму через IP3R і RyR. Ці сигнали мають характер осциляцій і забезпечують контрольований екзоцитоз секреторних гранул. Мітохондрії виконують роль буфера, що утилізує надлишковий Ca2+, одночасно стимулюючи синтез АТФ, необхідного для кальцієвих насосів. Протокові клітини за допомогою кальцієвих каналів (TRPV6, Orai1) регулюють транспорт іонів і секрецію бікарбонату, що є ключовим для підтримання pH у тонкому кишечнику. Зірчасті клітини реагують на кальцієві сигнали зміною активності та синтезом компонентів позаклітинного матриксу, контролюючи тканинну структуру. Імунні клітини за допомогою P2Y-рецепторів і кальцієвих каналів продукують цитокіни та реагують на метаболічні подразники, зберігаючи імунний контроль у тканинах залози. Результати свідчать про високий ступінь інтеграції кальцієвих сигналів між органелами та клітинами, що забезпечує точну координацію функцій підшлункової залози. Висновки. Внутрішньоклітинний кальцій є універсальним регулятором функціональної активності клітин підшлункової залози. Скоординована взаємодія кальцієвих каналів, насосів, рецепторів та регуляторних білків забезпечує фізіологічну секрецію, гомеостаз тканин, адаптацію до навантаження та міжклітинну взаємодію. Розуміння цих процесів створює базу для подальших досліджень у галузі панкреатології та потенційної розробки нових терапевтичних стратегій.
Background. The pancreas is a unique organ combining both exocrine and endocrine functions, with intracellular Ca2+ acting as a central secondary messenger that coordinates these processes. Under physiological conditions, Ca2+ regulates digestive enzyme secretion by acinar cells, bicarbonate secretion by ductal cells, as well as the activity of stellate and immune cells that support tissue homeostasis. However, calcium signaling in pancreatic cells remains insufficiently explored, particularly in the context of its complex intercellular interactions. Clarifying these mechanisms is essential for a deeper understanding of secretory regulation, cellular energy supply, antioxidant protection, and adaptation to physiological stress. The purpose was to provide a comprehensive overview of current insights into the mechanisms of intracellular calcium signaling in pancreatic cells under physiological conditions, with a particular focus on the regulatory role of Ca2+ in secretion, metabolism, and intercellular communication across acinar, ductal, stellate, and immune cell populations. Materials and methods. Recent scientific publications from PubMed, Scopus, and Google Scholar on calcium signaling in pancreatic acinar, ductal, stellate, and immune cells were analyzed. Results. In normal physiology, calcium signals in acinar cells are triggered by activation of acetylcholine and cholecystokinin receptors, initiating Ca2+ release from the endoplasmic reticulum via IP3R and RyR. These signals present as oscillations that ensure controlled exocytosis of secretory granules. Mitochondria act as buffers, absorbing excess Ca2+ while simultaneously stimulating ATP synthesis required for calcium pumps. Ductal cells, through calcium channels (TRPV6, Orai1), regulate ion transport and bicarbonate secretion, crucial for maintaining intestinal pH. Stellate cells respond to calcium signals by modulating activity and synthesizing extracellular matrix components, preserving tissue architecture. Immune cells, via P2Y receptors and calcium channels, produce cytokines and respond to metabolic stimuli, maintaining immune surveillance within the pancreas. These findings highlight a high level of integration between organelles and cells, ensuring precise coordination of pancreatic functions. Conclusions. Intracellular calcium is a universal regulator of pancreatic cell activity. The coordinated interplay between calcium channels, pumps, receptors, and regulatory proteins underlies physiological secretion, tissue homeostasis, adaptation to load, and intercellular communication. Understanding these processes provides a foundation for future research in pancreatology and the development of new therapeutic strategies.
внутрішньоклітинний кальцій; кальцієва сигналізація; підшлункова залоза; ацинарні клітини; протокові клітини
intracellular calcium; calcium signaling; pancreas; acinar cells; ductal cells
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Petersen OH, Gerasimenko JV, Gerasimenko OV, Gryshchenko O, Peng S. The roles of calcium and ATP in the physiology and pathology of the exocrine pancreas. Physiol Rev. 2021 Oct 1;101(4):1691-1744. doi: 10.1152/physrev.00003.2021. Epub 2021 May 5. PMID: 33949875.
- Petersen OH. Watching Living Cells in Action in the Exocrine Pancreas: The Palade Prize Lecture. Function (Oxf). 2022 Dec 8;4(1):zqac061. doi: 10.1093/function/zqac061. eCollection 2023. PMID: 36606242.
- Marolt U, Paradiž Leitgeb E, Pohorec V, et al. Calcium imaging in intact mouse acinar cells in acute pancreas tissue slices. PLoS One. 2022 Jun 3;17(6):e0268644. doi: 10.1371/journal.pone.0268644. eCollection 2022. PMID: 35657915.
- Hegyi P, Rakonczay Z Jr. The role of pancreatic ducts in the pathogenesis of acute pancreatitis. Pancreatology. 2015 Jul;15(4 Suppl):S13-7. doi: 10.1016/j.pan.2015.03.010. Epub 2015 Apr 7. PMID: 25921231.
- Phadke MY, Sellers ZM. Current clinical opinion on CFTR dysfunction and patient risk of pancreatitis: diagnostic and therapeutic considerations. Expert Rev Gastroenterol Hepatol. 2022 Jun;16(6):499-509. doi: 10.1080/17474124.2022.2084072. Epub 2022 Jun 2. PMID: 35623009.
- Leir SH, Tkachenko S, Paranjapye A, et al. Stellate cells are in utero markers of pancreatic disease in cystic fibrosis. Mol Med. 2024 Aug 7;30(1):115. doi: 10.1186/s10020-024-00871-2. PMID: 39112965.
- Aney KJ, Jeong WJ, Vallejo AF, et al. Novel Approach for Pancreas Transcriptomics Reveals the Cellular Landscape in Homeostasis and Acute Pancreatitis. Gastroenterology. 2024 Jun;166(6):1100-1113. doi: 10.1053/j.gastro.2024.01.043. Epub 2024 Feb 6. PMID: 38325760.
- Gryshchenko O, Gerasimenko JV, Petersen OH, Gerasimenko OV. Calcium Signaling in Pancreatic Immune Cells In situ. Function (Oxf). 2020 Oct 13;2(1):zqaa026. doi: 10.1093/function/zqaa026. eCollection 2021. PMID: 35330972.
- Hopson P, Smadi Y, Mehta V, Patel S, Mehta D, Horvath K. Assessment of exocrine pancreatic function in children and adolescents with direct and indirect testing. Front Pediatr. 2022 Nov 14;10:908542. doi: 10.3389/fped.2022.908542. eCollection 2022. PMID: 36452348.
- Smith HA, Thillaiappan NB, Rossi AM. IP(3) receptors: An “elementary” journey from structure to signals. Cell Calcium. 2023 Jul;113:102761. doi: 10.1016/j.ceca.2023.102761. Epub 2023 May 23. PMID: 37271052.
- Sluga N, Postić S, Sarikas S, Huang YC, Stožer A, Slak Rupnik M. Dual Mode of Action of Acetylcholine on Cytosolic Calcium Oscillations in Pancreatic Beta and Acinar Cells іn Situ. Cells. 2021 Jun 23;10(7):1580. doi: 10.3390/cells10071580. PMID: 34201461.
- Williams JA. Cholecystokinin (CCK) Regulation of Pancreatic Acinar Cells: Physiological Actions and Signal Transduction Mechanisms. Compr Physiol. 2019 Mar 14;9(2):535-564. doi: 10.1002/cphy.c180014. PMID: 30873601.
- Ubeysinghe S, Wijayaratna D, Kankanamge D, Karunarath–ne A. Molecular regulation of PLCβ signaling. Methods Enzymol. 2023;682:17-52. doi: 10.1016/bs.mie.2023.01.001. Epub 2023 Feb 22. PMID: 36948701.
- Takano T, Yule DI. Neuronal and hormonal control of Ca2+ signalling in exocrine glands: insight from in vivo studies. J Physiol. 2024 Jul;602(14):3341-3350. doi: 10.1113/JP285461. Epub 2024 Jun 7. PMID: 38847391.
- Han Y, Shewan AM, Thorn P. HCO3- Transport through Anoctamin/Transmembrane Protein ANO1/TMEM16A in Pancreatic Acinar Cells Regulates Luminal pH. J Biol Chem. 2016 Sep 23;291(39):20345-52. doi: 10.1074/jbc.M116.750224. Epub 2016 Aug 10. PMID: 27510033.
- Gerasimenko JV, Gerasimenko OV, Petersen OH. The role of Ca2+ in the pathophysiology of pancreatitis. J Physiol. 2014 Jan 15;592(2):269-280. doi: 10.1113/jphysiol.2013.261784. Epub 2013 Jul 29. PMID: 23897234.
- Tsvilovskyy V, Ottenheijm R, Kriebs U, et al. OCaR1 endows exocytic vesicles with autoregulatory competence by preventing uncontrolled Ca2+ release, exocytosis, and pancreatic tissue damage. J Clin Invest. 2024 Apr 1;134(7):e169428. doi: 10.1172/JCI169428. PMID: 38557489.
- Romac JM, Shahid RA, Swain SM, Vigna SR, Liddle RA. Piezo1 is a mechanically activated ion channel and mediates pressure induced pancreatitis. Nat Commun. 2018 Apr 30;9(1):1715. doi: 10.1038/s41467-018-04194-9. PMID: 29712913.
- Scheuer R, Philipp SE, Becker A, et al. Protein Kinase CK2 Controls CaV2.1-Dependent Calcium Currents and Insulin Release in Pancreatic β-Cells. Int J Mol Sci. 2020 Jun 30;21(13):4668. doi: 10.3390/ijms21134668. PMID: 32630015.
- Barghouth M, Ye Y, Karagiannopoulos A, et al. The T-type calcium channel CaV3.2 regulates insulin secretion in the pancreatic β-cell. Cell Calcium. 2022 Dec;108:102669. doi: 10.1016/j.ceca.2022.102669. Epub 2022 Oct 31. PMID: 36347081.
- Nakagawa M, Takahashi K, Nishizawa Y, Ohta T. Involvement of interaction of Cav3.2 and nociceptive TRPA1 in pathological pain transmission. Biomed Res. 2024;45(1):45-55. doi: 10.2220/biomedres.45.45. PMID: 38325845.
- Ono N, Horikoshi J, Izawa T, et al. L-arginine-induced pancreatitis aggravated by inhibiting Na+/Ca2+ exchanger 1. J Vet Med Sci. 2023 Jun 13;85(6):657-666. doi: 10.1292/jvms.22-0569. Epub 2023 May 23. PMID: 37100607.
- Huai J, Shao Y, Sun X, Jin Y, Wu J, Huang Z. Melatonin ameliorates acute necrotizing pancreatitis by the regulation of cytosolic Ca2+ homeostasis. Pancreatology. 2012 May-Jun;12(3):257-63. doi: 10.1016/j.pan.2012.02.004. Epub 2012 Feb 15. PMID: 22687382.
- Liao QS, Du Q, Lou J, Xu JY, Xie R. Roles of Na+/Ca2+ exchanger 1 in digestive system physiology and pathophysiology. World J Gastroenterol. 2019 Jan 21;25(3):287-299. doi: 10.3748/wjg.v25.i3.287. PMID: 30686898.
- Courjaret RJ, Wagner LE, Ammouri RR, Yule DI, Machaca K. Ca2+ tunneling architecture and function are important for secretion. J Cell Biol. 2025 Jan 6;224(1):e202402107. doi: 10.1083/jcb.202402107. Epub 2024 Nov 5. PMID: 39499286.
- Barak P, Parekh AB. Signaling through Ca2+ Microdomains from Store-Operated CRAC Channels. Cold Spring Harb Perspect Biol. 2020 Jul 1;12(7):a035097. doi: 10.1101/cshperspect.a035097. PMID: 31358516.
- Sallinger M, Grabmayr H, Humer C, Bonhenry D, Roma–nin C, Schindl R, Derler I. Activation mechanisms and structural dynamics of STIM proteins. J Physiol. 2024 Apr;602(8):1475-1507. doi: 10.1113/JP283828. Epub 2023 Feb 2. PMID: 36651592.
- Waldron RT, Chen Y, Pham H, et al. The Orai Ca2+ channel inhibitor CM4620 targets both parenchymal and immune cells to reduce inflammation in experimental acute pancreatitis. J Physiol. 2019 Jun;597(12):3085-3105. doi: 10.1113/JP277856. Epub 2019 May 22. PMID: 31050811.
- Wang H, Cheng X, Tian J, Xiao Y, Tian T, Xu F, Hong X, Zhu MX. TRPC channels: Structure, function, regulation and recent advances in small molecular probes. Pharmacol Ther. 2020 May;209:107497. doi: 10.1016/j.pharmthera.2020.107497. Epub 2020 Jan 28. PMID: 32004513.
- Son A, Park S, Shin DM, Muallem S. Orai1 and STIM1 in ER/PM junctions: roles in pancreatic cell function and dysfunction. Am J Physiol Cell Physiol. 2016 Mar 15;310(6):C414-22. doi: 10.1152/ajpcell.00349.2015. Epub 2016 Jan 6. PMID: 26739495.
- Du W, Liu G, Shi N, et al. A microRNA checkpoint for Ca2+ signaling and overload in acute pancreatitis. Mol Ther. 2022 Apr 6;30(4):1754-1774. doi: 10.1016/j.ymthe.2022.01.033. Epub 2022 Jan 22. PMID: 35077860.
- Lopez JJ, Jardin I, Sanchez-Collado J, Salido GM, Smani T, Rosado JA. TRPC Channels in the SOCE Scenario. Cells. 2020 Jan 5;9(1):126. doi: 10.3390/cells9010126. PMID: 31948094.
- Englisch CN, Kirstein E, Diebolt CM, Wagner M, Tscher–nig T. Distribution of TRPC3 and TRPC6 in the human exocrine and endocrine pancreas. Pathol Res Pract. 2024 Aug;260:155403. doi: 10.1016/j.prp.2024.155403. Epub 2024 Jun 10. PMID: 38870712.
- Son A, Ahuja M, Schwartz DM, et al. Ca2+ Influx Channel Inhibitor SARAF Protects Mice From Acute Pancreatitis. Gastroenterology. 2019 Dec;157(6):1660-1672.e2. doi: 10.1053/j.gastro.2019.08.042. Epub 2019 Sep 4. PMID: 31493399.
- Shalygin A, Kolesnikov D, Glushankova L, et al. Role of STIM2 and Orai proteins in regulating TRPC1 channel activity upon calcium store depletion. Cell Calcium. 2021 Jun 8;97:102432. doi: 10.1016/j.ceca.2021.102432. Online ahead of print. PMID: 34157631.
- Manhas N. Computational Model of Complex Calcium Dynamics: Store Operated Ca2+ Channels and Mitochondrial Associated Membranes in Pancreatic Acinar Cells. Cell Biochem Biophys. 2025 Mar;83(1):519-535. doi: 10.1007/s12013-024-01484-6. Epub 2024 Sep 13. PMID: 39266873.
- Petersen OH, Courjaret R, Machaca K. Ca2+ tunnelling through the ER lumen as a mechanism for delivering Ca2+ entering via store-operated Ca2+ channels to specific target sites. J Physiol. 2017 May 15;595(10):2999-3014. doi: 10.1113/JP272772. Epub 2017 Mar 16. PMID: 28181236.
- Kodakandla G, Akimzhanov AM, Boehning D. Regulatory mechanisms controlling store-operated calcium entry. Front Physiol. 2023 Dec 19;14:1330259. doi: 10.3389/fphys.2023.1330259. eCollection 2023. PMID: 38169682.
- Wang H, Gao J, Wen L, et al. Ion channels in acinar cells in acute pancreatitis: crosstalk of calcium, iron, and copper signals. Front Immunol. 2024 Nov 13;15:1444272. doi: 10.3389/fimmu.2024.1444272. eCollection 2024. PMID: 39606246.
- Rubaiy HN. ORAI Calcium Channels: Regulation, Function, Pharmacology, and Therapeutic Targets. Pharmaceuticals (Basel). 2023 Jan 22;16(2):162. doi: 10.3390/ph16020162. PMID: 37259313.
- Gleitze S, Ramírez OA, Vega-Vásquez I, et al. Calcium release via IP(3)R/RyR channels contributes to the nuclear and mitochondrial Ca(2+) signals elicited by neuronal stimulation. Biochem Biophys Res Commun. 2025 Feb 9;754:151445. doi: 10.1016/j.bbrc.2025.151445. Online ahead of print. PMID: 40022811.
- Waldron RT, Lugea A, Pandol SJ. Brake adjustment: Ca2+ entry pathway provides a novel target for acute pancreatitis therapy. Ann Transl Med. 2019 Dec;7(Suppl 8):S284. doi: 10.21037/atm.2019.11.119. PMID: 32016003.
- Chemaly ER, Troncone L, Lebeche D. SERCA control of cell death and survival. Cell Calcium. 2018 Jan;69:46-61. doi: 10.1016/j.ceca.2017.07.001. Epub 2017 Jul 12. PMID: 28747251.
- Zheng S, Zhou L, Ma G, et al. Calcium store refilling and STIM activation in STIM- and Orai-deficient cell lines. Pflugers Arch. 2018 Oct;470(10):1555-1567. doi: 10.1007/s00424-018-2165-5. Epub 2018 Jun 22. PMID: 29934936.
- Lunz V, Romanin C, Frischauf I. STIM1 activation of Orai1. Cell Calcium. 2019 Jan;77:29-38. doi: 10.1016/j.ceca.2018.11.009. Epub 2018 Nov 30. PMID: 30530091.
- Biczo G, Vegh ET, Shalbueva N, et al. Mitochondrial Dysfunction, Through Impaired Autophagy, Leads to Endoplasmic Reticulum Stress, Deregulated Lipid Metabolism, and Pancreatitis in Animal Models. Gastroenterology. 2018 Feb;154(3):689-703. doi: 10.1053/j.gastro.2017.10.012. Epub 2017 Oct 23. PMID: 29074451.
- Zhou S, Liu S, Jiang A, Li Z, Duan C, Li B. New insights into the stromal interaction molecule 2 function and its impact on the immunomodulation of tumor microenvironment. Cell Biosci. 2024 Sep 13;14(1):119. doi: 10.1186/s13578-024-01292-8. PMID: 39272139.
- Yu F, Machaca K. The STIM1 Phosphorylation Saga. Cell Calcium. 2022 May;103:102551. doi: 10.1016/j.ceca.2022.102551. Epub 2022 Feb 16. PMID: 35217333.
- Berna-Erro A, Sanchez-Collado J, Nieto-Felipe J, Macias-Diaz A, Redondo PC, Smani T, Lopez JJ, Jardin I, Rosado JA. The Ca2+ Sensor STIM in Human Diseases. Biomolecules. 2023 Aug 22;13(9):1284. doi: 10.3390/biom13091284. PMID: 37759684.
- Giorgi C, Marchi S, Pinton P. The machineries, regulation and cellular functions of mitochondrial calcium. Nat Rev Mol Cell Biol. 2018 Nov;19(11):713-730. doi: 10.1038/s41580-018-0052-8. PMID: 30143745.
- Garbincius JF, Elrod JW. Mitochondrial calcium exchange in physiology and disease. Physiol Rev. 2022 Apr 1;102(2):893-992. doi: 10.1152/physrev.00041.2020. Epub 2021 Oct 26. PMID: 34698550.
- Wu W, Shen Q, Zhang R, Qiu Z, Wang Y, Zheng J, Jia Z. The structure of the MICU1-MICU2 complex unveils the regulation of the mitochondrial calcium uniporter. EMBO J. 2020 Oct 1;39(19):e104285. doi: 10.15252/embj.2019104285. Epub 2020 Aug 13. PMID: 32790952.
- Gherardi G, Monticelli H, Rizzuto R, Mammucari C. The Mitochondrial Ca2+ Uptake and the Fine-Tuning of Aerobic Metabolism. Front Physiol. 2020 Oct 7;11:554904. doi: 10.3389/fphys.2020.554904. eCollection 2020. PMID: 33117189.
- Feng S, Wei Q, Hu Q, Huang X, Zhou X, Luo G, Deng M, Lü M. Research Progress on the Relationship Between Acute Pancreatitis and Calcium Overload in Acinar Cells. Dig Dis Sci. 2019 Jan;64(1):25-38. doi: 10.1007/s10620-018-5297-8. Epub 2018 Oct 3. PMID: 30284136.
- Boyman L, Karbowski M, Lederer WJ. Regulation of Mitochondrial ATP Production: Ca2+ Signaling and Quality Control. Trends Mol Med. 2020 Jan;26(1):21-39. doi: 10.1016/j.molmed.2019.10.007. Epub 2019 Nov 22. PMID: 31767352.
- Pathak T, Trebak M. Mitochondrial Ca2+ signaling. Pharmacol Ther. 2018 Dec;192:112-123. doi: 10.1016/j.pharmthera.2018.07.001. Epub 2018 Jul 20. PMID: 30036491.
- Lee SH, Duron HE, Chaudhuri D. Beyond the TCA cycle: new insights into mitochondrial calcium regulation of oxidative phosphorylation. Biochem Soc Trans. 2023 Aug 31;51(4):1661-1673. doi: 10.1042/BST20230012. PMID: 37641565.
- Luongo TS, Lambert JP, Gross P, et al. The mitochondrial Na+/Ca2+ exchanger is essential for Ca2+ homeostasis and viability. Nature. 2017 May 4;545(7652):93-97. doi: 10.1038/nature22082. Epub 2017 Apr 26. PMID: 28445457.
- Garbincius JF, Luongo TS, Jadiya P, et al. Enhanced NCLX-dependent mitochondrial Ca2+ efflux attenuates pathological remodeling in heart failure. J Mol Cell Cardiol. 2022 Jun;167:52-66. doi: 10.1016/j.yjmcc.2022.03.001. Epub 2022 Mar 28. PMID: 35358843.
- Morris VS, Richards EMB, Morris R, Dart C, Helassa N. Structure-Function Diversity of Calcium-Binding Proteins (CaBPs): Key Roles in Cell Signalling and Disease. Cells. 2025 Jan 21;14(3):152. doi: 10.3390/cells14030152. PMID: 39936944.
- Yule, David I. Ca2+ Signaling in Pancreatic Acinar Cells. Pancreapedia: Exocrine Pancreas Knowledge Base. 2020. doi: 10.3998/panc.2020.09.
- Wang Q, Michalak M. Calsequestrin. Structure, function, and evolution. Cell Calcium. 2020 Sep;90:102242. doi: 10.1016/j.ceca.2020.102242. Epub 2020 Jun 20. PMID: 32574906.
- Gerasimenko JV, Gerasimenko OV. The role of Ca2+ signalling in the pathology of exocrine pancreas. Cell Calcium. 2023 Jun;112:102740. doi: 10.1016/j.ceca.2023.102740. Epub 2023 Apr 8. PMID: 37058923.
- Yule DI, Takano T. Pacing intracellular Ca2+ signals in exocrine acinar cells. J Physiol. 2024 Jan 10:10.1113/JP284755. doi: 10.1113/JP284755. Online ahead of print. PMID: 38197224.
- Berg P, Svendsen SL, Ayasse N, Sorensen MV, Leipziger J. Secretin: a hormone for HCO(3)(-) homeostasis. Pflugers Arch. 2024 Apr;476(4):545-554. doi: 10.1007/s00424-024-02906-3. Epub 2024 Jan 15. PMID: 38221598.
- Shan W, Hu Y, Ding J, et al. Advances in Ca2+ modulation of gastrointestinal anion secretion and its dysregulation in digestive disorders (Review). Exp Ther Med. 2020 Nov;20(5):8. doi: 10.3892/etm.2020.9136. Epub 2020 Aug 25. PMID: 32934673.
- Masamune A, Kotani H, Sörgel FL, et al. Variants That Affect Function of Calcium Channel TRPV6 Are Associated with Early-Onset Chronic Pancreatitis. Gastroenterology. 2020 May;158(6):1626-1641.e8. doi: 10.1053/j.gastro.2020.01.005. Epub 2020 Jan 10. PMID: 31930989.
- Angyal D, Groeneweg TA, Leung A, et al. Pro-inflammatory cytokines stimulate CFTR-dependent anion secretion in pancreatic ductal epithelium. Cell Mol Biol Lett. 2024 Jan 23;29(1):18. doi: 10.1186/s11658-024-00537-1. PMID: 38262945.
- Schnipper J, Dhennin-Duthille I, Ahidouch A, Ouadid-Ahidouch H. Ion Channel Signature in Healthy Pancreas and Pancreatic Ductal Adenocarcinoma. Front Pharmacol. 2020 Oct 16;11:568993. doi: 10.3389/fphar.2020.568993. eCollection 2020. PMID: 33178018.
- Pallagi P, Hegyi P, Rakonczay Z Jr. The Physiology and Pathophysiology of Pancreatic Ductal Secretion: The Background for Clinicians. Pancreas. 2015 Nov;44(8):1211-33. doi: 10.1097/MPA.0000000000000421. PMID: 26465950.
- Pallagi P, Görög M, Papp N, et al. Bile acid- and ethanol-mediated activation of Orai1 damages pancreatic ductal secretion in acute pancreatitis. J Physiol. 2022 Apr;600(7):1631-1650. doi: 10.1113/JP282203. Epub 2022 Feb 17. PMID: 35081662.
- Jiang T, Wei F, Xie K. Clinical significance of pancreatic ductal metaplasia. J Pathol. 2022 Jun;257(2):125-139. doi: 10.1002/path.5883. Epub 2022 Mar 16. PMID: 35170758.
- Backx E, Coolens K, Van den Bossche JL, Houbracken I, Espinet E, Rooman I. On the Origin of Pancreatic Cancer: Molecular Tumor Subtypes in Perspective of Exocrine Cell Plasticity. Cell Mol Gastroenterol Hepatol. 2022;13(4):1243-1253. doi: 10.1016/j.jcmgh.2021.11.010. Epub 2021 Dec 4. PMID: 34875393.
- Auwercx J, Fourgeaud M, Lalot A, Gautier M. Unraveling the Connection Between Ion Channels and Pancreatic Stellate Cell Activation. Cell Physiol Biochem. 2025 Jan 18;59(S1):25-40. doi: 10.33594/000000754. PMID: 39825736.
- Ferdek PE, Krzysztofik D, Stopa KB, Kusiak AA, Paw M, Wnuk D, Jakubowska MA. When healing turns into killing — the pathophysiology of pancreatic and hepatic fibrosis. J Physiol. 2022 Jun;600(11):2579-2612. doi: 10.1113/JP281135. Epub 2022 May 4. PMID: 35430731.
- Kusiak AA, Szopa MD, Jakubowska MA, Ferdek PE. Signaling in the Physiology and Pathophysiology of Pancreatic Stellate Cells — a Brief Review of Recent Advances. Front Physiol. 2020 Feb 14;11:78. doi: 10.3389/fphys.2020.00078. eCollection 2020. PMID: 32116785.
- Wang Z, Dong S, Zhou W. Pancreatic stellate cells: Key pla–yers in pancreatic health and diseases (Review). Mol Med Rep. 2024 Jul;30(1):109. doi: 10.3892/mmr.2024.13233. Epub 2024 May 2. PMID: 38695254.
- Iyer S, Enman M, Sahay P, Dudeja V. Novel therapeutics to treat chronic pancreatitis: targeting pancreatic stellate cells and macrophages. Expert Rev Gastroenterol Hepatol. 2024 Apr-May;18(4-5):171-183. doi: 10.1080/17474124.2024.2355969. Epub 2024 May 18. PMID: 38761167.