Резюме
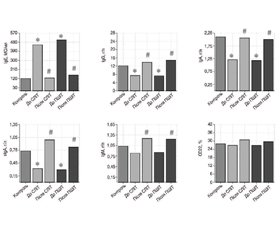
Актуальність. Алергенспецифічна імунотерапія (АСІТ) є єдиним методом лікування, здатним модифікувати природний перебіг алергічних захворювань. Сублінгвальна (СЛІТ) та підшкірна (ПШІТ) форми введення алергенів широко застосовуються, проте порівняльні дані щодо їх ефективності та впливу на імунну відповідь у дітей залишаються обмеженими. Мета: порівняти ефективність СЛІТ та ПШІТ у дітей з атопічною бронхіальною астмою (БА) шляхом аналізу їх впливу на цитокіновий профіль та імунну відповідь. Матеріали та методи. Обстежено 70 дітей віком 5–17 років з БА легкого та середнього ступеня тяжкості та сенсибілізацією до пилкових алергенів, розподілених на дві групи: група 1 (n = 35) — СЛІТ, група 2 (n = 35) — ПШІТ, та 30 здорових дітей (контроль). Період спостереження — 1 рік. Оцінювали динаміку клінічних проявів, еозинофільного запалення, стану клітинної та гуморальної ланок імунітету, рівнів цитокінів ІЛ-1β та ІЛ-4. Результати. В обох групах спостерігалось вірогідне поліпшення контролю захворювання: зниження загального бала клінічних проявів БА (на 83,4 % у групі 1, на 81,3 % — у групі 2), зменшення частоти симптомів (на 92,5 і 89,5 % відповідно) та потреби в препаратах невідкладної терапії (на 95,3 і 93,4 %). Відзначено порівнянне зменшення еозинофільного запалення: рівень еозинофілів у назальному секреті знизився з 34,6 ± 0,6 % до 15,4 ± 0,8 % у групі 1 та з 38,9 ± 1,8 % до 16,3 ± 0,5 % у групі 2; у периферичній крові — з 14,5 ± 0,5 % до 6,2 ± 1,5 % та з 15,8 ± 0,7 % до 6,3 ± 0,5 % відповідно. Обидва методи АСІТ зумовили зниження рівня IgE, підвищення рівня IgА (p < 0,001) та позитивну динаміку показників клітинної ланки імунітету. Імунорегуляторний індекс зріс у групі СЛІТ з 1,07 ± 0,21 до 1,25 ± 0,17 (р < 0,05), у групі ПШІТ — з 1,15 ± 0,11 до 1,18 ± 0,24 (р > 0,05). Виявлено порівнянну модифікацію цитокінового профілю: зниження рівнів ІЛ-1β (р < 0,05) та ІЛ-4 (р < 0,001) без статистично значущої різниці між групами (р = 0,071 та р = 0,112). Висновки. СЛІТ та ПШІТ мають однакову ефективність у лікуванні дітей з атопічною БА, демонструючи порівнянний вплив на імунітет та цитокіновий профіль. Обидва методи забезпечують формування імунологічної толерантності до алергенів, пригнічення Th2-запалення та зсув імунної відповіді в бік Th1-типу, що свідчить про їх здатність не лише полегшувати симптоми, але й модифікувати перебіг захворювання.
Background. Allergen-specific immunotherapy is currently the only disease-modifying treatment for allergic diseases. Among its delivery methods, sublingual (SLIT) and subcutaneous (SCIT) immunotherapy are commonly used. However, comparative data on their efficacy and influence on immune response in pediatric patients remain limited. The purpose was to compare the effectiveness of SLIT and SCIT in children with atopic bronchial asthma, focusing on their impact on cytokine profile and immune response. Materials and methods. A total of 70 children aged 5–17 years with mild to moderate bronchial asthma and sensibilization to pollen allergens were enrolled and randomized into two groups: group 1 (n = 35) — SLIT and group 2 (n = 35) — SCIT. A control group of 30 healthy children was included for baseline comparison. The follow-up duration was 1 year. Dynamics of clinical symptoms, eosinophilic inflammation, cellular and humoral immunity indicators, and IL-1β and IL-4 cytokines were assessed. Results. In both groups, a significant improvement in disease control was observed: a decrease in the total score of clinical manifestations of asthma (by 83.4 and 81.3 % in groups 1 and 2, respectively), symptom frequency (by 92.5 and 89.5 %), and the need to use rescue medication (by 95.3 and 93.4 %). A comparable reduction in eosinophilic inflammation was noted: the level of eosinophils in nasal secretion decreased from 34.6 ± 0.6 % to 15.4 ± 0.8 % in group 1 and from 38.9 ± 1.8 % to 16.3 ± 0.5 % in group 2; in peripheral blood — from 14.5 ± 0.5 % to 6.2 ± 1.5 % and from 15.8 ± 0.7 % to 6.3 ± 0.5 %, respectively. Both methods of allergen-specific immunotherapy led to a decrease in IgE, an increase in IgA (p < 0.001), and positive shifts in cellular immunity. The immunoregulatory index increased in the SLIT group from 1.07 ± 0.21 to 1.25 ± 0.17 (p < 0.05), in the SCIT group from 1.15 ± 0.11 to 1.18 ± 0.24 (p > 0.05). A comparable modification of the cytokine profile was found: a decrease in IL-1β (p < 0.05) and IL-4 (p < 0.001) without a statistically significant difference between the groups (p = 0.071 and p = 0.112). Conclusions. SLIT and SCIT have comparable effectiveness in the treatment of children with atopic bronchial asthma, demonstrating comparable effects on immunity and cytokine profile. Both methods provide the formation of immunological tolerance to allergens, suppression of Th2 inflammation and a shift of the immune response towards the Th1 type, which indicates their ability not only to alleviate symptoms, but also to modify the course of the disease.
Список литературы
1. Global Initiative for Asthma (GINA). The Global Strategy for Asthma Management and Prevention (2024 update). Available from: https://ginasthma.org/wp-content/uploads/2024/05/GINA-2024-Strategy-Report-24_05_22_WMS.pdf. Accessed: February 14, 2025.
2. Manti S, Magri P, De Silvestri A, De Filippo M, Votto M, Marseglia GL, et al. Epidemiology of severe asthma in children: a systematic review and meta-analysis. Eur Respir Rev. 2024 Oct 9;33(174):240095. doi: 10.1183/16000617.0095-2024. PMID: 39384302; PMCID: PMC11462310.
3. Kupkina AV, Volosovets OP, Kryvopustov SP, Prokhorova MP, Mozyrska OV. The impact of overweight and obesity on the quality of life in children with bronchial asthma. Wiad Lek. 2020;73(6):1140-1144. PMID: 32723941.
4. Volosovets OP, Bolbot YK, Kryvopustov SP, et al. Bronchial asthma in children of Ukraine: medical and environmental parallels of morbi–dity and prevalence. Medichni perspectivi. 2020;XXV(3):184-191. doi: 10.26641/2307-0404.2020.3.214861 (In Ukrainian).
5. Volosovets OP, Bolbot YK, Beketova GV, Berezenko VS, Umanets TR, Rechkina OA, et al. Allergic march in children of Ukraine. Me–dichni perspectivi. 2021;XXVІ(4):181-188. https://doi.org/10.26641/2307-0404.2021.4.2482275 (In Ukrainian).
6. Volosovets OP, Vyhovska OV, Kryvopustov SP, Mozyrska OV, Yemets OV, Volosovets AO, et al. Problems of providing medical care to children of Ukraine as a result of russian aggression. Child’s Health. 2023;18(3):157-161. https://doi.org/10.22141/2224-0551.18.3.2023.1578.
7. Volosovets OP, Kryvopustov SP, Kuzmenko AYa, Prokhorova MP, Chernii OF, Khomenko VE, et al. Deterioration of health of infants during the war and COVID-19 pandemic in Ukraine. Child’s Health. 2024;19(6):337-347. doi: 10.22141/2224-0551.19.6.2024.1737.
8. Mozyrska OV, Socolova YaV. The role of sensitization to aeroallergens and its determination in children with asthma in Ukraine. Modern Pediatrics. Ukraine. 2024;6(142):15-19. doi: 10.15574/SP.2024.6(142).1519.
9. Mozyrska OV, Volosovets OP, Kryvopustov SP, Iemets OV, Borysyuk MV, Shchotka TP. Prevalence of sensitization to respiratory allergens among Ukrainians with allergicrhinitis and asthma. Allergy. 2021;76(Suppl 110):77-78. https://doi.org/10.1111/all.15095.
10. Kappen J, Diamant Z, Agache I, et al. Standardization of clinical outcomes used in allergen immunotherapy in allergic asthma: An –EAACI position paper. Allergy. 2023 Nov;78(11):2835-2850. doi: 10.1111/all.15817. Epub 2023 Jul 14. PMID: 37449468.
11. Prokhorova MP, Volosovets OP, Kryvopustov SP, Kupkina AV, Volosovets TM. Effectiveness of allergen-specific immunotherapy in children with bronchial asthma sensitized to house dust mites. Child’s Health. 2024;19(2):58-67. https://doi.org/10.22141/2224-0551.19.2.2024.1676.
12. Batard T, Taillé C, Guilleminault L, et al. Allergen Immunothe–rapy for the Prevention and Treatment of Asthma. Clin Exp Allergy. 2025 Feb;55(2):111-141. doi: 10.1111/cea.14575. Epub 2024 Oct 4. PMID: 39363801; PMCID: PMC11791393.
13. Layhadi JA, Lalioti A, Palmer E, van Zelm MC, Wambre E, Shamji MH. Mechanisms and Predictive Biomarkers of Allergen Immunotherapy in the Clinic. J Allergy Clin Immunol Pract. 2024 Jan;12(1):59-66. doi: 10.1016/j.jaip.2023.11.027. Epub 2023 Nov 22. PMID: 37996041.
14. Gurgel RK, Baroody FM, Damask CC, et al. Clinical Practice Guideline: Immunotherapy for Inhalant Allergy. Otolaryngol Head Neck Surg. 2024 Mar;170(Suppl 1):S1-S42. doi: 10.1002/ohn.648. PMID: 38408152; PMCID: PMC11788925.
15. Asllani J, Mitsias D, Konstantinou G, et al. Adverse events in children and adolescents undergoing allergen immunotherapy for respiratory allergies-Report from the Allergen Immunotherapy Adverse Events Registry (ADER), a European Academy of Allergy and Clinical Immuno–logy taskforce. Clin Transl Allergy. 2023 Jun;13(6):e12250. doi: 10.1002/clt2.12250. PMID: 37357552; PMCID: PMC10236500.
16. Rodríguez Del Río P, Vidal C, Just J, et al. The European Survey on Adverse Systemic Reactions in Allergen Immunotherapy (EASSI): A paediatric assessment. Pediatr Allergy Immunol. 2017 Feb;28(1):60-70. doi: 10.1111/pai.12660. Epub 2016 Nov 3. PMID: 27637414.
17. Pfaar O, Ankermann T, Augustin M, et al. Guideline on allergen immunotherapy in IgE-mediated allergic diseases. Allergol Select. 2022 Sep 6;6:167-232. doi: 10.5414/ALX02331E. PMID: 36178453; PMCID: PMC9513845.
18. Shamji MH, Sharif H, Layhadi JA, Zhu R, Kishore U, Renz H. Diverse immune mechanisms of allergen immunotherapy for allergic rhinitis with and without asthma. J Allergy Clin Immunol. 2022 Mar;149(3):791-801. doi: 10.1016/j.jaci.2022.01.016. Epub 2022 Jan 29. PMID: 35093483.
19. Heinzerling L, Mari A, Bergmann KC, et al. The skin prick test — European standards. Clin Transl Allergy. 2013 Feb 1;3(1):3. doi: 10.1186/2045-7022-3-3. PMID: 23369181; PMCID: PMC3565910.
20. Manohar SM, Shah P, Nair A. Flow cytometry: principles, applications and recent advances. Bioanalysis. 2021 Feb;13(3):181-198. doi: 10.4155/bio-2020-0267. Epub 2021 Feb 5. PMID: 33543666.
21. Canonica GW, Baena-Cagnani CE, Bousquet J, et al. Recommendations for standardization of clinical trials with Allergen Specific Immunotherapy for respiratory allergy. A statement of a World Allergy Organization (WAO) taskforce. Allergy. 2007 Mar;62(3):317-24. doi: 10.1111/j.1398-9995.2006.01312.x. PMID: 17298350.
22. Atta AH, Amer RM, Mesbah AE, Khater MW. Sublingual Versus Subcutaneous Immunotherapy as regards Efficacy and Safety in Respiratory Allergic Patients. Egypt J Immunol. 2019 Jul;26(2):65-78. PMID: 31926496.
23. Vogelberg C, Brüggenjürgen B, Richter H, Jutel M. Real-World Adherence and Evidence of Subcutaneous and Sublingual Immunotherapy in Grass and Tree Pollen-Induced Allergic Rhinitis and Asthma. Patient Prefer Adherence. 2020 May 13;14:817-827. doi: 10.2147/PPA.S242957. PMID: 32494127; PMCID: PMC7231771.
24. Berce V, Cugmas M, Čopi S, Koren B, Tomazin M, Hojnik T. Evaluation and Comparison of the Efficacy of Subcutaneous and Sublingual Immunotherapy for the Treatment of Allergic Asthma in Children. Children (Basel). 2024 Jun 5;11(6):692. doi: 10.3390/children11060692. PMID: 38929271; PMCID: PMC11201833.
25. Elmoniem MA, Abdelsalam M, Yousef AM, Elmaria MO. Sublingual versus subcutaneous allergen immunotherapy in bronchial asthma: A randomized controlled trial. The Egyptian Journal of Chest Diseases and Tuberculosis. 2024 Jan-March;73(1):13-18. doi: 10.4103/ecdt.ecdt_64_23.
26. Chung SJ, Sim J, Kim HB, Park DY, Choi JH. Head-to-head comparison between subcutaneous and sublingual immunotherapy in perennial allergic rhinitis: A systematic review and meta-analysis. Allergy Asthma Respir Dis. 2024 Jan;12(1):17-25. doi: 10.4168/aard.2024.12.1.17.
27. Yang W, Wang W, Ji Y, Pan H. Efficacy and safety of subcutaneous and sublingual allergen immunotherapy in the treatment of asthma in children: a systematic review and meta-analysis. J Asthma. 2025 Jan;62(1):124-133. doi: 10.1080/02770903.2024.2391441. Epub 2024 Aug 28. PMID: 39132908.
28. Fiala S, Fleit HB. Clinical and experimental treatment of allergic asthma with an emphasis on allergen immunotherapy and its mechanisms. Clin Exp Immunol. 2023 Apr 7;212(1):14-28. doi: 10.1093/cei/uxad031. PMID: 36879430; PMCID: PMC10081111.
29. Gomaa MMHM, Kabil ASA, Ebrahim FKF, Afifi EE. Sublingual Versus Subcutaneous Immunotherapy as Regards Efficacy and Safety in Allergic Bronchial Asthma. Al-Azhar International Medical Journal. 2024;5(10):Article 6. doi: 10.58675/2682-339X.2687.
30. Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy: multiple suppressor factors at work in immune tolerance to allergens. J Allergy Clin Immunol. 2014 Mar;133(3):621-31. doi: 10.1016/j.jaci.2013.12.1088. PMID: 24581429.
31. Shamji MH, Valenta R, Jardetzky T, et al. The role of allergen-specific IgE, IgG and IgA in allergic disease. Allergy. 2021 Dec;76(12):3627-3641. doi: 10.1111/all.14908. Epub 2021 Jun 8. PMID: 33999439; –PMCID: PMC8601105.
32. Shamji MH, Larson D, Eifan A, et al. Differential induction of allergen-specific IgA responses following timothy grass subcutaneous and sublingual immunotherapy. J Allergy Clin Immunol. 2021 Oct;148(4):1061-1071.e11. doi: 10.1016/j.jaci.2021.03.030. Epub 2021 Apr 2. PMID: 33819508.
33. Han MW, Kim SH, Oh I, Kim YH, Lee J. IL-1β and iNOS can drive the asthmatic comorbidities and decrease of lung function in perennial allergic rhinitis children. Allergy Asthma Clin Immunol. 2024 Jan 2;20(1):1. doi: 10.1186/s13223-023-00867-3. PMID: 38167134; –PMCID: PMC10763256.
34. Wang ZX, Shi H. Single-allergen sublingual immunotherapy versus multi-allergen subcutaneous immunotherapy for children with allergic rhinitis. J Huazhong Univ Sci Technolog Med Sci. 2017 Jun;37(3):407-411. doi: 10.1007/s11596-017-1748-2. Epub 2017 Jun 6. PMID: 28585143.
35. Schmidlin KA, Bernstein DI. Safety of allergen immunotherapy in children. Curr Opin Allergy Clin Immunol. 2023 Dec 1;23(6):514-519. doi: 10.1097/ACI.0000000000000945. Epub 2023 Oct 17. PMID: 37846900.
36. De Filippo M, Votto M, Caminiti L, et al. Safety of allergen-specific immunotherapy in children. Pediatr Allergy Immunol. 2022 Jan;33(Suppl 27):27-30. doi: 10.1111/pai.13622. PMID: 35080302; PMCID: PMC9544714.
37. Yang J, Lei S. Efficacy and safety of sublingual versus sub–cutaneous immunotherapy in children with allergic rhinitis: a systematic review and meta-analysis. Front Immunol. 2023 Dec 15;14:1274241. doi: 10.3389/fimmu.2023.1274241. PMID: 38162647; PMCID:
PMC10757840.