Журнал «Медицина неотложных состояний» Том 21, №5, 2025
Вернуться к номеру
Визначальні фактори довгострокових результатів ортотопічної трансплантації серця: досвід найбільшої української когорти
Авторы: Білявська А.В., Ященко Н.О., Тодуров Б.М., Лоскутов О.А., Кузьмич І.М., Мельник А.Ю., Мельник М.Г.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
ДНП «Інститут серця МОЗ України», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
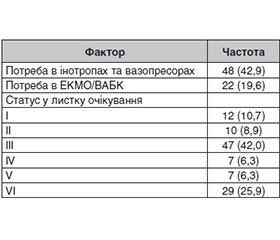
Актуальність. Попри прогрес хірургічних і імуносупресивних технологій, ранні та віддалені кардіологічні ускладнення залишаються головним обмежувальним фактором довгострокової виживаності після ортотопічної трансплантації серця (ОТС). Потреба в локальних даних особливо актуальна для України, де донорський пул старший, а метаболічні порушення реципієнтів трапляються частіше, ніж у середньому за даними ISHLT. Мета: визначити частоту ключових кардіологічних ускладнень після ОТС у найбільшій українській когорті та встановити незалежні предиктори кожного з них, приділивши особливу увагу ролі метаболічного синдрому (МС) і цукрового діабету (ЦД). Матеріали та методи. У ретроспективне одноцентрове дослідження включено 112 дорослих реципієнтів, яким виконано ізольовану ОТС у 2019–2025 рр. Оцінювали чотири кінцеві точки: первинну дисфункцію графта (ПДГ), гостре відторгнення, васкулопатію трансплантованого серця (ВТС) та клінічно значущі аритмії. Проводили описову статистику, уніваріантний аналіз (, Fisher, t-тест/Манна — Вітні) та чотири окремі логістичні регресії forced-entry з перевіркою Hosmer-Lemeshow і AUC-ROC. Результати. Медіана спостереження становила 3,7 року (IQR 2,1–4,9). Частота ускладнень: ПДГ — 33 %, гостре відторгнення — 38 %, ВТС — 28 %, аритмії — 18 %. ПДГ: незалежні фактори — ішемічний час > 240 хв (сВШ 5,22; 95% ДI 1,75–15,5), СисТЛА > 45 мм рт.ст. (4,81; 1,84–12,5), бал за ШІВ > 25 (2,50; 0,92–6,81), донор > 50 р. (2,67; 1,02–6,97) та ЦД реципієнта (2,27; 0,56–9,25). Відторгнення: реципієнт < 30 р. (4,40; 1,64–11,8), жіноча стать реципієнта (3,52; 1,09–11,3), ХХН (3,49; 1,13–10,7), СисТЛА > 50 мм рт.ст. (2,24; 0,95–5,30) і ЦД (2,02; 0,55–7,44). Аритмії: бал за ШІВ > 25 (7,33; 2,42–22,2), передопераційна ЕКМО/ВАБК (3,59; 1,08–11,9), донор > 50 р. (2,17; 0,71–6,68) та ішемія > 240 хв (2,07; 0,58–7,34). ВТС: попереднє відторгнення (13,9; 4,44–43,6), МС (4,03; 1,21–13,4), донор > 50 р. (3,98; 1,07–14,7), бал за ШІВ > 25 (2,74; 0,78–9,60), ЦД (4,43; 0,74–26,5) і ХХН (2,42; 0,57–10,3). Висновки. Ранні механічні ускладнення переважно зумовлені якістю донорського органа та гемодинамікою, тоді як відторгнення і ВТС формуються під впливом імунних та метаболічних факторів реципієнта. Метаболічний синдром і цукровий діабет залишаються універсальними предикторами несприятливого перебігу. Оптимізація донорського відбору (молодший вік, низький бал за ШІВ, час ішемії < 180 хв), контроль легеневої гіпертензії та рання корекція метаболічних розладів (HbA1c < 6,5 %, статини, сучасні антидіабетичні препарати) здатні суттєво зменшити частоту критичних кардіологічних ускладнень і поліпшити довгострокову виживаність трансплантата в українській популяції.
Background. Despite advances in surgical technique and immunosuppression, early- and late-onset cardiac complications remain the main limitation to long-term survival after orthotopic heart transplantation (OHT). Locally derived data are especially relevant for Ukraine, where the donor pool is older and metabolic disorders are more prevalent than the International Society for Heart and Lung Transplantation averages. Objective: to determine the frequency of key cardiac complications after OHT in the largest Ukrainian cohort and to establish independent predictors of each of them, paying special attention to the role of metabolic syndrome (MetS) and diabetes mellitus (DM). Materials and methods. We retrospectively analysed 112 adult recipients who underwent isolated OHT between 2019 and 2025 at a single centre. Four endpoints were assessed: primary graft dysfunction (PGD), acute rejection, cardiac allograft vasculopathy (CAV) and clinically significant arrhythmias. Descriptive statistics, univariate tests (, Fisher; t-test or Mann-Whitney) and four separate forced-entry logistic-regression models were applied. Model fit was checked with the Hosmer-Lemeshow test, discrimination with ROC AUC. Results. Median follow-up was 3.7 years (interquartile range 2.1–4.9). Overall incidence: PGD — 33 %, acute rejection — 38 %, CAV — 28 %, arrhythmias — 18 %. PGD: independent predictors: ischaemic time > 240 min (adjusted odds ratio 5.22; 95% confidence interval 1.75–15.5), systolic pulmonary artery pressure (PAPsys) > 50 mmHg (4.81; 1.84–12.5), donor vasoactive-inotropic score (VIS) > 25 (2.50; 0.92–6.81), donor age > 50 years (2.67; 1.02–6.97) and recipient DM (2.27; 0.56–9.25). Acute rejection: recipient age < 30 years (4.40; 1.64–11.8), female sex (3.52; 1.09–11.3), chronic kidney disease (3.49; 1.13–10.7), PAPsys > 50 mmHg (2.24; 0.95–5.30) and DM (2.02; 0.55–7.44). Arrhythmias: donor VIS > 25 (7.33; 2.42–22.2), pre-operative extracorporeal membrane oxygenation/intra-aortic balloon pump (3.59; 1.08–11.9), donor age > 50 years (2.17; 0.71–6.68) and ischaemic time > 240 min (2.07; 0.58–7.34). CAV: prior rejection episodes (13.9; 4.44–43.6), MetS (4.03; 1.21–13.4), donor age > 50 years (3.98; 1.07–14.7), donor VIS > 25 (2.74; 0.78–9.60), DM (4.43; 0.74–26.5) and chronic kidney disease (2.42; 0.57–10.3). Conclusions. Early mechanical complications are primarily driven by donor organ quality and implantation haemodynamics, whereas immune-mediated rejection and CAV reflect a synergy between immunological triggers and recipient metabolic status. MetS and DM act as universal amplifiers of adverse events. Rigo-
rous donor selection (younger age, low VIS, ischaemic time < 180 min), aggressive management of pulmonary hypertension, and early metabolic optimisation (HbA1c < 6.5 %, statins, mo-dern antidiabetic agents) could substantially reduce critical cardiac complications and improve long-term graft survival in the Ukrainian transplant population.
трансплантація серця; первинна дисфункція графта; відторгнення; васкулопатія; аритмія; предиктори
heart transplantation; primary graft dysfunction; rejection; vasculopathy; arrhythmia; predictors
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Peled Y, Ducharme A, Kittleson M, Bansal N, Stehlik J, Amdani S, et al. International Society for Heart and Lung Transplantation Guidelines for the Evaluation and Care of Cardiac Transplant Candidates — 2024. J Heart Lung Transplant. 2024 Oct;43(10):1529-1628.e54. https://doi.org/10.1016/j.healun.2024.05.010.
- Wilhelm MJ. Long-term outcome following heart transplantation: current perspective. J Thorac Dis. 2015 Mar;7(3):549-51. https://doi.org/10.3978/j.issn.2072-1439.2015.01.46.
- Jernryd V, Stehlik J, Metzsch C, Lund LH, Smith JG, Andersson B, et al. Donor age and ischemic time in heart transplantation — implications for organ preservation. J Heart Lung Transplant. 2025 Mar 1;44(3):364-75. https://doi.org/10.1016/j.healun.2024.10.030.
- Kobashigawa J, Zuckermann A, Macdonald P, Leprince P, Esmailian F, Luu M, et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 2014 Apr;33(4):327-40. https://doi.org/10.1016/j.healun.2014.02.027.
- Mehra MR, Crespo-Leiro MG, Dipchand A, Ensminger SM, Hiemann NE, Kobashigawa JA, et al. International Society for Heart and Lung Transplantation working formulation of a standardized nomenclature for cardiac allograft vasculopathy — 2010. J Heart Lung Transplant. 2010 Jul 1;29(7):717-27. https://doi.org/10.1016/j.healun.2010.05.017.
- Belletti A, Lerose CC, Zangrillo A, Landoni G. Vasoactive-Inotropic Score: Evolution, Clinical Utility, and Pitfalls. J Cardiothorac Vasc Anesth. 2021 Oct;35(10):3067-77. https://doi.org/10.1053/j.jvca.2020.09.117.
- Miura K, Yu R, Entwistle TR, McKenzie SC, Green AC. Association of diet quality and weight increase in adult heart transplant recipients. J Hum Nutr Diet. 2024 Apr;37(2):408-17. https://doi.org/10.1111/jhn.13263.
- Grzyb C, Du D, Mahesh B, Nair N. Risk prediction models of primary graft dysfunction in cardiac transplant patients: a need to improve? Front Cardiovasc Med [Internet]. 2024 Sep 23 [cited 2025 Jun 15];11. Available from: https://www.frontiersin.org/journals/cardiovascular-medicine/articles/10.3389/fcvm.2024.1478821/fullhttps://doi.org/10.3389/fcvm.2024.1478821.
- Segovia J, Coso MDG, Barcel JM, Bueno MG, Pava PG, Burgos R, et al. RADIAL: A novel primary graft failure risk score in heart transplantation. J Heart Lung Transplant. 2011 Jun;30(6):644-51. https://doi.org/10.1016/j.healun.2011.01.721.
- Kim D, Kim IC, Youn JC, Chang WS, Kim JJ, Jung MH, et al. Impact of obesity on long term post heart transplantation outcomes. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. 2025 May 27;S1053-2498(25)01960-6. https://doi.org/10.1016/j.healun.2025.04.021.
- Alvarez CK, Nnani D, Patel SR, Goldstein D, Saeed O, Sims D, et al. Post-Transplant Diabetes Mellitus and the Risk of Acute Rejection in Heart Transplant. J Heart Lung Transplant. 2020 Apr 1;39(4):S244. https://doi.org/10.1016/j.healun.2020.01.923.
- Nuzzi V, Cimino G, Del Medico M, Metra M, Cipriani MG. Heart Transplant Recipients: A New Test for Gliflozins. Transplantation. 2024 Oct;108(10):2009-11. https://doi.org/10.1097/TP.0000000000005010.
- Tao Z, Luo Z, Zou Z, Ye W, Hao Y, Li X, et al. Novel insights and an updated review of metabolic syndrome in immune-mediated organ transplant rejection. Front Immunol. 2025 Apr 22;16:1580369. https://doi.org/10.3389/fimmu.2025.1580369.
- Velleca A, Shullo MA, Dhital K, Azeka E, Colvin M, DePasquale E, et al. The International Society for Heart and Lung Transplantation (ISHLT) guidelines for the care of heart transplant recipients. J Heart Lung Transplant. 2023 May;42(5):e1-141. https://doi.org/10.1016/j.healun.2022.10.015.
- Elezaby A, Dexheimer R, Sallam K. Cardiovascular effects of immunosuppression agents. Front Cardiovasc Med [Internet]. 2022 Sep 21 [cited 2025 Jun 19];9. Available from: https://www.frontiersin.org/journals/cardiovascular-medicine/articles/10.3389/fcvm.2022.981838/fullhttps://doi.org/10.3389/fcvm.2022.981838.
- Decker JJ, Norby FL, Rooney MR, Soliman EZ, Lutsey PL, Pankow JS, et al. Metabolic Syndrome and Risk of Ischemic Stroke in Atrial Fibrillation: ARIC Study. Stroke. 2019 Nov;50(11):3045-50. https://doi.org/10.1161/STROKEAHA.119.025376.
- Lee MS, Tadwalkar RV, Fearon WF, Kirtane AJ, Patel AJ, Patel CB, et al. Cardiac allograft vasculopathy: A review. Catheter Cardiovasc Interv [Internet]. 2018 Dec [cited 2025 Jun 18];92(7). Available from: https://onlinelibrary.wiley.com/doi/10.1002/ccd.27893https://doi.org/10.1002/ccd.27893.
- Sponga S, Vendramin I, Ferrara V, Marinoni M, Valdi G, Di Nora C, et al. Metabolic Syndrome and Heart Transplantation: An Underestimated Risk Factor? Transpl Int. 2024 Mar 8;37:11075. https://doi.org/10.3389/ti.2024.11075.
- Rohnean A, Houyel L, Sigal-Cinqualbre A, To NT, Elfas-sy E, Paul JF. Heart Transplant Patient Outcomes: 5-Year Mean Follow-Up by Coronary Computed Tomography Angiography. Transplantation. 2011 Mar 15;91(5):583-8. https://doi.org/10.1097/TP.0b013e3182088b96.
- Snchez-Gmez JM, Martnez-Dolz L, Snchez-Lzaro I, Almenar L, Snchez-Lacuesta E, Muoz-Giner B, et al. Influence of Metabolic Syndrome on Development of Cardiac Allograft Vasculopathy in the Transplanted Heart. Transplantation. 2012 Jan 15;93(1):106. https://doi.org/10.1097/TP.0b013e3182398058.
- Jesus Valero-Masa M, Ortiz-Bautista CD, Castrodeza J, Martinez-Selles M. Optimization of Hypercholesterolemia Treatment after Heart Transplant: The Role of PCSK9 Inhibitors. Curr Pharm Des. 2024 Oct;30(35):2797-800. https://doi.org/10.2174/0113816128315228240716183827.