Журнал «Медицина неотложных состояний» 3 (66) 2015
Вернуться к номеру
Вибір дози гіпербаричного бупівакаїну (Лонгокаїн® Хеві) для запобігання артеріальній гіпотензії при спінальній анестезії у вагітних із підвищеною масою тіла
Авторы: Ткаченко Р.О. — Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ; Гріжимальський Є.В. — Київський міський центр репродуктивної та перинатальної медицини; Петриченко В.В. — Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ; Рибін М.С. — Київський міський центр репродуктивної та перинатальної медицини
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У роботі розглядається питання анестезіологічного забезпечення кесарева розтину з використанням регіонарної анестезії. Наведені дані дослідження з розробки методики підбору доз препарату Лонгокаїн® Хеві для спінальної анестезії при операції кесарева розтину для профілактики інтраопераційних порушень гемодинаміки в пацієнток із підвищеною масою тіла.
В работе рассматривается вопрос анестезиологического обеспечения кесарева сечения с использованием регионарной анестезии. Приведены данные исследования по разработке методики подбора доз препарата Лонгокаин® Хеви для спинальной анестезии при операции кесарева сечения для профилактики интраоперационных нарушений гемодинамики у пациенток с повышенной массой тела.
This paper deals with the issue of anesthetic management for caesarean section using regional anesthesia. Study data on the development of techniques to select Longocain® Heavy doses for spinal anesthesia during cesarean section to prevent intraoperative hemodynamic disorders in patients with overweight are provided.
кесарів розтин, анестезія, бупівакаїн.
кесарево сечение, анестезия, бупивакаин.
caesarean section, anesthesia, bupivacaine.
Статья опубликована на с. 111-115
Вступ
Кесарів розтин (КР) є частиною людської культури з давніх часів. Відповідно до грецької міфології Аполлон вийняв Асклепія з живота його матері (Асклепій означає «розкритий»). Багато посилань на кесарів розтин є в історії Древньої Індії, Єгипту, Греції, Римської держави, Китаю. І до сьогодні операція кесарева розтину як в Україні, так і за кордоном є однією з найпоширеніших акушерських операцій. Частота КР у родопомічних установах України, за даними МОЗ України, має тенденцію до збільшення і становить у середньому 17–22 % від загальної кількості пологів. За визначенням ВООЗ, «ідеальна» частота КР — 15 % [1].
Кесарів розтин може бути проведений під загальною анестезією, регіонарною чи місцевою інфільтраційною анестезією. Вибір методу анестезії визначається багатьма факторами — досвідом і кваліфікацією операційної бригади, ступенем терміновості операції, станом матері та плода і — не в останню чергу — можливостями лікувального закладу [1]. Кожен метод анестезії має свої переваги і недоліки, для кожного існують досить суворі показання та протипоказання.
Серед анестезіологів різних шкіл і напрямків було (а в деяких лікувальних закладах є дотепер) багато суперечок щодо методу вибору оптимального анестезіологічного забезпечення операції КР. Спроба відповісти на ці питання була зроблена в Англії, де був проведений аналіз усіх причин материнської смертності. Порівняння показників виявило таку картину. Хоча материнська смертність у цілому неухильно знижується, летальність, пов’язана з анестезією, до останнього часу не зменшувалася і до 1994 року, за даними J.L. Hawkins та співавт. (1994), була третьою причиною материнської летальності як такої [6]. Аналіз анестезіологічної летальності, проведений авторами, показав, що основною причиною серйозних ускладнень є неможливість інтубації трахеї з подальшою гіпоксемією або аспірація шлункового вмісту з розвитком синдрому Мендельсона. Зрозуміло, що такі серйозні ускладнення призвели до зростання популярності регіонарної анестезії як для планових, так і для екстрених операцій. Причини підвищеного ризику загальної анестезії пояснюються фізіологічними змінами під час вагітності. Насамперед це ризик аспірації шлункового вмісту та складної інтубації.
Під час вагітності спостерігається пригнічення евакуації їжі зі шлунка та гіперпродукція гастрину (у тому числі і плацентою), що створює всі умови для затримки у шлунку вагітної шлункового вмісту з низьким рН. Тому всі вагітні повинні розглядатись анестезіологом як пацієнти з повним шлунком, яким треба застосовувати заходи, спрямовані на запобігання регургітації й аспірації.
За рахунок анатомо-фізіологічних змін у вагітних у 10–15 разів збільшується частота складних інтубацій, ніж у звичайній хірургії (1 складна інтубація на 250 інтубацій) [6]. За рахунок зростання у вагітної потреби в кисні при невдалій або довготривалій інтубації десатурація матері (відповідно і плода) відбувається набагато швидше, ніж у невагітних. При цьому вентиляція маскою може бути неефективною та може призводити до регургітації шлункового вмісту. Безумовно, всі ускладнення, що відбуваються з породіллею, мають суттєвий вплив і на плід.
Враховуючи вищенаведене, у даний час регіонарна анестезія для акушерських операцій визначена як оптимальний метод анестезіологічної допомоги в акушерстві усіма провідними медичними організаціями світу (RCOG, FIGO, ACOG, AAGBI/OAA, ASA, SOAP та ін.).
Переваги регіонарної анестезії при операції кесарева розтину:
1. Профілактика аспіраційного синдрому.
2. Мінімальне (або відсутнє взагалі) фармакологічне навантаження на плід і новонародженого.
3. Зменшення об’єму крововтрати за рахунок гіпотензивного ефекту.
4. Часовий інтервал до вилучення плоду під час операції кесаревого розтину не обмежений.
5. Профілактика тромбоемболічних ускладнень.
6. Змога побачити немовля з перших секунд його життя.
7. Можливість раннього прикладання дитини до грудей матері (навіть під час операції).
8. Зменшення вартості анестезіологічного забезпечення.
9. Можливість раннього ентерального харчування породіллі.
Серед існуючих методів регіонарної анестезії при кесаревому розтині є багато прихильників спінальної (СА) чи епідуральної анестезії. Все більшої поширеності в анестезіологічному забезпеченні цієї операції набуває комбінована спінально-епідуральна анестезія. Всі ці методи мають свої певні переваги та недоліки, тому і до сьогодні точаться суперечки щодо методу вибору регіонарної анестезії (табл. 1).
При цьому регіонарна анестезія не позбавлена побічних ефектів і ускладнень, серед яких розвиток артеріальної гіпотензії можна зарахувати до одного з найбільш частих ускладнень (від 30,5 до 85 %) [2, 3]. Артеріальна гіпотензія негативно впливає не тільки на організм матері [4], але й на стан плода [5] за рахунок зменшення плацентарної перфузії.
Сьогодні для спінальної анестезії при КР в Україні дозволено застосування гіпербаричних розчинів лідокаїну 2% та бупівакаїну 0,5%. Для поліпшення якості аналгезії можливе додавання до розчину місцевого анестетика 15–25 мкг фентанілу [1].
Використання лідокаїну асоціюється з більшою частотою артеріальної гіпотензії та розвитком транзиторних неврологічних порушень [4]. Один із найяскравіших описів нейротоксичності місцевих анестетиків вперше надано R. Schneider у 1993 р. Він повідомив про виникнення інтенсивного болю в спині, що розвивається в пацієнтів після спінальної анестезії лідокаїном, назвавши больові відчуття синдромом подразнення нервових корінців. Пізніше був запропонований існуючий нині термін «транзиторний неврологічний синдром». Надалі Y. Auroy et al. (1997) [7] встановив, що близько 75 % неврологічних ускладнень при виконанні спінальної анестезії асоційовані із застосуванням лідокаїну. На даний час в Україні доступний для повсякденної практики лікаря-анестезіолога 0,5% гіпербаричний бупівакаїн виробництва компанії «Юрія-Фарм» під торговою назвою Лонгокаїн® Хеві. Бупівакаїн — найпоширеніший препарат для спінальної анестезії у світі. Для нього характерна велика тривалість дії (90–240 хв), що дозволяє забезпечити якісне знеболювання впродовж усієї операції.
При виборі препарату для спінальної анестезії обов’язково необхідно враховувати таку характеристику анестетика, як баричність — відношення щільності анестетика до щільності ліквору при температурі тіла. Цей показник вкрай важливий, оскільки дозволяє судити про те, як буде вести себе анестетик при введенні в субарахноїдальний простір. Існують гіпо-, ізо- та гіпербаричні розчини анестетиків. Тенденція до більш широкого застосування гіпербаричних розчинів пояснюється прагненням анестезіологів зменшити частоту розвитку високих блоків, тому, як вважається, краніальне поширення «важкого» анестетика може бути обмежене грудним кіфозом. Тобто при горизонтальному положенні вагітної на спині анестетик не підніметься вище T6–5, що і буде профілактикою високого блока та його наслідків [8].
Для профілактики артеріальної гіпотензії при КР застосовують різні методи. Досить широко раніше застосовувався метод преінфузії кристалоїдів в об’ємі 15–20 мл/кг. Однак ця методика недостатньо ефективна і сьогодні вже не рекомендована. Більш ефективним вважається метод «постінфузії», коли інфузійна терапія розпочинається одразу після виконання спінальної анестезії у швидкому темпі [9].
Вільне орієнтування лікаря в питаннях оцінки якості, рівня і глибини досягнутого блока є основою своєчасних і адекватних лікувальних заходів при виникненні будь-яких ускладнень. Слід пам’ятати, що швидкість розвитку анестезії неоднакова у різних препаратів — так, наприклад, при використанні лідокаїну блок розвивається за 2–4 хвилини, у той час як при використанні бупівакаїну його розвиток може затягнутися до 8–10 хвилин.
Для запобігання розвитку некерованої артеріальної гіпотензії при СА під час КР також використовують методику розрахунку доз місцевого анестетика. Існують різні варіанти дозування місцевих анестетиків при проведенні операції кесарева розтину. Деякі з них засновані на застосуванні фіксованих доз препаратів, інші — на розрахунку дози місцевого анестетика за морфометричними характеристиками пацієнта. Цей варіант більш обґрунтований, оскільки встановлено, що довжина і маса тіла значно впливають на остаточний рівень блока. Наприклад, є дані про те, що час розвитку сенсорного блока зростає із збільшенням довжини тіла і зменшується зі збільшенням маси [7].
Найбільш простим та часто вживаним є спосіб, що полягає у визначенні дози місцевого анестетика згідно зі зростом пацієнтки (табл. 2).
Недоліком указаного способу є те, що відсутня корекція розрахованої за зростом дози анестетика при збільшеній масі тіла пацієнтки. При надмірній масі тіла (індекс маси тіла (ІМТ) понад 25 кг/м2) відбувається зменшення об’єму субарахноїдального простору та ліквору. Введення дози місцевого анестетика, розрахованої тільки за зростом без корекції дози на збільшення маси тіла, призводить до більш краніального поширення анестетика, що, у свою чергу, призводить до виникнення неадекватно високої блокади симпатичної нервової системи, що супроводжується розвитком серцево-судинних ускладнень у вигляді артеріальної гіпотензії та брадикардії у матері.
Для запобігання вищенаведеним ускладненням ми пропонуємо корекцію розрахованої дози анестетика за зростом, у вигляді зниження дози препарату залежно від ІМТ (табл. 3).
Для поліпшення якості аналгезії до розчину місцевого анестетика додавали 25 мкг фентанілу.
Метою нашого дослідження була розробка методики підбору доз препарату Лонгокаїн® Хеві для спінальної анестезії при операції кесаревого розтину для профілактики інтраопераційних порушень гемодинаміки в пацієнток із підвищеною масою тіла.
Дослідження проводилось у Київському міському центрі перинатальної та репродуктивної медицини. У дослідження було включено 35 жінок із підвищеною масою тіла (ІМТ = 28,6 ± 4,3 кг/м2) та неускладненим перебігом вагітності віком від 18 до 40 років, які прооперовані в термін гестації від 38 до 41 тижня (середній термін — 39,7 ± 0,8 тижня) в умовах спінальної анестезії, в основному 3–4-ї категорії ургентності (табл. 4).
Усі пацієнтки були статистично однорідними за антропологічними характеристиками, ступенем анестезіологічного ризику і за характером оперативного розродження. В обох групах використовували гіпербаричний бупівакаїн компанії «Юрія Фарм» Лонгокаїн® Хеві. Пацієнтки були розподілені на дві групи: I група — контрольна (n = 15) — спінальна анестезія проводилася з розрахунком препарату за зростом, II група — порівняння (n = 20) — спінальна анестезія проводилася з розрахунком препарату за зростом і корекцією за ІМТ пацієнтки за запропонованою нами методикою. Дослідження проводили у 2 етапи: I — на операційному столі перед спінальною анестезією, II — безпосередньо після вилучення плода. Оцінювався гемодинамічний профіль апаратом КМ-АР-01 «Діамант» (Росія), а саме: систолічний та діастолічний тиск, частота серцевих скорочень, серцевий викид, серцевий індекс, загальний периферичний опір судин. Артеріальна гіпотензія визначалася нами як зниження систолічного артеріального тиску понад 25 % від початкового рівня або нижче 90 мм рт.ст. При цьому ми збільшували темп інфузії кристалоїдів, а у випадках рефрактерності АТ до проведених заходів внутрішньовенно вводили розчин мезатону (фенілефрину).
Результати дослідження та їх обговорення
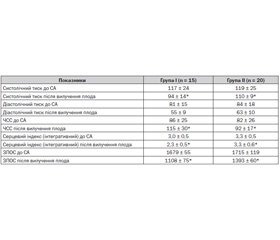
Проведене дослідження показало, що в I групі у 8 випадках (53,4 %) було відзначено розвиток артеріальної гіпотензії, 7 (46,6 %) із яких потребували додаткового введення мезатону. У II групі зниження систолічного артеріального тиску понад 25 % (або нижче 90 мм рт.ст.) від початкового рівня відмічалося у 5 жінок (25 %), у 3 (15 %) із яких використовували мезатон. Отримано вірогідне розходження між групами за частотою розвитку артеріальної гіпотензії (р < 0,05) (табл. 5).
Порівнюючи результати, отримані при оцінці гемодинамічного профілю, ми відмітили вірогідну різницю між показниками серцевого індексу та загального периферичного опору судин у групах порівняння (табл. 6). Так, у пацієнток I групи спостерігалися вірогідно нижчі вищезазначені показники, а також рівень систолічного артеріального тиску після вилучення плода та наростання тахікардії. Це свідчить, що у вагітних із підвищеною масою тіла застосування запропонованої нами схеми коригування дози гіпербаричного бупівакаїну супроводжується зменшенням частоти розвитку артеріальної гіпотензії на 28,4 % і, як наслідок, вірогідно меншими проявами порушень центральної і периферичної гемодинаміки.
Також слід зазначити, що вітчизняний препарат Лонгокаїн® Хеві продемонстрував 100% надійність і ефективність. У всіх пацієнтів відзначені прогнозований рівень спінального блока та адекватна анестезія, а відсутність будь-яких алергічних реакцій після інтратекального введення Лонгокаїну® Хеві свідчить про його безпеку.
Висновки
1. Застосування запропонованої нами схеми коригування дози гіпербаричного бупівакаїну у вагітних із підвищеною масою тіла супроводжується зменшенням частоти розвитку артеріальної гіпотензії на 28,4 % і, як наслідок, вірогідно меншими проявами порушень центральної і периферичної гемодинаміки.
2. Вітчизняний анестетик Лонгокаїн® Хеві є надійним та безпечним для виконання спінальної анестезії в акушерстві.
1. Клінічний протокол з акушерської допомоги «Кесарів розтин». Наказ МОЗ № 977 від 27.12.2011.
2. Корячкин В.А. История нейроаксиальных блокад (спинномозговая анестезия) // Регионарная анестезия и лечение острой боли. — 2008. — Т. II, № 1. — С. 51-57.
3. Hanss R., Bein B., Ledowski T. et al. Heart rate variability predicts severe hypotension after spinal anesthesia for elective cesarean delivery // Anesthesiology. — 2005. — Vol. 102. — P. 1086-1093.
4. Морган Д.Э. мл., Михаил М.С. Клиническая анестезиология. — В 3 т. — М.: Бином, 2005. — Кн. 1. — 400 с.
5. Bonnet M.P., Bruyйre M., Moufoukietal M. Anaesthesia, a cause of fetal distress? // Ann. Fr. Anesth. Reanim. — 2007. — Vol. 26, № 7. — P. 694-698.
6. Hawkins J.L., Koonin L.M., Palmer S.K., Gibbs C.P. Anesthesia-related Deaths during Obstetric Delivery in the United States, 1979–1990 // Anesthesiology. — 1997. — Vol. 86, № 2. — P. 277-284.
7. Auroy Y., Narchi P., Messiah A. Serious complications related to regional anesthesia // Anesthesiology. — 1997. — Vol. 87. — P. 479-486.
8. Chan V.W., Peng P., Chinyanga H. et al. Determining Minimum Effective Anesthetic Concentration of Hyperbaric Bupivacaine for Spinal Anesthesia // Anesth. Analg. — 2000 — Vol. 90. — P. 1135-1140.
9. Ткаченко Р.О. Сравнительная оценка различных методов внутривенной преинфузии перед выполнением эпидуральной анальгезии в родах // Біль, знеболювання і інтенсивна терапія. — 2004. — № 2(д). — C. 132-135.

/112/112.jpg)
/113/113.jpg)
/114/114.jpg)