Статья опубликована на с. 41-49
Практически во всех странах мира регистрируется рост заболеваемости сахарным диабетом (СД), причем СД 2-го типа составляет порядка 80–90 % всех случаев данной патологии [1, 2]. Пристальное внимание к данной проблеме определяется большими экономическими и моральными потерями, которые несет не только сам пациент, но и государство в целом [3]. Признано, что именно СД 2-го типа является лидирующей патологией, которая ведет к увеличению частоты сердечно-сосудистых заболеваний и сосудистых катастроф в разных странах и популяциях [4]. При хронической гипергликемии, наблюдаемой при СД, подвергаются повреждению нейроны и шванновские клетки периферических нервов, эндотелиальные клетки сетчатки глаза и мезангиальные клетки почек, которые не способны самостоятельно регулировать трансмембранный транспорт глюкозы [5]. Ангиопатии и нейропатии у больных с СД следует рассматривать как взаимообусловленные процессы. По мере прогрессирования заболевания поражение сосудов способствует нарастанию тяжести нейропатии, а последняя усугубляет сосудистую патологию [6].
Несмотря на множество инструментальных и лабораторных диагностических методик в данной области, наполненность фармацевтического рынка современными и достаточно эффективными препаратами, проблема лечения СД и его осложнений остается открытой. Соответственно, использование новых методов обследования может позволить продвинуться вперед в лечении СД.
Метод проточной цитометрии позволяет исследовать клеточный цикл, определять уровень апоптоза по гиподиплоидному содержанию ДНК в клетке, количество клеток с микроядрами, одним из путей образования которых также является апоптоз клеток [7]. Измерение содержания ДНК является одним из самых простых и распространенных применений проточной цитометрии. Анализ ДНК-гистограмм позволяет четко различать клетки, находящиеся в G1-, S-, G2/M-фазах клеточного цикла [8]. Увеличение клеток в S-фазе клеточного цикла может свидетельствовать о высокой пролиферативной активности и/или аресте клеток с повреждениями ДНК, что может служить одним из диагностических критериев некоторых патологических состояний.
Исследование апоптоза активно проводится в медицине, особенно применительно к онкологическим заболеваниям, ишемической болезни сердца, процессам старения.
Наличие микроядер в клетках и степень апоптоза также могут быть использованы в качестве своеобразного маркера патологических изменений в организме. Микроядерный тест с успехом используется в клинической практике для выявления и прогнозирования течения ряда заболеваний [9], однако его применение при СД 2-го типа мало изучено.
Существуют также данные эпидемиологических исследований, показывающие, что гипергликемия и инсулинорезистентность (ИР), важнейшие характеристики СД 2-го типа, являются факторами риска развития рака [10, 11]. Другие авторы указывают на отсутствие прямой связи онкологических заболеваний с гипергликемией и ИР [12, 13], предполагая зависимость от косвенных факторов риска СД, таких как ожирение или курение [14].
Учитывая тот факт, что апоптоз клеток является маркером онкологических заболеваний, можно предположить актуальность использования данного показателя для оценки риска возникновения рака при СД 2-го типа.
Таким образом, несмотря на относительно длительное существование метода проточной цитометрии, а также использование его в медицине для определения уровня апоптоза и характера пролиферации клеток при различных заболеваниях, при СД 2-го типа метод –изучен недостаточно, что не позволяет на данный момент рекомендовать методику для применения в клинической практике. Некоторые ученые отмечают увеличение растворимого Fas-рецептора, играющего важную роль в активации апоптоза, при наличии у пациента с СД полинейропатии [15]. По данным индийских исследований, отмечена взаимосвязь Fas-опосредованного апоптоза и тяжести нейрональной дегенерации при диабетической полинейропатии [16]. Однако недостатком данного исследования является небольшая выборка контрольной и опытной групп. Fas-опосредованный апоптоз относится к рецепторзависимому сигнальному пути апоптоза и является одним из возможных путей гибели клеток. У позвоночных (в том числе у человека) большинство форм апоптоза реализуется по митохондриальному пути, а не через рецепторы клеточной гибели [17], либо комбинацией описанных путей [18]. Помимо двух вышеперечисленных путей апоптотической гибели клеток, существует еще несколько менее распространенных, например, за счет активации прокаспазы-12, локализованной в эндоплазматическом ретикулуме [19]. Соответственно, оценка степени апоптоза только по уровню Fas-рецептора не отражает полную картину повреждения клеток при какой-либо патологии.
Именно по этой причине нами была предпринята попытка изучить возможности проточной цитометрии для дополнительной диагностики патологических изменений при СД 2-го типа, с помощью которой гибель клеток оценивалась многосторонне и по наличию уже возникшего повреждения.
Цель исследования: оценить гибель клеток периферической крови, распределение по клеточному циклу и уровень микроядер методом проточной цитометрии у пациентов с СД 2-го типа при наличии и отсутствии дистальной сенсомоторной нейропатии.
Материалы и методы
Исследование проводилось на базе Городского эндокринологического диспансера г. Минска и Республиканского госпиталя МВД Республики Беларусь.
Обследовано 176 пациентов с СД 2-го типа, среди которых 68,75 % (121 человек) составили мужчины и 31,25 % (55 человек) — женщины. Критериями исключения из исследования были сопутствующие заболевания, способные вызывать нейропатию: алкоголизм, СПИД, активные формы гепатита, гипо- и гипертиреоидные состояния, онкологические заболевания в момент исследования или в анамнезе; нарушения психики; возраст старше 65 лет; а также наличие диабетической периферической полинейропатии (ДПНП) третьей степени с ампутациями и/или трофическими изменениями нижних конечностей.
Контрольную группу составили 67 обследуемых: 83,58 % (56 человек) — мужчины, 16,42 % (11 человек) — женщины, которые не имели хронических заболеваний.
Обследование пациентов опытной группы включало опрос с уточнением анкетных данных, длительности СД и особенностей его течения, наследственности, наличия жалоб. Для количественной оценки жалоб использовалась общая шкала неврологических симптомов (Total Symptoms Score — TSS), которая включает исследование четырех нейропатических симптомов: онемения, жжения, парестезии, боли в конечностях. Проводилась диагностика ДПНП. Для этого применялась шкала нейропатического дисфункционального счета (Neuropathy Disability Score — NDS), используемая для оценки коленного и ахиллова рефлексов, порога вибрационной, температурной, болевой и тактильной чувствительности, а также уровня поражения. Для определения обширности поражения периферических нервов и для разграничения двух основных патоморфологических изменений (аксональной дегенерации и демиелинизации) у 133 пациентов опытной группы была проведена стимуляционная электромиография (ЭМГ) с помощью 2-канального электронейромиографа «Нейро-ЭМГ-Микро» фирмы «Нейрософт» (Россия). Оценивались амплитуда М-ответа и скорость распространения возбуждения (СРВ) по n. peroneus, амплитуда потенциала действия и СРВ по n. suralis и n. peroneus superficialis. На основании результатов обследования выставлялся диагноз ДПНП, а также определялась степень тяжести нейропатии с использованием классификации по P. Dyck [20], согласно которой ДПНП имеет следующие степени тяжести: стадия 0 — нет объективных данных ДПНП; стадия 1 — бессимптомная ДПНП (1а — нет симптомов и признаков ДПНП, но есть нарушения неврологических тестов; 1b — нет симптомов и признаков ДПНП, но есть нарушения неврологических тестов, а также нарушения, выявленные при неврологическом осмотре); стадия 2 — симптоматическая нейропатия (2а — есть симптомы и признаки ДПНП, а также положительные результаты неврологических тестов; 2b — признаки стадии 2а + слабость тыльных сгибателей стопы); стадия 3 — стадия осложнений полинейропатии (высокий риск образования язвенных дефектов, нейроостеоартропатия, нетравматические ампутации, нарушения трудоспособности).
У пациентов опытной и контрольной групп проводился однократный забор венозной крови. В лаборатории фармакогенетики Института биоорганической химии НАН Беларуси определяли молекулярно-биологические показатели: апоптоз лейкоцитов, микроядра, распределение клеток по фазам клеточного цикла. В лаборатории Городского эндокринологического диспансера и Республиканского госпиталя МВД РБ проводили биохимический анализ крови (гликемия, гликированный гемоглобин (HbA1c), билирубин, аланин- и аспартатаминотрансфераза, креатинин, мочевина, холестерин, липопротеиды низкой плотности (ЛПНП), триглицериды). У обследуемых обеих групп проводились антропометрические измерения: рост, масса тела, окружность талии.
Так как СД 2-го типа является хроническим заболеванием, склонным к прогрессированию, для более полного и адекватного анализа опытная группа была разделена на подгруппы А и Б. Подгруппа А включала пациентов с длительностью СД 2-го типа до 10 лет, а подгруппа Б — с длительностью заболевания 10 лет и более.
Учитывая различные нормы показаний ЭМГ, описанные в литературе, а также особенности используемых приборов и методик проведения обследования, для установления диапазона нормальных значений электромиографических показателей данного исследования была набрана отдельная контрольная группа из 35 человек: 68,6 % (24 человека) составили женщины, 31,4 % (11 человек) — мужчины. Средний возраст группы — 43,50 ± 9,88 года. Обследуемые данной группы не имели неврологических жалоб и диагноза нейропатии любого генеза. Критерием исключения также служили облитерирующий атеросклероз, варикозная болезнь нижних конечностей, радикулопатии, алкоголизм и другие заболевания, способные приводить к изменениям сенсорных и моторных волокон нервов нижних конечностей.
Пациенты опытной группы (133 человека), обследованные методом ЭМГ, были разделены на подгруппы N (норма) и P (патология) в зависимости от полученных показателей ЭМГ по n. peroneus, n. suralis, n. peroneus superficialis. В случае нормального распределения показателей ЭМГ за нижнюю границу нормы принималось значение М – 1σ, при распределении признака, отличном от нормального, нижней границей нормы считался 25% квартиль. Опираясь на полученные данные, в группу N были включены пациенты с СД 2-го типа с электромиографическими показателями, соответствующими полученной норме, а в группу P — пациенты с СД, имеющие снижение амплитуд потенциала действия и/или скоростей распространения возбуждения по нервным волокнам относительно контрольной группы.
Обработка полученных данных проводилась на персональной ЭВМ с использованием статистических пакетов Excel, Statistica 10.0. Гипотезу о нормальности распределения признаков, характеризующихся количественными значениям, считали подтвержденной, если в интервал M ± 2σ попадало не менее 95 % всех значений признаков. При нормальном распределении признака использовали методы параметрической статистики. Оценку достоверности разности сравниваемых величин проводили на основании величины критерия Стъюдента (t). Результаты представляли в виде средней ± ошибка среднего (М ± m). Если гипотезу о нормальности распределения признака в совокупности отвергали, для обработки данных использовали методы непараметрической статистики Манна — Уитни (U). Данные представляли в виде медианы и квартильного размаха — Me (25–75 %). Для определения связи между явлениями использовали коэффициенты корреляции Спирмена (ρ). Результаты исследования считали достоверными, различия между показателями значимыми при вероятности безошибочного прогноза не менее 95 % (р < 0,05).
Результаты и их обсуждение
В работе представлены изменения уровня апоптоза лейкоцитов венозной крови у пациентов с СД 2-го типа при наличии или отсутствии дистальной полинейропатии, а также в зависимости от возраста пациентов и компенсации СД. Сопоставлены показатели микроядерного теста лейкоцитов венозной крови с наличием или отсутствием диабетической полинейропатии. Проанализирован характер распределения клеток периферической крови по клеточному циклу у пациентов с СД 2-го типа при наличии или отсутствии полинейропатии.
Клиническая и лабораторная характеристика контрольной и опытной групп представлена в табл. 1.
Как видно из табл. 1, опытная группа имела больший индекс массы тела (ИМТ), что свидетельствует о частом наличии ожирения у пациентов с СД 2-го типа. Средняя длительность СД в опытной группе составила 7,50 ± 0,41 года. При обследовании пациентов с СД 2-го типа на наличие ДПНП были получены следующие данные: суммарный балл шкалы NDS составил 6,0 (3,0–10,0), а шкалы TSS — 1,0 (0,0–4,3). Для объективизации признаков поражения периферических нервов при ДПНП была проведена стимуляционная ЭМГ. Значения показателей контрольной группы были приняты за норму в нашем исследовании. В случае нормального распределения значений для каждого показателя ЭМГ был рассчитан интервал M ± σ. За нижнюю границу нормы было принято значение M – 1σ. В случае отличного от нормального распределения значений рассчитывался интервал Ме (25–75 %). В данном случае за нижнюю границу нормы принималось значение 25% квартиля.
Данные, полученные при электромиографическом обследовании в группах N и P, а также нижняя граница нормы показателей ЭМГ представлены в табл. 2.
Как видно из табл. 2, показатели ЭМГ пациентов группы P по всем исследуемым нервам были значительно ниже, чем в группе N.
/45.jpg)
В указанных группах проводился анализ молекулярно-биологических показателей лейкоцитов венозной крови. При анализе гибели лейкоцитов по уровню апоптоза и количеству клеток с микроядрами между данными показателями обнаружена прямая корреляционная связь умеренной степени (r = 0,54 при р < 0,001). Учитывая тот факт, что одним из путей образования микроядер является именно апоптоз [7], количественная оценка микроядер может служить его косвенной характеристикой. Таким образом, степень апоптоза и количество клеток с микроядрами — два взаимосвязанных маркера патологических изменений в организме. При корреляционном анализе была выявлена прямая связь апоптоза, клеток, находящихся в S-фазе, и длительности СД 2-го типа (r = 0,15 при р < 0,05, слабая корреляция). При проведении корреляционного анализа данных апоптоза с показателями ЭМГ статистически достоверная прямая слабая корреляционная связь была отмечена лишь по некоторым позициям и не носила системный характер, соответственно, не может считаться клинически значимой.
Для более детального изучения взаимосвязи клеточной гибели и СД обследуемые пациенты были разделены на две группы в зависимости от длительности СД: группа А — до 10 лет, группа Б — 10 лет и более. В данных группах проводился сравнительный анализ по нескольким позициям. При сравнении степени групп А и Б получены достоверные различия по уровню апоптоза, который в группе А составил 2,8 (1,9–4,7) %, а в группе Б — 3,7 (2,1–6,0) % (р = 0,03). Статистически достоверных различий при сравнении групп по количеству микроядер не обнаружено (p > 0,05), однако имеется тенденция к небольшому нарастанию количества клеток с микроядрами в группе Б, что показано на рис. 1.
Учитывая приведенные выше данные, можно предположить, что степень апоптоза нарастает с увеличением длительности СД.
При проведении сравнительного анализа данных групп по клиническим и лабораторным показателям было обнаружено несколько статистически достоверных различий, представленных в табл. 3.
Как видно из табл. 3, группы А и Б статистически различимы по возрасту и уровню гликированного гемоглобина (p < 0,001 и p < 0,01 соответственно). В группе Б возраст пациентов был больше, однако в данном случае статистическое различие в возрасте можно считать клинически не существенным, так как пациенты обеих групп относятся к одной возрастной категории. При проведении корреляционного анализа связь возраста и степени апоптоза отсутствует (p > 0,05). Также группа Б характеризовалась увеличением суммарных баллов шкал NDS и TSS, что лишь подтверждает данные о прогрессировании ДПНП с увеличением длительности СД.
/46.jpg)
Статистическую достоверность различия групп по HbA1c можно считать клинически важной, так как большинство пациентов группы Б находились в состоянии декомпенсации (HbA1c = 7,7 (6,8–9,6) %), а большинство пациентов группы А укладывались в рамки состояния компенсации и субкомпенсации, где HbA1c = 7,5 % считается пограничным, при превышении которого значительно возрастает количество осложнений. Однако при проведении корреляционного анализа статистически достоверная связь апоптоза и уровня гликемии отсутствовала.
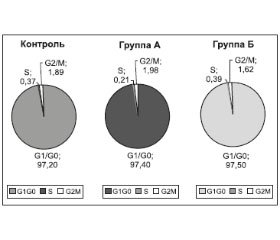
Как правило, в клеточной популяции с высокой пролиферативной активностью число клеток в S-фазе увеличивается [9]. Количество клеток в данной фазе клеточного цикла может также накапливаться с увеличением повреждений ДНК и при дифференцировке в органах кроветворения. В отсутствии полной репарации повреждений генетического материала происходит гибель клеток в очаге кроветворения, периферической крови или органах окончательной дифференцировки и депонирования. С учетом обнаруженной прямой корреляционной связи между клетками S-фазы и длительностью СД при прогрессировании СД отмечаются изменения по распределению клеток по циклу. Максимальное количество клеток, находящихся в S-фазе, было в группе Б (0,39 %), что практически не отличалось от контрольной группы, где клетки S-фазы составили 0,37 %. Несколько меньшее количество клеток было в группе А — 0,21 %, однако различие не носило статистической достоверности. Как видно на рис. 2, распределение лейкоцитов по фазам клеточного цикла в группах А и Б, а также контрольной группе не имеет статистических и клинических различий (p > 0,05). Статистической достоверности не было выявлено при анализе клеточного цикла с учетом степени компенсации СД, липидограммы, наличия ДПНП (р > 0,05). При анализе распределения клеток S-фазы в зависимости от длительности диабета в группах Р и N, сформированных на основании данных исследования ЭМГ, также было обнаружено увеличение числа клеток в S-фазе в подгруппе Б по отношению к подгруппе А. В группе N относительное количество клеток S-фазы подгруппы Б составило 0,95 (0,70–2,08) % против 0,17 (0,0–1,05) % подгруппы А (p < 0,05). Группа P: относительное количество клеток S-фазы подгруппы Б составило 0,36 (0,0–0,52) % против 0,21 (0,0–0,47) % подгруппы А (p > 0,05). Описанные данные наглядно отражены на рис. 3.
/46_2.jpg)
Таким образом, незначительный рост числа клеток в S-фазе отмечается с увеличением длительности СД 2-го типа.
Молекулярно-биологические показатели были проанализированы также в группах Р и N, сформированных на основании данных исследования ЭМГ. При сравнительном анализе уровня апоптоза и результатов микроядерного теста в указанных группах статистически достоверных различий получено не было. Следовательно, клеточная гибель, оцененная по уровню апоптоза лейкоцитов и количеству микроядер, не зависит от наличия или отсутствия полинейропатии.
Для более детального анализа пациенты данной выборки также были разделены на подгруппы А и Б по длительности СД. Статистически достоверное различие по уровню апоптоза было получено только в группе Р (р < 0,05), однако, как видно из табл. 4, в группе N сохранялась аналогичная тенденция по увеличению уровня апоптоза в подгруппе Б по сравнению с подгруппой А.
Выводы
1. Уровень апоптоза лейкоцитов периферической крови и количество клеток с микроядрами нарастает при увеличении длительности СД 2-го типа независимо от наличия или отсутствия диабетической дистальной полинейропатии, а также компенсации СД, возраста пациента.
2. Определение апоптоза и проведение микроядерного теста лейкоцитов периферической крови может служить интегральным маркером патологических изменений в организме при СД 2-го типа, но не при диабетической полинейропатии.
3. Распределения клеток периферической крови по клеточному циклу у пациентов с СД 2-го типа существенным образом не зависит от наличия или отсутствия полинейропатии.
Информация о конфликте интересов
Авторы декларируют отсутствие конфликта (двойственности) интересов при написании данной статьи.
Информация о спонсорстве
Научная работа выполнялась при финансировании Национальной академии наук Беларуси и привлеченных внебюджетных средств в рамках Государственной программы научных исследований на 2011–2015 годы «Изучение закономерностей функционирования организма в норме и при патологии, причин и механизмов развития социально значимых заболеваний, разработка новых медицинских технологий и лекарственных средств», подпрограммы 3 «Фармакология и фармация».
Соответствие нормам этики. Участники исследования давали устное согласие, информированное согласие не подписывали.
Список литературы
1. Silventoinen K., Tuomilehto J. Obesity and diabetes: increasing epidemic challenges / Luc van Gaal // Managing Obesity and Diabetes. — 2003. — Р. 1-11.
2. Valle T., Tuomilehto J., Eriksson J. Epidemiology of NIDDM in Europids // International Textbook of Diabetes Mellitus. — 2nd ed. — 1997. — № 2. — Р. 125-142.
3. Шувалова И.Г. Роль систематического обучения пациентов в профилактике поздних сосудистых осложнений у больных сахарным диабетом 2-го типа [Диссертация]. — М., 2006.
4. Данилова Л.И. Сахарный диабет 2-го типа: современные подходы к коррекции. — Минск: БелМАПО, 2010.
5. Торнелли П.Дж. Осложнения сахарного диабета: патофизиология и варианты патогенетического лечения // Материалы Международной рабочей встречи экспертов. — Штутгарт, 2010.
6. Ефимов А.С., Скробонская Н.А. Клиническая диабетология. — К., 1998.
7. Voitovich A.M., Afonin V.Y., Krupnova E.V., Trusova V.D., Dromashko E.S. The level of aberrant cells in various tissues of bank vole depending on doses and radionuclide balance in organism // Tsitol. Genet. — 2003. — № 37(4). — Р. 10-15.
8. Van Dilla M.A., Trujillo T.T., Mullaney P.F., Coulter J.R. Cell microfluorometry: a method for rapid fluorescence measurement // Science. — 1969. — № 163(3872). — Р. 1213-1214.
9. Ильин Д.А. Аспекты формирования микроядер // Естествознание и гуманизм. — 2006. — № 3(3). — С. 67-73.
10. Grote V.A., Becker S., Kaaks R. Diabetes mellitus type 2 — an independent risk factor for cancer? // Exp. Clin. Endocrinol. Diabetes. — 2010. — № 118. — Р. 4-8.
11. Mullner E., Brath H., Toferer D., Adrigan S., Bulla M.T., Stieglmayer R., Wallner M., Wagner R.M. Genome damage in peripheral blood lymphocytes of diabetic and non-diabetic individuals after intervention with vegetables and plant oil // Oxford Journals Medicine & Health & Science & Mathematics. Mutagenesis. — 2013. — № 28(2). — Р. 205-211.
12. Miao Jonasson J., Cederholm J., Eliasson B., Zethelius B., Eeg-Olofsson K., Gudbjоrnsdottir S. HbA1с and cancer risk in patients with type 2 diabetes — a nationwide population-based prospective cohort study in Sweden // PLoS ONE. — 2012. — № 7(6). — Е38784.
13. Giovannucci E., Harlan D.M., Archer M.C., Bergenstal R.M., Gapstur S.M., Habel L.A., Pollak M., Regensteiner J.G., Yee D. Diabetes and cancer: a consensus report // Diabetes Care. — 2010. — № 33. — Р. 1674-1685.
14. Kowall B., Rathmann W., Strassburger K., Heier M., Holle R., Thorand B., Giani G., Peters A., Meisinger C. Association of passive and active smoking with incident type 2 diabetes mellitus in the elderly population: the KORA S4/F4 cohort study // Eur. J. Epidemiol. — 2010. — № 25(6). — Р. 393-402.
15. Guillot R., Bringuier A.F., Porokhov B., Guillausseau P.J., Feldmann G. Increased levels of soluble Fas in serum from diabetic patients with neuropathy // Diabetes Metab. — 2001. — № 27(3). — Р. 315-321.
16. Mondal A., Sen S., Chanda D., Kundu S., Chatterjee M., Mukherjee S. Evaluation of diabetic polyneuropathy in Type 2 diabetes mellitus by nerve conduction study and association of severity of neuropathy with serum sFasL level // Indian J. Endocrinol. Metab. — 2012. — № 16(Suppl. 2). — Р. 465-467.
17. Льюин Б., Кассимерис Л., Лингаппа В.П., Плоппер Д., Филиппович И.В. Клетки. — М.: БИНОМ, 2011.
18. humbio.ru [интернет]. База знаний по биологии человека [доступ от 11.10.2014]. Доступ по ссылке: http://humbio.ru/humbio/apon/000079c2.htm
19. humbio.ru [интернет]. База знаний по биологии человека [доступ от 11.10.2014]. Доступ по ссылке: http://humbio.ru/humbio/apon/00007ebd.htm
20. Dyck J.B., Dyck P.J. Diabetic Neuropathy. — Philadelphia: WB Saunders, 1999.
/45_2.jpg)

/44.jpg)
/45.jpg)
/46.jpg)
/46_2.jpg)
/47.jpg)