Международный эндокринологический журнал 5 (69) 2015
Вернуться к номеру
Сучасні підходи до діагностики та скринінгу метаболічних порушень у хворих із неалкогольною жировою хворобою печінки
Авторы: Кобиляк Н.М. - Національний медичний університет імені О.О. Богомольця; Динник О.Б. - Інститут фізіології ім. О.О. Богомольця НАН України, м. Київ; Кирієнко Д.В. - Київський міський клінічний ендокринологічний центр
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Неалкогольна жирова хвороба печінки (НАЖХП) є найпоширенішою патологією серед усіх хронічних захворювань печінки, що призводить до погіршення якості життя, інвалідизації і смерті. Згідно із сучасними уявленнями, НАЖХП належить до одного з компонентів метаболічного синдрому, що підкреслює її взаємозв’язок із цукровим діабетом типу 2 та серцево-судинними захворюваннями. В цій статті узагальнено підходи щодо сучасних методів інструментально-лабораторної діагностики різних стадій НАЖХП. Також акцентовано увагу на проведенні скринінгу метаболічних порушень та оцінці серцево-судинного ризику в цієї когорти хворих, оскільки НАЖХП є раннім предиктором розвитку зазначених патологічних станів.
Неалкогольная жировая болезнь печени (НАЖБП) является самой распространенной патологией среди всех хронических заболеваний печени, приводящей к ухудшению качества жизни, инвалидизации и смерти. Согласно современным представлениям, НАЖБП является одним из компонентов метаболического синдрома, что подчеркивает ее взаимосвязь с сахарным диабетом типа 2 и сердечно-сосудистыми заболеваниями. В данной статье обобщены подходы относительно современных методов инструментально-лабораторной диагностики различных стадий НАЖБП. Также акцентировано внимание на проведении скрининга метаболических нарушений и оценке сердечно-сосудистого риска у данной когорты больных, поскольку НАЖБП является ранним предиктором развития указанных патологических состояний.
Nonalcoholic fatty liver disease (NAFLD) is the most common pathology among all chronic liver diseases, which leads to poor quality of life, disability and death. According to current concepts, NAFLD is one of the components of metabolic syndrome that emphasize its relationship with type 2 diabetes mellitus and cardiovascular diseases. This article summarizes the approaches to modern methods of instrumental and laboratory diagnosis of different stages of NAFLD. Also, attention is focused on the screening for metabolic disorders and evaluation of cardiovascular risk in this cohort of patients, because NAFLD is an early predictor of these pathological conditions.
неалкогольна жирова хвороба печінки, метаболічний синдром, діагностика, скринінг.
неалкогольная жировая болезнь печени, метаболический синдром, диагностика, скрининг.
nonalcoholic fatty liver disease, metabolic syndrome, diagnosis, screening.
Статья опубликована на с. 89-99
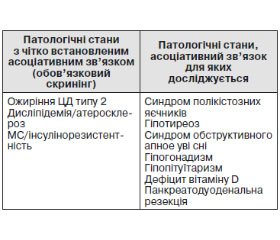
Поняття неалкогольної жирової хвороби печінки (НАЖХП) об’єднує спектр клініко-морфологічних змін печінки, представлених неалкогольним стеатозом (НАСП), стеатогепатитом (НАСГ), фіброзом (ФП) і цирозом печінки (ЦП), що розвиваються у пацієнтів, які не вживають алкоголь у гепатотоксичних дозах (< 21 алкогольної Од/тиждень для чоловіків, < 14 алкогольних Од/тиждень для жінок) [1]. НАЖХП є найпоширенішою патологією серед усіх хронічних захворювань печінки, що призводить до погіршення якості життя, інвалідизації і смерті. Це зумовлено насамперед високим ризиком її прогресування з розвитком НАСГ, печінкової недостатності та гепатоцелюлярної карциноми (ГЦК) [2]. Поширеність НАЖХП у різних країнах перебуває в межах 14–40 % [3–5]. НАЖХП трапляється в усіх вікових групах, але найбільший ризик її розвитку спостерігається у жінок віком 40–60 років з ознаками метаболічного синдрому (МС) [6].
/89.jpg)
Висновок
1. Боднар П.М. Неалкогольна жирова хвороба печінки у хворих на цукровий діабет типу 2: патогенез, діагностика та лікування (лекція) / П.М. Боднар, Г.П. Михальчишин, Н.М. Кобиляк // Ендокринологія. — 2012. — Т. 17, № 1. — C. 94-101.
2. Neuschwander-Tetri B.A. Non-alcoholic steatohepatitis: summary of an AASLD single topic conference / B.A. Neuschwander-Tetri, S.H. Caldwell // Hepatology. — 2003. — Vol. 37, № 5. — P. 1202-1219.
3. Living donor liver transplantation: histological abnormalities found on liver biopsies of apparently healthy potential donors / T.T. Tran, C. Changsri, C.R. Shackleton [et al.] // Journal of Gastroenterology and Hepatology. — 2006. — Vol. 21, № 2. — P. 381-383.
4. Prevalence of and risk factors for nonalcoholic fatty liver di-sease: the Dionysos nutrition and liver study / G. Bedogni, L. Miglioli, F. Masutti [et al.] // Hepatology. — 2005. — Vol. 42, № 1. — P. 44-52.
5. Prevalence of and risk factors for fatty liver in a general population of Shanghai, China / J.G. Fan, J. Zhu, X.J. Li [et al.] // Journal of Hepatology. — 2005. — Vol. 43, № 3. — P. 508-514.
6. Lazo M. The Epidemiology of Nonalcoholic Fatty Liver Di-sease: A Global Perspective / M. Lazo, J.M. Clark // Seminars in Liver Disease. — 2008. — Vol. 28, № 4. — P. 339-350.
7. American Diabetes Associations. Diagnosis and classification of diabetes mellitus // Diabetes Care. — 2010. — Suppl. 1. — S. 62-69.
8. Homeostasis model assessment: insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man / D.R. Matthews, J.P. Hosker, A.S. Rudenski [et al.] // Diabetologia. — 1985. — Vol. 28, № 7. — P. 412-419.
9. Prevalence of non-alcoholic fatty liver disease and its association with cardiovascular disease among Type 2 diabetic patients / G. Targher, L. Bertolini, R. Padovani [et al.] // Diabetes Care. — 2007. — Vol. 30, № 5. — Р. 1212-1218.
10. Clark J.M. The prevalense and etiology of elevated aminotransferase levels in the United States / J.M. Clark // American Journal of Gastroenterology. — 2003. — Vol. 98, № 5. — P. 955-956.
11. Bugianesi E. Non-alcoholic steatohepatitis and cancer / E. Bugianesi // Clinics in Liver Disease. — 2007. — Vol. 11, № 1. — P. 191-207.
12. Nair S. Is obesity an independent risk factor for hepatocellular carcinoma in cirrhosis? / S. Nair, A. Mason, J. Eason // Hepatology. — 2002. — Vol. 36, № 1. — Р. 150-155.
13. The natural history of non-alcoholic fatty liver disease: a population-based cohort study / L.A. Adams, J.F. Lymp, J. Sauver [et al.] // Gastroenterology. — 2005. — Vol. 129, № 1. — Р. 113-121.
14. Afdhal N.H. Evaluation of liver fibrosis: a concise review / N.H. Afdhal, D. Nunes // American Journal of Gastroenterology. — 2004. — Vol. 99, № 6. — P. 1160-1174.
15. Patients with elevated liver enzymes are not at higher risk for statin hepatotoxicity / N. Chalasani, H. Aljadhey, J. Kesterson [et al.] // Gastroenterology. — 2004. — Vol. 126, № 5. — P. 1287-1292.
16. Goessling W. Increased liver chemistry in an asymptomatic patient / W. Goessling, L.S. Friedman // Clinical Gastroenterology and Hepatology. — 2005. — Vol. 3, № 9. — P. 852-858.
17. One-year intense nutritional counselling results in histological improvement in patients with non-alcoholic steatohepatitis: a pilot study / M.A. Huang, J.K. Greenson, C. Chao [et al.] // American Journal of Gastroenterology. — 2005. — Vol. 100, № 5. — P. 1072-1081.
18. Kobyliak N., Abenavoli L. The role of liver biopsy to assess non-alcoholic fatty liver disease / N. Kobyliak, L. Abenavoli // Reviews on Recent Clinical Trials. — 2014. — Vol. 9, № 3. — P. 159-169.
19. Stauber R.E. Noninvasive diagnosis of hepatic fibrosis in chronic hepatitis C / R.E. Stauber, C. Lackner // World Journal of Gastroenterology. — 2007. — Vol. 13, № 32. — Р. 4287- 4294.
20. Prevalence and factors associated with failure of liver stiffness measurement using FibroScan in a prospective study of 2114 examinations / J. Foucher, L. Castera, P.H. Bernard [et al.] // European Journal of Gastroenterology & Hepatology. — 2006. — Vol. 18, № 4. — Р. 411-412.
21. The role of bright liver echo pattern on ultrasound B-mode examination in the diagnosis of liver steatosis / B. Palmentieri, I. de Sio, V. La Mura [et al.] // Digestive and Liver Disease. — 2006. — Vol. 38, № 7. — Р. 485-489.
22. Saverymuttu S.H. Ultrasound scanning in the detection of hepatic fibrosis and steatosis / S.H. Saverymuttu, A.E. Joseph, J.D. Maxwell // British Journal of Radiology. — 1986. — Vol. 292, № 6512. — P. 13-15.
23. Noninvasive assessment and quantification of liver steatosis by ultrasound, computed tomography and magnetic resonance / N. Schwenzer, F. Springer, C. Schraml [et al.] // Journal of Hepatology. — 2009. — Vol. 51, № 3. — Р. 433-45.
24. The role of ultrasound in the diagnosis of hepatic steatosis in morbidly obese patients / C.C. Mottin, M. Moretto, A.V. Padoin [et al.] // Obesity Surgery. — 2004. — Vol. 14, № 5. — P. 635-637.
25. Interobserver and intraobserver variability in the sonographic assessment of fatty liver / S. Strauss, E. Gavish, P. Gottlieb, L. Katsnelson // American Journal of Roentgenology. — 2007. — Vol. 189, № 6. — P. 320-323.
26. Liver echogenicity: measurement or visual grading? / T. Vehmasa, A. Kaukiainena, K. Luoma [et al.] // Compute-rized Medical Imaging and Graphics. — 2004. — Vol. 28, № 5. — P. 289-293.
27. Митьков В.В. Допплерография в диагностике заболеваний печени, желчного пузыря, поджелудочной железы и их сосудов / В.В. Митьков. — М.: Видар, 2000. — 129 с.
28. Роль індексу згасання еходенситометрії в діагностиці неалкогольного стеатогепатозу у хворих на цукровий діабет типу 2 / Н.М. Кобиляк, П.М. Боднар, О.Б. Динник, Г.П. Михальчишин // Клінічна ендокринологія та ендокринна хірургія. — 2012. — № 3(40). — С. 42-49.
29. Діагностична ефективність гепаторенального індексу у хворих на цукровий діабет типу 2 з неалкогольним стеатогепатозом / Н.М. Кобиляк, П.М. Боднар, Г.П. Михальчишин, О.Б. Динник // Український медичний часопис. — 2012. — № 6(92). — С. 125-128.
30. Лучевая диагностика заболеваний печени (МРТ, КТ, УЗИ, ОФЭКТ и ПЭТ) / Под ред. проф. Труфанова Г.Е. — М.: ГЭОТАР-Медиа. — 2007. — 193 c.
31. Noninvasive evaluation of graft steatosis in living donor liver transplantation / M. Iwasaki, Y. Takada, M. Hayashi [et al.] // Transplantation. — 2004. — Vol. 78, № 10. — P. 1501-1505.
32. Noninvasive assessment of hepatic steatosis / S.M. Mazhar, M. Shiehmorteza, C.B. Sirlin // Clinical Gastroenterology and Hepatology. — 2009. — Vol. 7, № 2. — P. 135-140.
33. Proton MR spectroscopy in quantitative in vivo determination of fat content in human liver steatosis / R. Longo, P. Pollesello, C. Ricci [et al.] // Journal of Magnetic Resonance Imaging. — 1995. — Vol. 5, № 3. — P. 281-285.
34. Magnetic resonance spectroscopy to measure hepatic triglyceride content: prevalence of hepatic steatosis in the general population / L.S. Szczepaniak, P. Nurenberg, D. Leonard [et al.] // American Journal of Physiology. — 2005. — Vol. 288, № 2. — P. 462-468.
35. Mazhar S.M. Noninvasive assessment of hepatic steatosis / S.M. Mazhar, M. Shiehmorteza, C.B. Sirlin // Clinical Gastroenterology and Hepatology. — 2009. — Vol. 7, № 2. — P. 135-140.
36. Elastography: imaging the elastic properties of soft tissues with ultrasound (review article) / J. Ophir, S.K. Alam, B.S. Garra [et al.] // Journal of Medical Ultrasonics. — 2002. — Vol. 29, № 4. — P. 155-171.
37. Doppler ultrasound detection of shear waves remotely induced in tissue phantoms and tissue in vitro / E.A. Barannik, S.A. Girnyk, V.V. Tovstiak [et al.] // Ultrasonics. — 2002. — Vol. 40, № 1–8. — P. 849-852.
38. Ультразвукова еластографія: різноманітність та пастки: Мат-ли IV конгресу Української асоціації фахівців ультразвукової діагностики (Севастополь, 14–16 травня, 2012 р.) / О.Б. Динник, Н.М. Кобиляк, О.М. Мішанич [та ін.] — К.: ВБО «Український Доплерівський Клуб», 2012. — C. 133.
39. Bavu E. Noninvasive in vivo liver fibrosis evaluation using supersonic shear imaging: a clinical study on 113 hepatitis C virus patients / E. Bavu, J. Gennisson, M. Couade // Ultrasound Med. Biol. — 2011. — Vol. 37, № 9. — P. 1361-1373.
40. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis / L. Sandrin, B. Fourquet, J.M. Hasquenoph [et al.] // Ultrasound in Medicine & Biology. — 2003. — Vol. 29, № 12. — P. 1705-1713.
41. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C / M. Ziol, A. Handra-Luca, A. Kettaneh [et al.] // Hepatology. — 2005. — Vol. 41, № 1. — P. 48-54.
42. Non-invasive assessment of liver fibrosis by stiffness measurement in patients with chronic hepatitis B / P. Marcellin, M. Ziol, P. Bedossa [et al.] // Liver International. — 2009. — Vol. 29, № 2. — P. 242-247.
43. Assessment of liver fibrosis using transient elastography in patients with alcoholic liver disease / P. Nahon, A. Kettaneh, I. Tengher-Barna [et al.] // Journal of Hepatology. — 2008. — Vol. 49, № 6. — P. 1062-1068.
44. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease / V.W. Wong, J. Vergniol, G.L. Wong [et al.] // Hepatology. — 2010. — Vol. 51, № 2. — P. 454-462.
45. Непрямая эластография печени с помощью ультразвука в диагностике фиброза: систематический обзор и метаанализ / J.A. Talwalkar, D.M. Kurtz, S.J. Schoenleber [et al.] // Клиническая гастроэнтерология и гепатология. — 2008. — Т. 1, № 2. — С. 76-83.
46. Liver stiffness values in apparently healthy subjects: influence of gender and metabolic syndrome / D. Roulot, S. Czernichow, H. Le Clésiau [et al.] // Journal of Hepatology. — 2008. — Vol. 48, № 4. — P. 606-613.
47. Prevalence and factors associated with failure of liver stiffness measurement using FibroScan in a prospective study of 2114 examinations / J. Foucher, L. Castera, P.H. Bernard [et al.] // European Journal of Gastroenterology & Hepatology. — 2006. — Vol. 18, № 4. — Р. 411-412.
48. Ультразвукова еластографія: теорія і практика створення навчального тренажеру / О.Б. Динник, М.М. Жайворонок, Н.М. Кобиляк, М.С. Харченко // Променева діагностика, променева терапія. — 2014. — № 3. — C. 42-53.
49. Дынник О.Б. Cдвигововолновая эластография и эластометрия паренхимы печени (методические аспекты) / О.Б. Дынник, А.В. Линская, Н.Н. Кобыляк // Променева діагностика, променева терапія. — 2014. — № 1–2. — C. 73-82.
50. Вікові зміни жорсткості тканини печінки білих щурів в нормі за даними біофізичного методу ультразвукової еластографії на основі хвиль зсуву / О.Б. Динник, В.Я. Березовський, Н.М. Кобиляк [та ін.] // Фізіологічний журнал. — 2013. — Т. 59, № 3. — С. 111-118.
51. Діагностична ефективність нового ультразвукового методу оцінки жорсткості печінки — еластографія хвилі зсуву у тварин з експериментальним ожирінням / П.М. Боднар, О.Б. Динник, Г.П. Михальчишин [та ін.] // Доповіді НАН України. — 2013. — № 4. — С. 159-166.
52. Diagnosis of experimental steatohepatosis using ultrasound shear wave elastography / P.M. Bodnar, O.B. Dynnik, G.P. Mykhalchyshyn [et al.] // Current Issues in Pharmacy and Medical Sciences. — 2013. — Vol. 26, № 1. — P. 97-101.
53. Жорсткість печінки за даними зсувнохвильової еластографії у хворих на цукровий діабет типу 2 з неалкогольною жировою хворобою печінки залежно від активності процесу НАЖХП / О.Б. Динник, Г.П. Михальчишин, Н.М. Кобиляк, П.М. Боднар // Гастроентерологія. — 2014. — № 3(53). — С. 24-29.
54. Кобиляк Н.М. Жорсткість печінки за даними ультра-звукової еластографії хвилі зсуву у тварин з глютамат-індукованим ожирінням / Н.М. Кобиляк // Лікарська справа. — 2013. — № 3. — С. 85-89.
55. Оцінка діагностичної ефективності еластографії хвилі зсуву у хворих на цукровий діабет типу 2 з неалкогольним стеатогепатозом / П.М. Боднар, Г.П. Михальчишин, О.Б. Динник, Н.М. Кобиляк // Ендокринологія. — 2012. — Т. 17, № 3. — С. 38-48.
56. Оцінка еластографії хвилі зсуву в діагностиці експериментальної неалкогольної жирової хвороби печінки / П.М. Боднар, О.Б. Динник, Г.П. Михальчишин [та ін.] // Журнал НАМН України. — 2011. — Т. 17, № 4. — С. 422-430.
57. Фадеенко Г.Д. «Жировая печень»: этиопатогенез, диагностика, лечение / Г.Д. Фадеенко // Сучасна гастроентерологія. — 2003. — № 3. — С. 9-16.
58. McCullough A.J. The clinical features, diagnosis and natural history of nonalcoholic fatty liver disease / A.J. McCullough // Clinical Liver Disease. — 2004. — Vol. 8, № 3. — P. 521-533.
59. Nonalcoholic fatty liver disease: predisposing factors and the role of nutrition / M. Cave, I. Deaciuc, C. Mendez [et al.] // The Journal of Nutritional Biochemistry. — 2007. — Vol. 18, № 3. — P. 184-195.
60. Кособян Е.П. Современные концепции патогенеза неалкогольной жировой болезни печени / Е.П. Кособян, О.М. Смирнова // Сахарный диабет. — 2010. — № 1. — С. 55-64.
61. The epidemiology of fatty liver / S. Bellentani, G. Bedogni, L. Miglioli, C. Tiribelli // European Journal of Gastroenterology & Hepatology. — 2004. — Vol. 16, № 11. — P. 1087-1093.
62. Prevalence of and risk factors for hepatic steatosis in Northern Italy / S. Bellentani, G. Saccoccio, F. Masutti [et al.] // Annals of Internal Medicine. — 2000. — Vol. 132, № 2. — P. 112-117.
63. Скрипник Н.В. Патогенетичне обґрунтування гепатопротекторної терапії у хворих на цукровий діабет // Міжнародний ендокринологічний журнал. — 2014. — № 6(62). — С. 85-90.
64. Reply to Alanine Aminotransferase as an Independent Predictor of Incident Nonalcoholic Fatty Liver Disease / Y. Chang, S. Ryu, E. Sung [et al.] // Clinical Chemistry. — 2007. — Vol. 53, № 6. — P. 1159-1161.
65. Некоторые клинико-патогенетические и терапевтические аспекты течения сахарного диабета 1-го типа под влиянием жировой дистрофии печени / В.Н. Хворостинка, О.И. Цивенко, О.В. Лахно, Ю.А. Горюшко // Международный эндокринологический журнал. — 2009. — № 3(21). — С. 24-28.
66. The natural history of nonalcoholic steatohepatitis: a follow-up study of forty-two patients for up to 21 years / E.E. Powell, W.G. Cooksley, R. Hanson [et al.] // Hepatology. — 1990. — Vol. 11, № 1. — P. 74-80.
67. Sonsuz A. Relationship between aminotransferase levels and histopathological findings in patients with nonalcoholic steatohepatitis / A. Sonsuz, M. Basaranoglu, G. Ozbay // American Journal of Gastroenterology. — 2000. — Vol. 95, № 5. — P. 1370-1371.
68. Diehl A.M. Alcohol-like liver disease in nonalcoholics. A clinical and histologic comparison with alcoholinduced liver injury / A.M. Diehl, Z. Goodman, K.G. Ishak // Gastroenterology. — 1988. — Vol. 95, № 4. — P. 1056-1062.
69. Independed predictors of liver fibrosis in patients whith non-alcoholic steatohepatitis / P. Angulo, J.C. Keach, K.P. Batts, K.D. Lindor // Hepatology. — 1999. — Vol. 30, № 6. — P. 1356-1362.
70. Prospective evaluation of unexplained chronic liver transaminase abnormalities in asymptomatic and symptomatic patients / S. Daniel, T. Ben-Menachem, G. Vasudevan [et al.] // American Journal of Gastroenterology. — 1999. — Vol. 94, № 10. — P. 3010-3014.
71. Schaffner F. Nonalcoholic fatty liver disease / F. Schaffner, H. Thaler // Prog. Liver Dis. — 1986. — № 8. — P. 283-298.
72. Prevalence of fatty liver in a general population of Okinawa, Japan / H. Nomura, S. Kashiwagi, J. Hayashi [et al.] // Japanese Journal of Medicine. — 1988. — Vol. 27, № 2. — P. 142-149.
73. Бабак О.Я. Стан сироваткових маркерів фіброзу печінки при неалкогольній жировій хворобі печінки / О.Я. Бабак, О.В. Колеснікова // Сучасна гастроентерологія. — 2008. — № 3. — С. 9-13.
74. Pantsari M.W. Nonalcoholic fatty liver disease presenting with an isolated elevated alkaline phosphatise / M.W. Pantsari, S.A. Harrison // Journal of Clinical Gastroenterology. — 2006. — Vol. 40, № 7. — P. 633-635.
75. Ultrasonographic hepatic steatosis increases prediction of mortality risk from elevated serum gamma-glutamyl transpeptidase levels / R. Haring, H. Wallaschofski, M. Nauck [et al.] // Hepatology. — 2009. — Vol. 50, № 5. — P. 1403-1411.
76. Ruhl C.E. Elevated serum alanine aminotransferase and gamma-glutamyltransferase and mortality in the United States population / C.E. Ruhl, J.E. Everhart // Gastroenterology. — 2009. — Vol. 136, № 2. — P. 477-485.
77. Serum gamma-glutamyltranspeptidase distinguishes non-alcoholic fatty liver disease at high risk / V. Tahan, B. Canbakan, H. Balci [et al.] // Hepato-Gastroenterology. — 2008. — Vol. 55, № 85. — P. 1433-1438.
78. Lewis J.R. Nonalcoholic fatty liver disease: a review and update / J.R. Lewis, S.R. Mohanty // Digestive Diseases and Sciences. — 2010. — Vol. 55, № 3. — P. 560-578.
79. Wieckowska A. Diagnosis of non-alcoholic fatty liver disease: invasive versus noninvasive / A. Wieckowska, A.E. Feldstein / Seminars in Liver Disease. — 2008. — Vol. 28, № 4. — P. 386-395.
80. In vivo assessment of liver cell apoptosis as a novel biomarker of disease severity in nonalcoholic fatty liver disease / A. Wieckowska, N.N. Zein, L.M. Yerian [et al.] // Hepatology. — 2006. — Vol. 44, № 1. — P. 27-33.
81. Cytokeratin-18 fragment levels as noninvasive biomarkers for nonalcoholic steatohepatitis: a multicenter validation study / A.E. Feldstein, A. Wieckowska, A.R. Lopez [et al.] // Hepatology. — 2009. — Vol. 50, № 4. — P. 1072-1078.
82. The clinical utility of biomarkers and the nonalcoholic steatohepatitis CRN liver biopsy scoring system in patients with nonalcoholic fatty liver disease / R. Malik, M. Chang, K. Bhaskar [et al.] // Journal of Gastroenterology and Hepatology. — 2009. — Vol. 24, № 4. — P. 564-568.
83. Cytokeratin 18 fragment levels as a noninvasive biomarker for non-alcoholic steatohepatitis in bariatric surgery patients / D.L. Diab, L. Yerian, P. Schauer [et al.] // Clinical Gastroenterology and Hepatology. — 2008. — Vol. 6, № 11. — P. 1249-1254.
84. Wieckowska A. Noninvasive diagnosis and monitoring of non-alcoholic steatohepatitis: present and future / A. Wieckowska, A.J. McCullough, A.E. Feldstein // Hepatology. — 2007. — Vol. 46, № 2. — P. 582-589.
85. Blood oxidative stress markers are unreliable markers of hepatic steatosis / D. Bonnefont-Rousselot, V. Ratziu, P. Giral [et al.] // Alimentary Pharmacology and Therapeutics. — 2006. — Vol. 23, № 1. — P. 91-98.
86. Chalasani N. Systemic levels of lipid peroxidation and its metabolic and dietary correlates in patients with nonalcoholic steatohepatitis / N. Chalasani, M.A. Deeg, D.W. Crabb // American Journal of Gastroenterology. — 2004. — Vol. 99, № 8. — P. 1497-1502.
87. Diehl A. M. Tumor necrosis factor and its potential role in insulin resistance and nonalcoholic fatty liver disease / A.M. Diehl // Clinics in Liver Disease. — 2004. — Vol. 8, № 3. — P. 619-638.
88. Serum cytokine and soluble cytokine receptor levels in patients with non-alcoholic steatohepatitis / S. Abiru, K. Migita, Y. Maeda [et al.] // Liver International. — 2006. — Vol. 26, № 1. — P. 39-45.
89. Free fatty acids promote hepatic lipotoxicity by stimulating TNF-α expression via a lysosomal pathway / A.E. Feldstein, N.W. Werneburg, A. Canbay [et al.] // Hepatology. — 2004. — Vol. 40, № 1. — P. 185-194.
90. Beyond insulin resistance in NASH: TNF-α or adiponectin? / J.M. Hui, A. Hodge, G.C. Farrell [et al.] // Hepatology. — 2004. — Vol. 40, № 1. — P. 46-54.
91. Михальчишин Г.П. Рівень чинника некрозу пухлин альфа і його кореляційні взаємозв’язки у хворих на цукровий діабет типу 2 із неалкогольною жировою хворобою печінки / Г.П. Михальчишин, П.М. Боднар, Н.М. Кобиляк // Клінічна ендокринологія та ендокринна хірургія. — 2014. — № 1(46). — C. 33-40.
92. Михальчишин Г.П. Рівень ІЛ-1β та його кореляційні взаємозв’язки у хворих на цукровий діабет типу 2 із неалкогольною жировою хворобою печінки / Г.П. Михальчишин, П.М. Боднар, Н.М. Кобиляк // Ендокринологія. — 2013. — Т. 18, № 4. — C. 21-28.
93. Патофізіологічна роль адипонектину в розвитку ожиріння та супутніх захворювань / Н.М. Кобиляк, Г.П. Михальчишин, О.А. Савченюк, Т.М. Фалалєєва // Світ медицини та біології. — 2013. — № 3(40). — Ч. 2. — С. 81-87.
94. Михальчишин Г.П. Кореляційні взаємозв’язки адипонектину у хворих на цукровий діабет типу 2 із неалкогольною жировою хворобою печінки в залежності від рівня трансаміназ / Г.П. Михальчишин, П.М. Боднар, Н.М. Кобиляк // Лікарська справа. — 2014. — № 5–6. — С. 130-138.
95. Михальчишин Г.П. Гіпоадипонектинемія у хворих на цукровий діабет типу 2 з неалкогольною жировою хворобою печінки / Г.П. Михальчишин, П.М. Боднар, Н.М. Кобиляк // Ендокринологія. — 2013. — Т. 18, № 2. — С. 18-25.
96. Usefulness of a combined evaluation of the serum adiponectin level, HOMA-IR, and serum type IV collagen 7S level to predict the early stage of nonalcoholic steatohepatitis / M. Shimada, H. Kawahara, K. Ozaki [et al.] // American Journal of Gastroenterology. — 2007. — Vol. 102, № 9. — P. 1931-1938.
97. High-sensitivity C-reactive protein is an independent clinical feature of nonalcoholic steatohepatitis (NASH) and also of the severity of fibrosis in NASH / M. Yoneda, H. Mawatari, K. Fujita [et al.] // Journal of Gastroenterology. — 2007. — Vol. 42, № 7. — P. 573-582.
98. Targher G. Relationship between high-sensitivity C-reactive protein levels and liver histology in subjects with non-alcoholic fatty liver disease / G. Targher // Journal of Hepatology. — 2006. — Vol. 45, № 6. — P. 879-881.
99. High sensitivity C-reactive protein values do not reliably predict the severity of histological changes in NAFLD / J.M. Hui, G.C. Farrell, J.G. Kench, J. George // Hepatology. — 2004. — Vol. 39, № 5. — P. 1458-1459.
100. Increased hepatic and circulating interleukin-6 levels in human nonalcoholic steatohepatitis / A. Wieckowska, B.G. Papouchado, Z. Li [et al.] // American Journal of Gastroenterology. — 2008. — Vol. 103, № 6. — P. 1372-1379.
101. Could inflammatory markers help diagnose nonalcoholic steatohepatitis? / G. Tarantino, P. Conca, F. Pasanisi [et al.] // European Journal of Gastroenterology and Hepatology. — 2009. — Vol. 21, № 5. — P. 504-511.
102. Serum adipokine levels predictive of liver injury in non-alcoholic fatty liver disease / M. Lemoine, V. Ratziu, M. Kim [et al.] // Liver International. — 2009. — Vol. 29, № 9. — P. 1431-1438.
103. Does leptin play a role in the pathogenesis of human non-alcoholic steatohepatitis? / N. Chalasani, D.W. Crabb, O.W. Cummings [et al.] // American Journal of Gastroenterology. — 2003. — Vol. 98, № 12. — P. 2771-2776.
104. Serum leptin levels in patients with nonalcoholic steatohepatitis / A. Uygun, A. Kadayifci, Z. Yesilova [et al.] // American Journal of Gastroenterology. — 2000. — Vol. 95, № 12. — P. 3584-3589.
105. Clinical usefulness of biochemical markers of liver fibrosis in patients with nonalcoholic fatty liver disease / H. Sakugawa, T. Nakayoshi, K. Kobashigawa [et al.] // World Journal of Gastroenterology. — 2005. — Vol. 11, № 2. — P. 255-259.
106. Elevated plasma homocysteine concentrations as a predictor of steatohepatitis in patients with non-alcoholic fatty liver disease / M. Gulsen, Z. Yesilova, S. Bagci [et al.] // Journal of Gastroenterology and Hepatology. — 2005. — Vol. 20, № 9. — P. 1448-1455.
107. Plasma Pentraxin 3 is a novel marker for nonalcoholic steatohepatitis (NASH) [Електронний ресурс] / M. Yoneda, T. Uchiyama, S. Kato [et al.] // BMC Gastroenterology. — 2008. — Vol. 8, article 53. — 7 р. — Режим доступу до журн.: http://www.biomedcentral.com/1471-230X/8/53
108. Serum concentrations of the tissue polypeptide specific antigen in patients suffering from non-alcoholic steatohepatitis / G. Tarantino, P. Conca, A. Coppola [et al.] // The European Journal of Clinical Investigation. — 2007. — Vol. 37, № 1. — P. 48-53.
109. Kotronen A., Peltonen M., Hakkarainen A. et al. Prediction of non-alcoholic fatty liver disease and liver fat using metabolic and genetic factors. Gastroenterology. — 2009. — Vol. 137. — P. 865-872.
110. The fatty liver index: a simple and accurate predictor of hepatic steatosis in the general population [Електронний ресурс] / G. Bedogni, S. Bellentani, L. Miglioli [et al.] // BMC Gastroenterology. — 2006. — Vol. 6, article 33. — 9 р. — Режим доступу до журн.: http://www.biomedcentral.com/1471-230X/6/33
111. A simple index of lipid overaccumulation is a good marker of liver steatosis [Електронний ресурс] / G. Bedogni, H.S. Kahn, S. Bellentani, C. Tiribelli // BMC Gastroenterology. — 2010. — Vol. 10, article 98. — 8 р. — Режим доступу до журн.: http://www.biomedcentral.com/1471-230X/10/98
112. Nishi T., Babazono A., Maeda T., Imatoh T., Une H. Evaluation of the fatty liver index as a predictor for the development of diabetes among insurance beneficiaries with prediabetes // Journal of Diabetes Investigation. — 2015. — Vol. 6, № 3. — P. 309-316.
113. Jung C.H., Lee W.J., Hwang J.Y. et al. Assessment of the fatty liver index as an indicator of hepatic steatosis for predicting incident diabetes independently of insulin resistance in a Korean population. Diabet Med. — 2013. — Vol. 30, № 4. — P. 428-435.
114. Balkau B., Lange C., Vol S., Fumeron F. et al. Nine-year incident diabetes is predicted by fatty liver indices: the French D.E.S.I.R. study // BMC Gastroenterol. — 2010. — Vol. 10. — e. 56.
115. Lee J.H., Kim D., Kim H.J. et al. Hepatic steatosis index: a simple screening tool reflecting nonalcoholic fatty liver disease // Dig Liver Dis. — 2010. — Vol. 42, № 7. — P. 503-508.
116. Kahl S., Straßburger K., Nowotny B. Comparison of liver fat indices for the diagnosis of hepatic steatosis and insulin resistance // PLoS One. — 2014. — Vol. 9, № 4. — e. 94059.
117. Liver stiffness measurement in children using FibroScan: feasibility study and comparison with Fibrotest, aspartate transaminase to platelets ratio index, and liver biopsy / V. De Ledinghen, B. Le Bail, L. Rebouissoux [et al.] // Journal of Pediatric Gastroenterology and Nutrition. — 2007. — Vol. 45, № 4. — P. 443-450.
118. Liver fibrosis: noninvasive assessment with MR elastography versus aspartate aminotransferase-to-platelet ratio index / L. Huwart, C. Sempoux, N. Salameh [et al.] // Radiology. — 2007. — Vol. 245, № 2. — P. 458-466.
119. Transient elastography predicts fibrosis progression in patients with hepatitis and cirrhosis / L. Castera, P.H. Bernard, B. Le Bail [et al.] // Hepatology. — 2008. — Vol. 48, № 2. — P. 156-159.
120. Evolving practices of noninvasive markers of liver fibrosis patients with chronic hepatitis C in France: Time for new guidelines? // Journal of Hepatology. — 2007. — Vol. 46, № 3. — P. 528-529.
121. Complex non-invasive fibrosis models are more accurate than simple models in non-alcoholic fatty liver disease / L.A. Adams, J. George, E. Bugianesi [et al.] // J. Gastroenterol Hepatol. — 2011. — Vol. 26. — P. 1536-1543.
122. The impact of liver disease aetiology and the stages of hepatic fibrosis on the performance of non-invasive fibrosis biomarkers: an international study of 2411 cases / G. Sebastiani, L. Castera, P. Halfon [et al.] // Aliment. Pharmacol. Ther. — 2011. — Vol. 34. — P. 1202-1216.
123. Performance of biomarkers FibroTest, ActiTest, SteatoTest, and NashTest in patients with severe obesity: meta analysis of individual patient data / T. Poynard, G. Lassailly, E. Diaz [et al.] // PLoS One. — 2012. — Vol. 7. — e. 30325.