Международный эндокринологический журнал 5 (69) 2015
Особливості цитокінового профілю у хворих на гіпотиреоз із супутнім хронічним холециститом
Резюме
Досліджено особливості показників цитокінової регуляції у пацієнтів із гіпотиреозом та супутнім хронічним холециститом та їх взаємозв’язки з біохімічними показниками крові та параметрами ліпідного профілю. Рівень прозапального інтерлейкіну-1β (IL-1β) у хворих дослідної групи на 55,3 % (p = 0,03) переважав аналогічний показник в осіб групи контролю. Уміст IL-1β позитивно корелював із концентрацією сечовини (r = 0,41, p = 0,04), активністю аспартатамінотрансферази (АсАТ) (r = 0,40, p = 0,05) та аланінамінотрансферази (АлАТ) (r = 0,43, p = 0,04). У пацієнтів із гіпотиреозом та хронічним холециститом концентрація фактора некрозу пухлини α (TNF-α) у 4,6 раза (p = 0,0005) переважала показник у практично здорових осіб та на 23,1 % (p = 0,04) — у пацієнтів групи порівняння. Встановлені прямі кореляційні зв’язки між рівнем TNF-α та активністю АлАТ (r = 0,47, p = 0,02), АсАТ (r = 0,52, p = 0,01), лужної фосфатази (r = 0,60, p = 0,002) та γ-глутамілтранспептидази (r = 0,52, p = 0,01). Концентрація протизапального IL-10 у крові хворих на гіпотиреоз із супутнім хронічним холециститом була вірогідно нижчою порівняно з показником у практично здорових осіб та пацієнтів із хронічним холециститом на 56,4 % (p = 0,05) та 53,8 % (p = 0,04) відповідно. Встановлена обернена кореляція між умістом IL-10 та активністю гамма-глутамілтранспептидази (r = –0,44, p = 0,04), АлАТ (r = –0,39, p = 0,09), рівнем загального холестерину (r = –0,46, p = 0,03), холестерину ліпопротеїнів низької щільності (r = –0,51, p = 0,01), холестерину ліпопротеїнів дуже низької щільності (r = –0,43, p = 0,04).
Исследованы особенности показателей цитокиновой регуляции у пациентов с гипотиреозом и сопутствующим хроническим холециститом и их взаимосвязи с биохимическими показателями крови и параметрами липидного профиля. Уровень провоспалительных интерлейкинов-1β (IL-1β) у больных опытной группы на 55,3 % (p = 0,03) превосходил аналогичный показатель у лиц группы контроля. Содержание IL-1β положительно коррелировало с концентрацией мочевины (r = 0,41, p = 0,04), активностью аспартатаминотранс-феразы (АсАТ) (r = 0,40, p = 0,05) и аланинаминотрансферазы (АлАТ) (r = 0,43, p = 0,04). У пациентов с гипотиреозом и хроническим холециститом концентрация фактора некроза опухоли α (TNF-α) в 4,6 раза (p = 0,0005) превосходила показатель у практически здоровых лиц и на 23,1% (p = 0,04) — у пациентов группы сравнения. Установлены прямые корреляционные связи между уровнем TNF-α и активностью АсАТ (r = 0,47, p = 0,02), АлАТ (r = 0,52, p = 0,01), щелочной фосфатазы (r = 0,60, p = 0,002) и гамма-глутамилтранспептидазы (r = 0,52, p = 0,01). Концентрация противовоспалительного IL-10 в крови больных гипотиреозом с сопутствующим хроническим холециститом была достоверно ниже по сравнению с таковой у практически здоровых лиц и пациентов с хроническим холециститом на 56,4 % (p = 0,05) и 53,8 % (p = 0,04) соответственно. Установлена обратная корреляция между содержанием IL-10 и активностью гамма-глутамилтранспептидазы (r = –0,44, p = 0,04), АлАТ (r = –0,39, p = 0,09), содержанием общего холестерина (r = –0,46, p = 0,03), холестерина липопротеинов низкой плотности (r = –0,51, p = 0,01), холестерина липопротеинов очень низкой плотности (r = –0,43, p = 0,04).
The peculiarities of cytokine regulation in patients with hypothyroidism and concomitant chronic cholecystitis and its relationship with blood biochemical parameters and lipid profile parameters were investigated. The proinflammatory IL-1β plasma level in patients in the experimental group 55.3 % (p = 0.03) prevailed in comparison with a control one. IL-1β content positively correlated with the urea concentration (r = 0.41, p = 0.04), AST (r = 0.40, p = 0.05) and ALT activities (r = 0.43, p = 0.04). In patients with hypothyroidism and chronic cholecystitis TNF-α concentration was 4.6 times (p = 0.0005) greater that in healthy individuals and 23.1 % (p = 0.04) in comparison with a comparative group of patients. A direct correlation between the TNF-α level and AST (r = 0.47, p = 0.02), ALT (r = 0.52, p = 0.01), alkaline phosphatase (r = 0.60, p = 0.002) and gamma-glutamyltransferase activities (r = 0.52, p = 0.01) was revealed. The concentration of anti-inflammatory IL-10 in the blood of patients with hypothyroidism with concomitant chronic cholecystitis was significantly lower compared to that in healthy individuals and patients with chronic cholecystitis at 56.4 % (p = 0.05) and 53.8 % (p = 0.04), respectively. There was established inverse correlation between the IL-10 content and gamma-glutamyltransferase (r = –0.44, p = 0.04), ALT activities (r = –0.39, p = 0.09), total cholesterol level (r = –0.46, p = 0.03), low density lipoproteins (r = –0.51, p = 0.01), very low density lipoproteins (r = –0.43, p = 0.04).
Ключевые слова
хронічний холецистит, гіпотиреоз, інтелейкін-1β, фактор некрозу пухлини α, інтерлейкін-10.
хронический холецистит, гипотиреоз, интерлейкин-1β, фактор некроза опухоли α, интерлейкин-10.
chronic cholecystitis, hypothyroidism, inteleukin 1β, tumor necrosis factor α, interleukin 10.
Статья опубликована на с. 130-134
Вступ
Гіпотиреоз належить до частої патології, що має тенденцію до зростання впродовж останніх десятиріч. За різними оцінками, поширеність клінічних та субклінічних форм гіпотиреозу становить від 1,4 до 8,0 % загальної популяції [8]. Вплив низької концентрації гормонів щитоподібної залози (ЩЗ) поширюється на різні органи, регулюючи білковий, вуглеводний, ліпідний обмін, моделюючи імунну відповідь та активність процесів запалення [18]. Rege et al. показали, що цитокіни родини інтерлейкіну-1 (IL-1) впливають на процеси всмоктування та секреції у жовчному міхурі [12], зокрема, IL-1β шляхом їх зміни може спричиняти холелітіаз [14]. ІL-1β також потенціює властивість IL-6 щодо зниження скоротливості гладких м’язів та розвитку резистентності до інсуліну [7, 12]. Водночас експресія прозапального IL-1β збільшується у хворих на гіпотиреоз [18].
Фактор некрозу пухлини α (TNF-α) також викликає порушення скорочення гладких м’язів жовчного міхура, процесів абсорбції, перекисного окислення ліпідів у ньому та сприяє розвитку інсулінорезистентності [6, 10]. Крім того, TNF-α збільшує секрецію муцину [9], який за умов запалення стінки жовчного міхура спричиняє виникнення жовчнокам’яної хвороби [11]. У дослідженнях A. Kasprzak et al. доведено, що висока концентрація TNF-α у пацієнтів із хронічним холециститом (ХХ) сприяє розвитку холелітіазу [3]. TNF-α також впливає на функцію ЩЗ [4], що обумовлено наявністю TNF-α-рецепторів в її паренхімі, кількість яких зростає у пацієнтів із гіпотиреозом [13] одночасно зі збільшенням вмісту TNF-α у крові таких хворих [19]. У дослідженнях на щурах показана властивість TNF-α пригнічувати функцію ЩЗ [16].
D.N. Gadzhiev et al. встановили асоціацію вмісту протизапального IL-10 із клінічними показниками пацієнтів, які були прооперовані з приводу гострого калькульозного холециститу [17]. Водночас у роботах І.О. Шаповалової виявлено збільшення концентрації IL-10 у пацієнтів із хронічним токсичним гепатитом, поєднаним із хронічним некаменевим холециститом [2]. Отже, про- та протизапальні цитокіни мають плейотропні властивості щодо ЩЗ та жовчного міхура, що вказує на актуальність їх вивчення у пацієнтів із гіпотиреозом та ХХ з метою виявлення ймовірної ролі у розвитку та перебігу зазначених захворювань.
Мета дослідження — вивчити особливості про- та протизапальних цитокінів у пацієнтів із гіпотиреозом і супутнім ХХ та їх взаємозв’язки з біохімічними показниками крові та параметрами ліпідного профілю.
Матеріал і методи
Обстежені 72 пацієнти з первинним гіпотиреозом та супутнім хронічним безкам’яним холециститом (дослідна група). Для встановлення можливого впливу гіпотиреозу на перебіг ХХ обстежено 30 хворих із ХХ та нормальною функціональною активністю ЩЗ (група порівняння). У групу контролю увійшли 20 практично здорових осіб. Середній вік хворих дослідної групи становив 42,3 ± 2,6 року, групи порівняння — 46,0 ± 1,6 року, осіб контрольної групи — 40,1 ± 2,9 року. Гендерний розподіл був порівнянний у всіх групах. Усі обстежені пацієнти та практично здорові особи дали письмову інформовану згоду на участь у дослідженні. Кров брали натще із ліктьової вени. Як антикоагулянт застосовували 5% розчин етилендіамінтетраацетату динатрієвої солі. Біохімічні дослідження крові та вивчення ліпідного спектра проводили на біохімічному аналізаторі Accent-200 (Cormay S.A., Польща) з використанням стандартних реактивів та методик у лабораторії Чернівецького обласного діагностичного центру. До показників біохімічного дослідження крові, що вивчалися, увійшли: загальний білірубін та його фракції, сечова кислота, загальний білок та альбумін, сечовина та креатинін, активність ферментів крові (аспартатамінотрансферази (АсАТ), аланінамінотрансферази (АлАТ), лактатдегідрогенази (ЛДГ), гамма-глутамілтранспептидази (ГГТП), лужної фосфатази (ЛФ)). Серед параметрів ліпідного спектра досліджували вміст загального холестерину (ЗХС), триацилгліцеролів, холестерину ліпопротеїнів високої (ЛПВЩ), низької (ЛПНЩ) та дуже низької щільності (ЛПДНЩ). Для кожного пацієнта розраховували коефіцієнт атерогенності (КА). Ультразвукове дослідження (УЗД) органів черевної порожнини проводили за допомогою апаратів En Visor HD (Philips Ultrasound System, США) з урахуванням стандартного протоколу УЗД органів черевної порожнини [1]. Вивчення показників цитокінового профілю проводили методом імуноферментного аналізу, визначаючи вміст у плазмі крові прозапальних цитокінів: IL-1β, TNF-α та протизапального IL-10.
Тип розподілу даних визначали за порівнянням середньої арифметичної, моди і медіани та за допомогою тестів Шапіро — Уїлка і Левене. Для визначення статистичних відмінностей між двома незалежними групами використовували критерій Манна — Уїтні.
Результати та їх обговорення
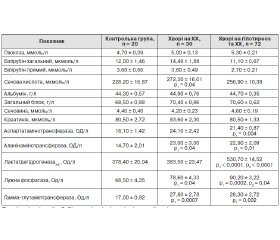
У пацієнтів із гіпотиреозом та ХХ відзначалося збільшення активності АсАТ, АлАТ та ГГТП порівняно з показниками активності цих ферментів в осіб групи контролю. У хворих із поєднаною патологією ЩЗ та жовчного міхура спостерігали значне збільшення активності ЛДГзаг. та ЛФ, які переважали аналогічні показники у пацієнтів групи порівняння та в практично здорових осіб, що може вказувати на збільшення холестазу у пацієнтів із ХХ на фоні гіпофункції ЩЗ (табл. 1).
Аналізуючи показники ліпідного профілю, автори виявили вірогідне збільшення вмісту ЗХС та триацилгліцеролів у крові хворих обох груп, проте більш значним воно було у пацієнтів із поєднаною патологією (табл. 2).
Отримані результати корелюють із даними інших дослідників, які вказують на наявність гіперхолестеринемії у хворих із гіпотиреозом [5]. Для хворих обох груп було властивим збільшення рівня ХС ЛПНЩ та ЛПДНЩ порівняно з практично здоровими людьми, з тенденцією до більшого зростання у пацієнтів, в яких ХХ поєднувався із гіпотиреозом. Зазначені зміни –обумовили збільшення КА у хворих на ХХ і пацієнтів із ХХ та гіпотиреозом.
Рівень прозапального IL-1β у хворих дослідної групи на 55,3 % (p = 0,03) переважав показник в осіб групи контролю (табл. 3). Вірогідних відмінностей у концентрації зазначеного цитокіну між хворими дослідної групи та пацієнтами групи порівняння не виявлено. Вміст IL-1β позитивно корелював із концентрацією сечовини (r = 0,41, p = 0,04), активністю АсАТ (r = 0,40, p = 0,05) та АлАТ (r = 0,43, p = 0,04).
/132.jpg)
У хворих на ХХ вміст TNF-α у крові був вірогідно вищий у 3,7 раза (p = 0,02) порівняно з контрольними показниками. У пацієнтів із коморбідними захворюваннями на гіпотиреоз та ХХ концентрація цього прозапального цитокіну була найвищою та у 4,6 раза (p = 0,0005) переважала показник у практично здорових осіб. Водночас вона була на 23,1 % (p = 0,04) більшою за відповідний показник у пацієнтів групи порівняння (табл. 3). Встановлено прямі кореляційні зв’язки середньої сили між рівнем TNF-α у крові та активністю АсАТ (r = 0,47, p = 0,02), АлАТ (r = 0,52, p = 0,01), ЛФ (r = 0,60, p = 0,002) і ГГТП (r = 0,52, p = 0,01). Збільшення вмісту IL-1β та TNF-α у пацієнтів із гіпотиреозом та ХХ супроводжувалося більш вираженими ознаками інтоксикаційного синдрому та холе-стазу, частішими скаргами на відчуття тяжкості у правому підребер’ї, періодичну нудоту, головний біль, погане загальне самопочуття та загальну слабкість. Виявлені прямі кореляційні зв’язки між умістом обох прозапальних цитокінів і активністю маркерів цитолізу, холестазу й інтоксикаційного синдрому свідчать про певну їх роль у розвитку та прогресуванні хронічних запальних захворювань жовчного міхура. Отже, визначення вмісту IL-1β та TNF-α у крові таких хворих відображає активність вищевказаних синдромів, що може бути використано для покращення якості діагностики цього захворювання.
Концентрація протизапального IL-10 у крові хворих на гіпотиреоз із супутнім ХХ була вірогідно нижчою порівняно з показником у практично здорових осіб і пацієнтів із ХХ на 56,4 % (p = 0,05) та 53,8 % (p = 0,04) відповідно (табл. 3). Встановлена обернена кореляція середньої сили між умістом IL-10 у крові обстежених пацієнтів та активністю ГГТП (r = –0,44, p = 0,04). Також обернена кореляція, наближена до вірогідної, була виявлена між умістом протизапального цитокіну та активністю АлАТ (r = –0,39, p = 0,09). Зазначене може свідчити про роль IL-10 у запобіганні виникненню холестатичних процесів у жовчному міхурі, розвитку ендогенної інтоксикації внаслідок цього та зменшенні активності цитолітичних процесів у печінці таких хворих. Концентрація протизапального IL-10 негативно корелювала з умістом ЗХС (r = –0,46, p = 0,03), ЛПНЩ (r = –0,51, p = 0,01), ЛПДНЩ (r = –0,43, p = 0,04), що виявлялося у негативному кореляційному зв’язку між умістом цитокіну та показником КА (r = –0,49, p = 0,02). Зазначені кореляційні зв’язки вказують на ймовірну роль IL-10 у запобіганні атеросклеротичним процесам, що мають схильність до зростання у пацієнтів із гіпотиреозом [15].
Висновки
1. У хворих на ХХ, поєднаний із гіпотиреозом, спостерігається вірогідно вища концентрація прозапального TNF-α на 23,1 % (p = 0,04) та нижчий рівень протизапального IL-10 на 53,8 % (p = 0,04) у крові порівняно з пацієнтами без порушення функції щитоподібної залози.
2. Встановлено кореляційні зв’язки між умістом IL-1β, TNF-α, IL-10 та біохімічними маркерами цитолізу, холестазу, інтоксикації, а також показниками ліпідного профілю, що свідчить про участь цитокінової ланки імунної системи в патогенезі ХХ у хворих на гіпотиреоз.
Перспективу подальших досліджень вбачаємо у поглибленні досліджень механізмів участі про- та протизапальних цитокінів у перебігу ХХ та гіпотиреозу і використанні результатів таких досліджень для оптимізації терапевтичних схем лікування зазначеного контингенту осіб.
Список литературы
1. Стандартный протокол ультразвукового исследования печени (В-режим) / З.А. Лемешко, Э.Я. Дубров, В.В. Митьков [и др.] // Российский журнал гастроэнтерологии, гепатологии и колонопроктологии. — 2001. — № 1. — С. 84-85.
2. Шаповалова І.О. Вплив нуклеїнату на цитокіновий профіль крові хворих з хронічним токсичним гепатитом, поєднаним з хронічним некалькульозним холециститом на тлі ожиріння / І.О. Шаповалова // Український медичний альманах. — 2011. — Т. 14, № 1. — С. 224-227.
3. Analysis of immunohistochemical expression of proinflammatory cytokines (IL-1α, IL-6, and TNF-α) in gallbladder mucosa: comparative study in acute and chronic calculous cholecystitis / A. Kasprzak, M. Szmyt, W. Malkowski et al. // Folia Morphol. — 2015. — Vol. 74(1). — P. 65-72.
4. Cerniglia B. Infliximab-Induced Hypothyroidism: A Novel Case and Postulations concerning the Mechanism / B. Cerniglia, M.A. Judson // Case Rep. Med. — 2013. — Vol. 3. — P. 216-219.
5. Dickey R.A. The thyroid-cholesterol connection: an association between varying degrees of hypothyroidism and hypercholesterolemia in women / R.A. Dickey, S. Feld // J. Womens Health Gend. Based Med. — 2000. — Vol. 9. — P. 333-336.
6. Gilloteaux J. Lipid deposits and lipo-mucosomes in human cholecystitis and epithelial metaplasia in chronic cholecystitis / J. Gilloteaux, L.M. Tomasello, D.A. Elgison // Ultrastructural Pathology. — 2003. — Vol. 27. — P. 313-321.
7. Jager J. Interleukin-1beta-induced insulin resistance in adipocytes through down-regulation of insulin receptor substrate-1 expression / J. Jager, T. Gremeaux, M. Cormont // Endocrino-logy. — 2007. — Vol. 148. — P. 241-251.
8. Karmisholt J. Variation in thyroid function tests in patients with stable untreated subclinical hypothyroidism / J. Karmisholt, S. Andersen, P. Laurberg // Thyroid. — 2008. — Vol. 18. — P. 303-308.
9. MUC5AC, a gel-forming mucin accumulating in gallstone disease, is overproduced via an epidermal growth factor receptor pathway in the human gallbladder / L. Finzi, V. Barbu, P.R. Burgel et al. // Am. J. Pathol. — 2006. — Vol. 169. — P. 2031-2041.
10. Pazdrak K. TNF alpha suppresses human colonic circular smooth muscle cell contractility by SP1- and NF-kappaB-mediated induction of ICAM-1 / K. Pazdrak, X.Z. Shi, S.K. Sarna // Gastroenterology. — 2004. — Vol. 127. — P. 1096-1109.
11. Rege R.V. Inflammation and a thickened mucus layer in mice with cholesterol gallstones / R.V. Rege, J.B. Prystowsky // J. Surg. Res. — 1998. — Vol. 74. — P. 81-85.
12. Rege R.V. Inflammatory cytokines alter human gallbladder epithelial cell absorption/secretion / R.V. Rege // J. Gastrointest. Surg. — 2000. — Vol. 4. — P. 185-192.
13. Serum concentrations of tumour necrosis factor-alpha (TNF-alpha) and soluble TNF-alpha receptor p55 in patients with hypothyroidism and hyperthyroidism before and after normalization of thyroid function / J.J. Díez, A. Hernanz, S. Medina et al. // Clin. Endocrinol. (Oxf.). — 2002. — Vol. 57(4). — P. 515-521.
14. Steatocholecystitis: The Influence of Obesity and Dietary Carbohydrates / A. Mathur, H.H. Al-Azzawi, D. Lu et al. // J. Surg. Res. — 2008 — Vol. 147(2). — P. 290-297.
15. Suh S. Subclinical Hypothyroidism and Cardiovascular Disease / S. Suh, D.K. Kim // Endocrinol. Metab. — 2015. — Vol. 10. — P. 25-29.
16. Tang K.-T. Tumor necrosis factor-α and interferon-γ modulate gene expression of type I 5′-deiodinase, thyroid peroxidase, and thyroglobulin in FRTL-5 rat thyroid cells / K.-T. Tang, L.E. Braverman, W.J. De Vito // Endocrinology. — 1995. — Vol. 136(3). — P. 881-888.
17. The cytokine profile in the patients with acute calculous cholecystitis and correction of its disorders / D.N. Gadzhiev, É.G. Tagiev, A.G. Guseĭnaliev et al. // Klin. Khir. — 2013. — Vol. 4. — P. 17-19.
18. Thyroid hormones as modulators of immune activities at the cellular level / P. De Vito, S. Incerpi, J.Z. Pedersen et al. // Thyroid. — 2011. — Vol. 21(8). — P. 879-890.
19. Visfatin, leptin, and TNF-α: interrelated adipokines in insulin-resistant clinical and subclinical hypothyroidism / S. Guzel, A. Seven, E.C. Guzel et al. // Endocr. Res. — 2013. — Vol. 3 — P. 23-27.

/132.jpg)