Статтю опубліковано на с. 159-167
Вступ
Збагачена тромбоцитами плазма (platelet-rich plasma, PRP) — це отриманий із автологічної крові продукт, що містить тромбоцити в концентрації більшій, ніж у нативній крові [1]. PRP отримують шляхом центрифугування венозної крові, в результаті якого відбувається розділення різних компонентів крові, відповідно до їх специфічної ваги. Завдяки низькій вартості, доступності та безпечності PRP розглядається як перспективний метод отримання автологічних факторів росту та впливу на перебіг репаративних процесів у різних галузях медицини.
Лікувальний потенціал PRP базується на факторах росту, що містяться головним чином в альфа-гранулах тромбоцитів [2]. Це трансформуючий фактор росту бета (TGF-β) [3], фактор росту ендотелію судин (VEGF) [4], тромбоцитарний фактор росту (PDGF) [5] та інші (IGF-1, FGF, EGF). Фактори росту вивільняються при дегрануляції тромбоцитів у місці ушкодження та підсилюють регенерацію тканин, стимулюючи клітинну проліферацію, синтез екстрацелюлярного матриксу, проростання судин тощо. Гранули тромбоцитів також є джерелом цитокінів, хемокінів і багатьох інших протеїнів, що стимулюють проліферацію та дозрівання клітин, модулюють запальну реакцію [6].
Після концентрування та активації тромбоцитів концентрація факторів росту, що виділяються, зростає у 3–5 разів порівняно з їх концентрацією в плазмі крові [7]. Автори вказують на наявність позитивних кореляцій між рівнем факторів росту і загальною кількістю тромбоцитів у PRP. Зокрема це доведено для TGF-β1 та PDGF, хоча і не підтверджується для інсуліноподібного фактора росту [8].
Водночас оптимальна концентрація клітинних елементів у тромбоцитарних концентратах є предметом наукової дискусії та численних досліджень, результати яких неоднозначні [9, 10]. За визначенням Marx [11], плазма, збагачена тромбоцитами, має містити не менше ніж в 4–5 разів більшу їх кількість, ніж нативна плазма (в якій концентрація тромбоцитів становить 150–350 × 109/л). Однак клінічні та експериментальні дослідження останніх років засвідчили, що оптимальний вплив на регенерацію кісткової тканини досягається лише в певному діапазоні концентрації тромбоцитів (від 500 × 109 до 1000 × 109/л) [2, 12]. Зменшення концентрації тромбоцитів призводить до зменшення ефективності застосування PRP, а надмірне збільшення якісно змінює її дію, пригнічує клітинну проліферацію та інгібує репаративні процеси в кістковій і сполучній тканині [2, 12, 13].
Одним із найбільш поширених методів отримання тромбоцитарних концентратів є методика PRGF Endoret (Plasma Rich in Growth Factors), запропонована Інститутом біотехнології BTI (Vitoria, Іспанія). Це плазма, збагачена тромбоцитами, циркулюючими протеїнами і факторами росту. Протокол її отримання передбачає використання спеціальних пробірок із наступним однократним центрифугуванням і активацією хлоридом кальцію [14].
PRGF вивчалась багатьма дослідниками, і отримані результати переконливо свідчать, що вона здатна стимулювати остеогенез та ангіогенез, підвищує проліферацію, міграцію та хемотаксис остеобластів, створює фібринову матрицю, що сприяє клітинній міграції [9]. Ця тривимірна фібринова сітка може виступати носієм для низькодиференційованих –клітин-попередників та створює контрольовану систему доставки протеїнів [1, 7]. Крім того, PRGF підвищує автокринну експресію двох проангіогенних факторів: судинного ендотеліального фактора росту та фактора росту гепатоцитів, а також трьох маркерів остеобластичної активності: проколагену І, остеокальцину та лужної фосфатази [15].
За даними авторів, дотримання протоколу PRGF Endoret дозволяє в більшості випадків отримати оптимальну концентрацію тромбоцитів (до 500 тис/мл і більше) [15]. Водночас вплив індивідуальної варіації та чинників, від яких залежать клінічні, гематологічні та біохімічні параметри пацієнта, на концентрацію тромбоцитів в PRGF залишається недостатньо вивченим.
Мета дослідження: вивчити вміст тромбоцитів у PRGF Endoret, отриманої за стандартним протоколом, та їх функціональні властивості залежно від індивідуальних гематологічних параметрів пацієнта.
Матеріали та методи
У дослідження було включено 30 пацієнтів, які лікувались на базі Київського обласного центру щелепно-лицевої хірургії та стоматології з приводу посттравматичних і післяопераційних дефектів верхньої та нижньої щелепи, віком від 17 до 70 років. Середній вік хворих становив 36,2 ± 13,4 року. Чоловіків 43,3 % від загальної кількості обстежених.
Усім хворим перед хірургічними втручаннями було проведено комплексне клініко-лабораторне дослідження, що включало клінічний аналіз крові (18 показників), аналіз коагулограми та вивчення індукованої агрегації тромбоцитів плазми (агрегатограми). Ми вважали, що для оцінки функціональних властивостей тромбоцитів доцільно враховувати особливості їх агрегації, механізми і типи активації рецепторів, завдяки яким настає агрегація тромбоцитів, параметри міцності створеного згустка і його дезагрегації. Для цього ми розробили власний алгоритм розрахунку сумарного індексу функціональної активності тромбоцитів (ІФАТ) за допомогою індукованої агрегації адреналіном та аденозиндифосфатом у сукупності із врахуванням особливостей їх дезагрегації.
Під час хірургічного втручання щодо заміщення дефектів усім хворим були виготовлені дві фракції плазми за методикою PRGF (Endoret Dentistry, BTI Biotechnology Institute, S.L., Miñano, Álava, Spain) (Vitoria, Іспанія) [14]. Протокол їх отримання передбачав використання пробірок із 0,9 мл 3,8% цитрату натрію на 8,1 мл крові з наступним центрифугуванням (580 g) протягом 8 хвилин при кімнатній температурі, використовуючи центрифугу для PRGF System IV (ВТІ, Іспанія). Отриману плазму розділяли на дві фракції (F1 та F2) за допомогою пристрою для переміщення плазми PTD2. Фракція F2 являла собою плазму, збагачену факторами росту, — тромбоцитарний концентрат із найбільшим вмістом тромбоцитів. Натомість фракцію F1, бідну тромбоцитами, використовували для виготовлення фібринової мембрани. Для активації коагуляції і формування згустка або фібринової мембрани у відібрані фракції додавали хлорид кальцію (0,5 мл на 1 мл плазми) і досягали необхідного ефекту протягом 10 хв.
Перед активацією відбирали проби з фракцій F1 та F2 для проведення аналізу на вміст тромбоцитів та інших формених елементів крові, а також досліджували морфологію фібринової мембрани. Концентруючу здатність метода (коефіцієнт концентрування) визначали як відношення загальної кількості тромбоцитів у фракції F2 (PRGF) до загальної кількості тромбоцитів у крові.
Серед усіх пролікованих пацієнтів PRGF використовували як самостійний метод заміщення дефекту у 83 % випадків, поєднували із застосуванням кісткових автотрансплантатів — у 3 % та ксеногенних кістково-заміщуючих матеріалів — у 14 % випадків. У післяопераційному періоді враховували наявність чи відсутність ускладнень, пов’язаних із відторгненням або експозицією трансплантатів, приєднанням гнійно-запальних процесів у післяопераційному періоді та уповільненням репаративних процесів. Визначали строки появи грануляцій та повної епітелізації ран, окрім того, використовуючи метод експертних оцінок, визначали інтегральний результат загоєння операційної рани як добрий (3 бали), задовільний (2 бали), уповільнений (1 бал), незадовільний (0 балів).
Статистичні розрахунки проводили в програмному середовищі SPSS Statistics (IBM SPSS, США). Для визначення характеру розподілу вибірки застосовували критерій перевірки нормальності Колмогорова — Смірнова. Оцінка вірогідності розбіжностей між вмістом клітинних елементів у крові та фракціях плазми після центрифугування базувалась на використанні критерію Манна — Уітні та критерію Ст’юдента (лише для показників, що мали нормальний характер розподілу) [16, 17].
Для вивчення статистичних взаємозв’язків між окремими клінічними, біохімічними та гематологічними параметрами розраховували коефіцієнт кореляції Пірсона та встановлювали рівень його значимості [18].
Для описання статистичних зв’язків між певними параметрами проводили їх регресійний аналіз у програмному середовищі Origin 7.0 (OriginLab, США), використовуючи лінійно-регресійну модель, після чого визначали стандартні похибки коефіцієнтів регресії, їх вірогідність та довірчий інтервал для лінії регресії.
Результати
За даними лабораторного дослідження, кількість тромбоцитів у крові (PLT) у всіх хворих була у межах рекомендованих референтних значень, з коливанням 174–356 × 109/л, а в середньому становила 260,76 ± 44 × 109/л. Вміст тромбоцитів у PRGF після центрифугування (фракція F2), як правило, перевищував вміст тромбоцитів у нативній крові та в середньому становив 388 ± 186 × 109/л проти 260 ± 44 × 109/л (відмінності вірогідні з р < 0,05). Збільшення концентрації тромбоцитів більш ніж у 2 рази відзначали у 17 % хворих, а від 1,4 до 2 разів — у 30 % хворих. У інших пацієнтів концентрація тромбоцитів зростала незначною мірою або навіть дещо зменшувалась. Співвідношення між вмістом тромбоцитів у фракції F2 та нативній крові, що характеризувало концентруючу здатність методики PRGF Endoret, в середньому становило 1,48. Діапазон індивідуальних коливань вмісту тромбоцитів в PRGF був досить значним: від 155 × 109/л до 919 × 109/л.
Вміст тромбоцитів у фракції F1 (бідна тромбоцитами плазма) виявлявся в середньому в 1,3 раза меншим, ніж у нативній крові (р < 0,05), і зазнавав значних індивідуальних коливань. Співвідношення між вмістом тромбоцитів у фракціях F1 та F2 змінювалось у межах 1,2–3,9, а в середньому становило 2,01 раза.
Середній об’єм тромбоцитів (MPV), що відображає їх розмір та ступінь активації в ході центрифугування, мав тенденцію до зменшення, але відмінності між нативною кров’ю та PRGF за цим показником виявлялися невірогідними. Вміст лейкоцитів у PRGF (фракція F2) був мінімальним (в середньому 0,36 ± 0,23) і не перевищував 5 % від їх вмісту в крові (табл. 1), а у фракції F1 лейкоцити були практично відсутні.
Морфологічне дослідження фібринової мембрани, яку отримували за методикою PRGF Endoret, виявило значну схожість структури і відсутність вірогідної різниці у будові сітки, її наповненні волокнами чи гранулами, розташуванні волокон нерозчинного фібрину та їх послідовності у фракціях F1 та F2. Фібринові мембрани, одержані від різних пацієнтів, мали однакову консистенцію і подібну мікроскопічну структуру (рис. 2).
Вплив біохімічних показників на співвідношення тромбоцитів у нативній крові та PRGF, що характеризує концентруючу здатність методики, виявився незначним. Найбільше значення мали вміст аспартатамінотрансферази (прямий зв’язок) та рівень глюкози (зворотний зв’язок), що за даної кількості спостережень виявились невірогідними. Серед показників коагулограми виявлено вірогідний зворотний зв’язок між вмістом фібриногену та концентрацією тромбоцитів у фракції F2 (r = –0,683; p < 0,05), а також вмістом фібриногену та коефіцієнтом концентрування F2/PLT (r = –0,748; p < 0,05).
Середній об’єм тромбоцитів, їх морфологічні характеристики та тромбокрит вірогідно не впливали на концентруючу здатність методики. Вихідний рівень тромбоцитів вірогідно позначався на їх концентрації у фракції F2 (r = 0,44; p < 0,05) та F1 (r = 0,532; p < 0,05), але не мав вірогідного впливу на коефіцієнт концентрування та співвідношення тромбоцитів у фракціях PRGF.
У ході дослідження було виявлено вірогідні зв’язки між гематокритом (і, відповідно, вмістом еритроцитів і лейкоцитів у крові) та концентрацією тромбоцитів у PRGF, співвідношенням вмісту тромбоцитів у F1 і F2, а також концентруючою здатністю методики. Збільшення гематокриту супроводжувалось збільшенням концентрації тромбоцитів у фракції F2 та зменшенням співвідношення F2/F1.
Таким чином, основними чинниками, що визначали вміст тромбоцитів у плазмі, збагаченій факторами росту, були вихідний вміст тромбоцитів у крові, гематокрит і концентрація фібриногену.
Дослідження функціональної активності тромбоцитів за результатами агрегатограми виявили наступне. Значення ІФАТ, розраховане за даними агрегатограми із двома індукторами, змінювалось в діапазоні 1,13–0,41, із модою (Мо) = 0,79. За таких значень система гемостазу була збалансована, із невеликим превалюванням часу та швидкості агрегації над дезагрегацією, а коливання ІФАТ не виходили за межі фізіологічного діапазону. При цьому з анамнезу у хворих не було виявлено ознак порушення гемо–стазу або скарг з боку системи згортання крові, а під час проведення операцій не спостерігали інтенсивної кровотечі, зумовленої порушеннями згортання крові.
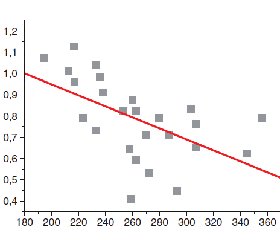
При вилученні з вибірки тих випадків, коли гіперагрегаційні властивості тромбоцитів пацієнтів співпадали із підвищеною кількістю PLT або їх гіпоагрегаційні властивості супроводжувалися низьким значенням PLT (випадаючі значення), виявлено вірогідний зворотний кореляційний зв’язок (r = –0,55; р = 0,01) між вмістом тромбоцитів (PLT) та ІФАТ. Це свідчило, що в популяції в більшості спостережень при зменшенні кількості тромбоцитів в плазмі крові їх функціональна активність зростала (рис. 3).
При співставленні вмісту тромбоцитів у PRGF закономірність була подібною: існував статистично вірогідний зворотний кореляційний зв’язок між функціональними властивостями тромбоцитів за ІФАТ та їх концентрацією у фракції F2 (r = –0,39; р = 0,05) (рис. 4).
Таким чином, якщо тромбоцити мали високу активність перш за все до агрегації, їх кількість у фракції F2 була зменшена, і навпаки, тромбоцитів із низькою активністю у F2 виявлялось більше. Водночас вірогідного зв’язку між функціональною активністю тромбоцитів і коефіцієнтом концентрування та вмістом тромбоцитів у фракції F1 виявлено не було.
Клінічні спостереження виявили, що у 93,3 % хворих у ході лікування було досягнуто хороших або задовільних результатів. Ускладнення у вигляді розходження країв рани та часткового руйнування тромбоцитарного згустка були відзначені в одного хворого (3,3 %), причому їх негативні наслідки не потребували проведення повторних хірургічних втручань і були ліквідовані консервативними методами, окрім того, у одного хворого (3,3 %) відзначали уповільнення загоєння рани, що відбувалось на тлі наявної супутньої соматичної патології (вроджена нейтропенія). При проведенні кореляційного аналізу вірогідних зв’язків між вмістом тромбоцитів у фракції F2 та клінічною ефективністю застосування PRGF виявлено не було. У всіх хворих вираженість больового синдрому та набряку в післяопераційному періоді була низькою або помірною, строки епітелізації ран не залежали від вмісту тромбоцитів у PRGF, а визначалися головним чином особливостями клінічної картини та характером проведеного хірургічного втручання. Вірогідного впливу функціональної активності тромбоцитів (ІФАТ) на клінічні показники також не було виявлено.
Обговорення
Оптимальний вміст клітинних елементів у тромбоцитарних концентратах залишається предметом наукової дискусії, це відноситься до вмісту як тромбоцитів, так і лейкоцитів. У ранніх роботах, присвячених PRP, вважалося, що клінічний ефект препарату, ступінь його активуючого впливу на проліферацію та диференціювання клітин пропорційний концентрації тромбоцитів в ньому [19]. У зв’язку із цим автори вважали за необхідне при отриманні PRP досягати високих концентрацій тромбоцитів (1 000 000/μL та більше) [11]. Оскільки у здорових осіб у нормі вміст тромбоцитів становить від 150 000 дo 350 000/μL, то досягнення їх необхідної концентрації в PRP потребувало обов’язкового подвійного центрифугування, що не тільки ускладнювало методику, але й закономірно призводило до морфологічних і функціональних змін у тромбоцитах, що виникали в процесі отримання препарату.
Роботами останніх років було доведено, що концентрація тромбоцитів, яка забезпечує позитивний вплив на регенерацію кістки, сполучної тканини і певною мірою епітелію, перебуває в межах 500 000–1 000 000/µL [2, 12]. Ці дані визначили тенденцію до зміни протоколів отримання PRP на користь методів, що використовують одне центрифугування. Зокрема до них належить методика PRGF Endoret.
За даними E. Anitua, методика дозволяє отримувати тромбоцитарні концентрати із середнім вмістом тромбоцитів на рівні 500 000 у фракції F2 [15]. Аналогічні дані отримав G. Weibrich при вихідному рівні тромбоцитів у донорській крові 274 ± 54 × 109/л, їх концентрація в PRGF становила 513 ± 139 × 109/л [12]. Концентрація тромбоцитів у PRGF, отриманої в нашому дослідженні, виявилась дещо нижчою: в середньому вона становила 388 ± 186 × 109/л і лише у 20 % випадків перевищувала 500 × 109/л, що ми пов’язували із тим, що вихідна кількість тромбоцитів у крові пацієнтів із тяжкими захворюваннями щелепно-лицевої ділянки, особливо на тлі наявної соматичної патології (у 52 %) та прийому препаратів, здатних впливати на агрегацію тромбоцитів та гематокрит, була меншою, ніж у здорових донорів, яких досліджували автори. Водночас концентрація тромбоцитів в плазмі, збагаченій факторами росту, яку отримували у хворих, здебільшого перебувала в межах оптимального/субоптимального діапазону, хоча і зазнавала значних індивідуальних коливань.
Індивідуальна варіативність була притаманна не тільки для абсолютної кількості тромбоцитів у PRGF, але й для концентраційної здатності методики. І хоча в більшості випадків концентрація тромбоцитів зростала в 1,5–2 рази і більше, в окремих спостереженнях вона майже не відрізнялася від їх концентрації в нативній крові або навіть була нижчою. Дуже варіабельним виявлявся вміст тромбоцитів у бідній тромбоцитами фракції F1, який в окремих спостереженнях практично не відрізнявся від фракції F2, а в інших випадках виявлявся значно нижчим.
До останнього часу в літературі автори звертали увагу на залежність концентрації тромбоцитів у PRP від методики її отримання (зокрема, режиму центрифугування, форми і розміру пробірок, застосованого антикоагулянту тощо) [5, 8, 15]. Однак отримані нами дані свідчать про значну варіабельність вмісту тромбоцитів у препараті, отриманому за однією стандартизованою методикою. Властивості крові пацієнта виявились важливим чинником, що визначає кінцеві параметри отриманого тромбоцитарного концентрату, і можуть мати не менше значення, ніж застосована технологія.
Слід зазначити, що вплив індивідуальних параметрів пацієнта на властивості тромбоцитарних концентратів є практично не вивченим, існують лише поодинокі дослідження, результати яких неоднозначні. Більшість з них підтверджують залежність між вихідною кількістю тромбоцитів у плазмі та її вмістом у PRP при застосуванні переважної більшості методів їх концентрування [20, 21]. M.G. De Andrade (2008) на тваринній моделі визначив, що кількість тромбоцитів у PRP серед інших гематологічних показників найбільшою мірою залежить від гематокриту і вихідного рівня тромбоцитів у плазмі та практично не залежить від коагуляційних властивостей крові [20].
За нашими даними, основними чинниками, що визначали вміст тромбоцитів у плазмі, збагаченій факторами росту, були вихідний вміст тромбоцитів у крові, гематокрит і концентрація фібриногену. Вихідна концентрація тромбоцитів вірогідно впливала на їх вміст у багатій факторами росту фракції F2, але фактично не позначалася на концентруючій здатності методики. Вплив гематокриту та вмісту формених елементів у крові (еритроцитів і лейкоцитів) був більш значущим. Загалом існувала тенденція до збільшення концентрації тромбоцитів при зменшенні відносного об’єму рідкої плазми, але при цьому розбіжності у вмісті тромбоцитів у фракції F1 та F2 зменшувались. Отже, у клінічній практиці слід враховувати, що лікувальні засоби (інфузійна терапія), які впливають на показник гематокриту, а також зміни водно-електролітного балансу (зневоднення) можуть суттєво позначатися на властивостях отриманих тромбоцитарних концентратів і їх клінічній ефективності.
Важливим параметром PRGF був вміст лейкоцитів, що виявився дуже низьким у всіх спостереженнях. Це узгоджується з даними E. Anitua та M. Zalduendo (2015), які виявили лише мінімальні домішки лейкоцитів у PRGF [14, 25].
Хоча оптимальний вміст лейкоцитів у тромбоцитарних концентратах є предметом дискусії, а рекомендації авторів часто носять діаметрально протилежний характер, втім, за останніми даними, наявність лейкоцитів у тромбоцитарних концентратах може негативно впливати на їх клінічну ефективність у зв’язку із потенційним ризиком стимуляції запального процесу після введення в зону хірургічного втручання та фібринолітичним ефектом лейкоцитів [23]. Останні дослідження E. Anitua (2015) свідчать, що наявність лейкоцитів в гелі або мембрані PRP/PRF в умовах стимуляції бактеріальними антигенами зменшує стабільність фібринової матриці за рахунок активації протеолітичних/фібринолітичних ферментів, що містяться в лейкоцитах. Крім того, наявність лейкоцитів та еритроцитів у препаратах PRP/PRF змінює тривимірну структуру фібринової матриці, порушуючи утворення міжфібрилярних зв’язків, що позначається на її механічних властивостях (гранична/максимальна деформація при розтягу зменшується в середньому на 28 %) [15]. Отже, прогнозовано низький вміст лейкоцитів у плазмі, збагаченій факторами росту, незалежно від індивідуальних варіацій клінічних, гематологічних і біохімічних показників пацієнта може розглядатися як суттєва перевага метода.
Клінічне застосування плазми, збагаченої факторами росту, за нашими даними, дозволило досягти добрих або задовільних результатів у абсолютної більшості прооперованих пацієнтів. Це узгоджується із даними Е. Anitua, який довів позитивний вплив PRGF на загоєння кісткових дефектів та епітелізацію ран слизової оболонки порожнини рота [24].
Водночас нами не було виявлено статистично вірогідних зв’язків між кількістю тромбоцитів у препараті та його клінічною ефективністю. Цей факт може бути поясненим на основі сучасних уявлень про механізми підтримки гомеостазу системи крові. Відомо, що між загальною кількістю тромбоцитів та їх середнім об’ємом існує нелінійний зворотний зв’язок, що з біологічної точки зору забезпечує перебіг процесів агрегації тромбоцитів, згортання крові та наступної стимуляції регенераторних процесів у межах фізіологічного діапазону, незалежно від індивідуальних коливань показника PLT [22]. У більшості хворих у фізіологічних межах коливання кількості тромбоцитів крові був виявлений зворотний зв’язок між функціональними, в першу чергу агрегаційними, властивостями тромбоцитів та їх концентрацією. При виготовленні плазми, збагаченої факторами росту, зворотний зв’язок між кількістю тромбоцитів у фракції F2, що забезпечує найбільший вплив на перебіг репаративних процесів, та функціональною активністю тромбоцитів зберігався. Отже, менша кількість тромбоцитів у нативній крові та плазмі, збагаченій факторами росту, в нормі компенсується їх підвищеною функціональною, зокрема агрегаційною, активністю. Саме тому в наших спостереженнях, де пацієнти суттєво розрізнялися за результатами агрегатограми та вмістом тромбоцитів, клінічна ефективність методики була практично однаковою.
З цієї точки зору досягнення великої концентрації тромбоцитів (більш 500 × 109/л) при виготовленні PRGF Endoret не можна розглядати як провідний фактор її ефективності. Клінічний ефект PRGF є результатом дії «коктейлю» факторів — тромбоцитарних факторів росту та розчинних в плазмі білків і цитокінів, що забезпечують формування та дозрівання сполучної, кісткової, епітеліальної тканини та фібрину. Останній у ході активації та формування згустка формує зв’язки, що забезпечує утворення складної тривимірної сітчастої структури, здатної затримувати цитокіни, фактори росту й інші біологічно активні речовини та забезпечувати міграцію клітин. Вміст фібрину в плазмі вірогідно позначається на концентруючій здатності метода, однак морфологічні характеристики фібринової матриці при застосуванні методики PRGF Endoret практично не залежали від індивідуальних параметрів крові пацієнта, вмісту та функціональної активності тромбоцитів у фракціях F2 та F1.
Нами встановлено, що у частини пацієнтів (15–20 %) зворотна залежність між вмістом і функціональною активністю тромбоцитів не відзначається. В цих випадках застосування методики PRGF має свої біологічно обґрунтовані особливості. У випадках, коли гіперактивні властивості тромбоцитів співпадають із їх початковою підвищеною кількістю у крові, на нашу думку, доцільно використовувати плазму за методикою PRGF Endoret без поділення на фракції (бідна факторами росту фракція F1 матиме в цих випадках достатній стимулюючий вплив на перебіг репаративних процесів, остеогенезу та ангіогенезу тощо). У випадках, коли у пацієнтів визначається гіпоактивність тромбоцитів, а їх кількість знаходиться у нижній межі, доцільно використовувати збільшену (подвійну) кількість F2 для забезпечення необхідного лікувального ефекту і створення достатньої концентрації факторів росту.
Таким чином, для практичного використання методики PRGF Endoret важливою є попередня оцінка кількості тромбоцитів у крові пацієнта та її співставлення із функціональною активністю за даними агрегатограми, що дозволяє обрати правильну лікувальну стратегію та визначити прогноз клінічної ефективності її застосування.
Висновки
1. Вміст тромбоцитів у фракціях F1 і F2 плазми, збагаченої факторами росту (PRGF Endoret), зазнає значних індивідуальних коливань у межах від 155 × 109/л до 919 × 109/л, коефіцієнт концентрування при цьому в середньому становить 1,48.
2. Основними чинниками, що впливають на вміст тромбоцитів у плазмі, збагаченій факторами росту, та концентраційну здатність методики, є вихідний вміст тромбоцитів у крові, гематокрит і концентрація фібриногену.
3. Для більшості пацієнтів існує зворотний кореляційний зв’язок між кількістю тромбоцитів у нативній крові, плазмі, збагаченій факторами росту, та їх функціональною (агрегаційною) активністю, що визначає високу клінічну ефективність PRGF Endoret навіть у випадках, коли концентрація тромбоцитів після центрифугування зростає незначною мірою.
4. У нестандартних випадках, коли гіперактивні властивості тромбоцитів співпадають із їх початковою підвищеною кількістю у крові, можливо використовувати плазму за методикою PRGF Endoret без поділення на фракції. У випадках, коли у пацієнта визначається гіпоактивність тромбоцитів і кількість тромбоцитів крові знаходиться у нижній межі, доцільно використовувати більший (подвійний) об’єм плазми, збагаченої факторами росту (фракція F2), для забезпечення необхідного лікувального ефекту.
5. При застосуванні методики PRGF Endoret доцільно попереднє визначення вихідного рівня тромбоцитів крові та її співставлення із функціональною активністю за даними агрегатограми, що дозволяє обрати правильну лікувальну стратегію та визначити прогноз її клінічної ефективності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. The use of platelet-rich plasma in plastic surgery: a systematic review / C.E. Sommeling, A. Heyneman, H. Hoeksema, J. Verbelen, F.B. Stillaert, S. Monstrey // Journal of Plastic, Reconstructive & Aesthetic Surgery. — 2013. — Vol. 66, № 3. — P. 301-311.
2. Platelet concentration in platelet concentrates and perio–dontal regeneration-unscrambling the ambiguity / A. Suchetha, P. Lakshmi, D. Bhat, D.B. Mundinamane, K.V. Soorya, G. Ashit // Bharwani Contemp. Clin. Dent. — Oct-Dec 2015. — Vol. 6, № 4. — P. 510-516.
3. Hsu C.W. The negative effect of platelet-rich plasma on the growth of human cells is associated with secreted thrombo–spondin-1 / C.W. Hsu, K. Yuan, C.C. Tseng // Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. — 2009. — № 107. — P. 185-92.
4. Platelet concentration in platelet-rich plasma affects tenocyte behavior in vitro / I. Giusti, S. D’Ascenzo, A. Mancò, G. Di Stefano, M. Di Francesco, A. Rughetti, A. Dal Mas, G. Properzi, V. Calvisi, V. Dolo // Biomed. Res. Int. — Jul. 2014.
5. Comparison of the platelet concentrate collection system with the plasma-rich-in-growth-factors kit to produce platelet-rich plasma: a technical report / G. Weibrich, W.K. Kleis, W.E. Hitzler, G. Hafner // J. Oral. Maxillofac. Implants. — Jan-Feb 2005. — Vol. 20, № 1. — P. 118-123.
6. Regenerative surgery performed with platelet-rich plasma used in sinus lift elevation before dental implant surgery: an useful aid in healing and regeneration of bone tissue / Inchingolo F., Tatullo M., Marrelli M. [et al.] // Eur. Rev. Med. Pharmacol. Sci. — 2012. — Vol. 16, № 9. — P. 1222-6.
7. Platelet-rich plasma: from basic science to clinical applications / T.E. Foster, B.L. Puskas, B.R. Mandelbaum, M.B. Gerhardt, S.A. Rodeo // American Journal of Sports Medicine. — 2009. — Vol. 37, № 11. — P. 2259-2272.
8. Giraldo C.E. Effects of sodium citrate and acid citrate dextrose solutions on cell counts and growth factor release from equine pure-platelet rich plasma and pure-platelet rich gel / C.E. Giraldo // BMC Vet. Res. — Mar 2015. — № 11. — P. 60.
9. Marx R.E. Platelet-rich plasma: evidence to support its use / R.E. Marx // J. Oral Maxillofac. Surg. — 2004. — № 62. — P. 489-496.
10. McCarrel T.M. Optimization of leukocyte concentration in platelet-rich plasma for the treatment of tendinopathy / T.M. McCarrel, T. Minas, L.A. Fortier // J. Bone Joint Surg. Am. — 2012. — № 94. — P. 143.
11. Marx R.E. Platelet-rich plasma (PRP): what is PRP and what is not PRP? / R.E. Marx // Implant. Dent. — 2001. — № 10. — P. 225-228.
12. Effect of platelet concentration in platelet-rich plasma on peri-implant bone regeneration / G. Weibrich, T. Hansen, W. Kleis, R. Buch, W.E. Hitzler // J. Bone. — 2004. — № 34. — P. 665-671.
13. Poor standardization in platelet-rich therapies hampers advancement / E. Lopez-Vidriero, K.A. Goulding, D.A. Simon, D.H. Johnson, M. Sanchez // Arthroscopy: The Journal of Arthroscopic and Related Surgery. — 2010. — Vol. 26, № 6. — P. 724-725.
14. Implementation of more physiological plasma rich in growth factor (PRGF) protocol: Anticoagulant removal and reduction in activator concentration / E. Anitua, R. Prado, M. Troya [et al.] // J. Platelets. — 2016. — Vol. 27, № 5. — P. 459-466.
15. Anitua E. Endogenous morphogens and fibrin bioscaffolds for stem cell therapeutics / E. Anitua, R. Prado, G. Orive // Trends in Biotechnology. — 2013. — Vol. 31, № 6. — P. 364-374.
16. Armitage P., Berry G., Matthews J.N.S. Statistical me–thods in medical research. — 4th edition. — Oxford, England: Blackwell Scientific Publications, 2002.
17. Блэнд M. Введение в медицинской статистике. — 3-е изд. — Oxford: Oxford, 2000.
18. Овчаров А.О. Актуальные проблемы современных научных исследований: методология, экономика, статистика: сборник статей. — М., 2013.
19. The effect of the platelet concentration in platelet-rich plasma gel on the regeneration of bone / M. Kawasumi, H. Kitoh, K.A. Siwicka, N. Ishiguro // Bone Joint Surg. Br. — 2008. — № 90. — P. 966-972.
20. Evaluation of factors that can modify platelet-rich plasma properties / M.G. De Andrade, C.J. Freitas Brandão, C.N. Sá, T.C. de Bittencourt, M. Sadigursky // Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. — 2008. — № 105. — P. 5-12.
21. Correlation of platelet concentration in platelet-rich plasma to the extraction method, age, sex, and platelet count of the donor / G. Weibrich, W.K. Kleis, M. Kunz-Kostomanolakis, A.H. Loos, W. Wagner // J. Oral Maxillofac. Implants. — Sep-Oct 2001. — Vol. 16, № 5. — P. 693-699.
22. Bessman J.D. Mean platelet volume. The inverse relation of platelet size and count in normal subjects, and an artifact of other particles / J.D. Bessman, L.J. Williams, P.R. Gilmer // J. Clin. Pathol. — Sep 1981. — Vol. 76, № 3. — P. 289-293.
23. Growth fаctor and catabolic cytocine concentrations are infl–uenced by the cellular composition of platelet-rich plasma / Sundman E.A. [et al.] // J. Sports Med. — 2011. — Vol. 39, № 10. — P. 2135-40.
24. Anitua E. The use of plasma-rich growth factors (PRGF) in oral surgery / E. Anitua // J. Pract. Proced. Aesthet. Dent. — Aug 2001. — Vol. 5, № 6. — P. 487-493.
25. Graves D.T. Biologically active mediators: platelet-derived growth factor, monocyte chemoattractant protein-1 and transforming growth factor-beta / D.T. Graves, D.L. Cochran // Curr. Opin. Dent. — 1991. — № 1. — P. 809-815.
26. Platelet-rich plasma obtained with different anticoagulants and their effect on platelet numbers and mesenchymal stromal cells behavior in vitro / R.J.F.C. do Amaral, N.P. da Silva, N.F. Haddad, L.S. Lopes, F.D. Ferreira, R.B. Filho, P.A. Cappelletti, W. de Mello, E. Cordeiro-Spinetti, A. Balduino // Stem. Cells. Int. — Jun 2016.
27. Critical role of transforming growth factor beta in different phases of wound healing / M. Pakyari, A. Farrokhi, M.K. Maharlooei, A. Ghahary // Advances in Wound Care. — 2013. — Vol. 2, № 5. — P. 215-224.
28. Holmes D.I.R. The vascular endothelial growth factor (VEGF) family: angiogenic factors in health and disease / D.I.R. Holmes, I. Zachary // Genome Biology. — 2005. — № 2. — Art. 209.
29. Милодаров М.Ю. Влияние тромбоцитов и процесса их агрегации на межэритроцитарные взаимодействия / Милорадов М.Ю. [и др.] // Ярославский педагогический вестник. — 2013. — Т. ІІІ, № 4. — С. 209-214.
30. Кеян Д.Н. Использование обогащенной тромбоцитами аутоплазмы крови для хирургического лечения радикулярных кист челюстей / Д.Н. Кеян // Матеріали міжнародної науково-практичної конференції «Сучасна стоматологія та щелепно-лицева хірургія». — К., 2013. — С. 88-89.
31. Biloklytska G.F. The use of platelet-rich plasma (PRP) for treatment of generalized periodontitis / G.F. Biloklytska, O.V. Kopchak // Stomatologia wspotczesna. — 2014. — Vol. 21, № 3. — Р. 8-17.

/161-1.gif)
/162.gif)