Журнал «Медицина неотложных состояний» №2(97), 2019
Вернуться к номеру
Аналіз геморагічних і тромбоемболічних ускладнень у пацієнтів з імплантованими пристроями механічної підтримки лівого шлуночка
Авторы: Мазуренко О.П.(1, 2), Надзякевич П.(2), Лоскутов О.А.(1), Згржебловська Л.В.(1)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) — Silesian Centre Heart Diseases, Department Kardioanesthesiology SUM, ICU SCCS, Poland
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Робота присвячена вивченню геморагічних та тромбоемболічних ускладнень у ранньому післяопераційному періоді в пацієнтів з імплантованими приладами механічної підтримки лівого шлуночка (LVAD). У дослідження увійшли 10 пацієнтів чоловічої статті віком 55,0 ± 13,5 року з індексом маси тіла 30,8 ± 8,3, з фракцією викиду лівого шлуночка від 9 до 28 %, яким у період із 11.03.2016 по 22.11.2017 року у Силезькому центрі хвороб серця (Польща) в умовах штучного кровообігу було встановлено LVAD. В ранньому післяопераційному періоді хворі щодоби отримували антикоагулянтну цільову терапію, до якої входили: гепарин (6–11 Од/кг/год), аспірин (75–150 мг), клопідогрель (75–150 мг), варфарин (1,5–7 мг), надропарин кальцію (0,3–0,6 мл 2 р/д), фондапаринукс натрію (2,5–5 мг 2 р/д). Два пацієнти отримували моногепаринотерапію, один пацієнт отримував монотерапію варфарином упродовж 14 днів. Інші пацієнти упродовж того ж терміну отримували комбіновану терапію з гепарином у перші три доби з наступним переходом на варфарин, аспірин, клопідогрель, фраксипарин або блокатор тромбіну. Механічна підтримка лівого шлуночка здійснювалась принципово двома різними імплантованими системами, що виконують одну функцію підтримки лівого шлуночка: POLVAD — програмно-контрольованою пневматично-мембранною механічною циркуляцією крові (2 пацієнти) та LVAD — програмно-контрольованою електроцентрифужною циркуляцією (8 пацієнтів). Тривалість підтримки системою POLVAD становила від 102 до 156 днів. Тривалість підтримки системою LVAD — від 20 до 78 днів. Порівняння проаналізованих результатів дозволило дійти висновків, що антикоагулянтна монотерапія гепарином або варфарином призводить до збільшення відсотка ускладнень та смертності порівняно з альтернативною комбінованою антикоагулянтною цільовою терапією, що складалась із таких препаратів: гепарину (6–11 Од/кг/год), аспірину (75–150 мг), клопідогрелю (75–150 мг), варфарину (1,5–7 мг), надропарину кальцію (0,3–0,6 мл 2 р/д), фондапаринуксу натрію (2,5–5 мг 2 р/д), при застосуванні якої показники виживаності були вірогідно вищими на 60 %.
Работа посвящена изучению геморрагических и тромбоэмболических осложнений в раннем послеоперационном периоде у пациентов с имплантированными устройствами механической поддержки левого желудочка (LVAD). В исследование вошли 10 пациентов мужского пола в возрасте 55,0 ± 13,5 года с индексом массы тела 30,8 ± 8,3, с фракцией выброса левого желудочка от 9 до 28 %, которым в период с 11.03.2016 по 22.11.2017 г. в Силезском центре болезней сердца (Польша) в условиях искусственного кровообращения были установлены LVAD. В раннем послеоперационном периоде больные ежесуточно получали антикоагулянтную целевую терапию, состоящую из следующих препаратов: гепарина (6–11 Ед/кг/ч), аспирина (75–150 мг), клопидогреля (75–150 мг), варфарина (1,5–7 мг), надропарина кальция (0,3–0,6 мл 2 р/д), фондапаринукса натрия (2,5–5 мг 2 р/д). Два пациента получали моногепаринотерапию, один пациент получал монотерапию варфарином в течение 14 дней. Другие пациенты в течение того же срока получали комбинированную терапию с гепарином в первые трое суток с последующим переходом на варфарин, аспирин, клопидогрель, фраксипарин или блокатор тромбина. Механическая поддержка левого желудочка осуществлялась двумя принципиально различными имплантируемыми системами, выполняющими одну функцию поддержки левого желудочка: POLVAD — программно-контролируемой пневматически-мембранной механической циркуляцией крови (2 пациента) и LVAD — программно-контролируемой электроцентрифужной циркуляцией (8 пациентов). Продолжительность поддержки системой POLVAD составила от 102 до 156 дней. Продолжительность поддержки LVAD — от 20 до 78 дней. Сравнение проанализированных результатов позволило сделать вывод, что антикоагулянтная монотерапия гепарином или варфарином приводит к увеличению процента осложнений и смертности по сравнению с альтернативной комбинированной антикоагулянтной целевой терапией, состоящей из следующих препаратов: гепарина (6–11 Ед/кг/ч), аспирина (75–150 мг), клопидогреля (75–150 мг), варфарина (1,5–7 мг), надропарина кальция (0,3–0,6 мл 2 р/д), фондапаринукса натрия (2,5–5 мг 2 р/д), при применении которых показатели выживаемости были достоверно выше на 60 %.
The work deals with the study of hemorrhagic and thromboembolic complications in the early postoperative period in patients with implanted left ventricular assist devices (LVAD). The study included 10 males aged 55.0 ± 13.5 years, with body mass index of 30.8 ± 8.3 kg/m2, left ventricular ejection fraction ranging from 9 to 28 %, who were implanted with LVAD under artificial blood circulation from 11.03.2016 to 22.11.2017 in the Silesian Center for Heart Disease (Poland). In the early postoperative period, patients received daily anticoagulant targeted therapy: heparin (6–11 U/kg/h), aspirin (75–150 mg), сlopidogrel (75–150 mg), warfarin (1.5–7 mg), nadroparin calcium (0.3–0.6 ml twice a day), fondaparinux sodium (2.5–5 mg twice a day). Two patients received heparin monotherapy, one patient — warfarin monotherapy for 14 days. Other patients during the same period received combined heparin therapy in the first three days with a subsequent transition to warfarin, aspirin, clopidogrel, fraxiparin, or thrombin blocker. The mechanical assistance of the left ventricle was carried out essentially by two different implantable systems performing one function of the left ventricular support: POLVAD — program-controlled pneumatic membrane mechanical blood circulation (2 patients), and LVAD — program-controlled electro-centrifugal circulation (8 persons). The duration of support by POLVAD system was from 102 to 156 days, by LVAD — from 20 to 78 days. A comparison of the analyzed results led to the conclusion that anticoagulant monotherapy with heparin or warfarin leads to an increase in the percentage of complications and mortality compared to the alternative combination anticoagulant targeted therapy: heparin (6–11 U/kg/h), aspirin (75–150 mg), clopidogrel (75–150 mg), warfarin (1.5–7 mg), nadroparin calcium (0.3–0.6 ml twice a day), fondaparinux sodium (2.5–5 mg twice a day), where survival rates were significantly higher, by 60 %.
апарат механічної підтримки лівого шлуночка; антикоагулянтна цільова терапія; геморагічні та тромбоемболічні ускладнення
аппарат механической поддержки левого желудочка; антикоагулянтная целевая терапия; геморрагические и тромбоэмболические осложнения
left ventricular assist device; anticoagulant targeted therapy; hemorrhagic and thromboembolic complications
Робота виконана у рамках двостороннього договору про наукове співробітництво між НМАПО імені П.Л. Шупика (кафедра анестезіології та інтенсивної терапії) та Силезьким центром хвороб серця
(Польща).
Вступ
Незважаючи на можливості сучасної медицини в галузі трансплантології серця, кількість необхідних донорських трансплантатів досить обмежена. Внаслідок цього кількість пацієнтів у листах очікування значно зростає, що нерідко супроводжується доопераційною смертністю [1]. Використання систем тривалої механічної підтримки кровообігу як мосту до трансплантації серця дає шанс на порятунок життя хворим із тяжкими ступенями серцевої недостатності, рефрактерної до медикаментозної терапії. Механічна підтримка кровообігу не тільки стабілізує гемодинамічну функцію, але також нормалізує функцію інших органів (печінка, нирки та ін.) [2]. Однак імплантація приладів механічної підтримки лівого шлуночка (LVAD) пов’язана з різними коротко- і середньостроковими ускладненнями.
На сьогодні в Силезькому центрі хвороб серця (Польща) користуються найсучаснішими автономними пристроями циркуляторної механічної підтримки кровообігу на рівні зі світовою практикою. POLVAD — програмно-контрольована пневматично-мембранна механічна система циркуляції крові, що розроблена групою інженерів на чолі з
З. Релігою, дозволяє підтримувати знижену функцію як правого, так і лівого шлуночка серця пацієнта. За допомогою канюль вона з’єднується із серцем і магістральними судинами, перебуваючи ззовні тіла пацієнта, завдяки чому відбувається спостереження за роботою пристрою. В дослідженні брали участь два пацієнти з підтримкою лівого шлуночка саме таким пристроєм POLVAD-MEV.
Ще один різновид допоміжної підтримки роботі лівого шлуночка — це LVAD центрифужно-кутового типу, такий як HeartMate®IIІ, Thoratec© та HeartWare®III (США). Дані пристрої мають компактний вигляд порівняно з попередніми моделями, тому використовуються частіше як у місцевій, так і у світовій практиці. Дослідження, ініційовані виробниками LVAD, свідчать про 83% виживаність пацієнтів після імплантації пристроїв даного типу, 10 % можливих подій порушення мозкового кровообігу і тільки один відсоток подій тромбозу двигуна насоса пристрою [4]. При цьому 78 % пацієнтів мають покращання стану скоротливої функції серця, переходячи з класу NYHAIIIB/IV в клас NYHA I/ІІ [4].
До основних нехірургічних несприятливих подій і ускладнень при імплантаціїLVAD належать кровотечі, тромбоз приладу, ішемічні та геморагічні інсульти, порушення функції нирок, мультиорганна недостатність й інфекції, які є основними причинами летальних випадків [3]. Щодо термінів появи ускладнень після імплантації LVAD, то вони можуть бути ранніми (до 30 днів після імплантації) або пізніми (через 30 днів після імплантації).
Метою нашого дослідження було вивчення кореляції між геморагічними і тромбоемболічними ускладненнями та стану системи згортання крові в пацієнтів, котрим було виконано імплантацію LVAD на фоні застосованої антикоагулянтної терапії.
Матеріали та методи
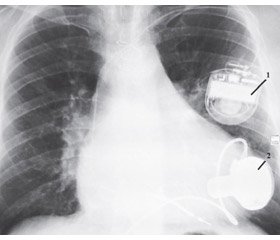
Об’єктом дослідження були 10 пацієнтів чоловічої статті віком 55,0 ± 13,5 року з індексом маси тіла 30,8 ± 8,3 кг/ м2 із фракцією викиду лівого шлуночка від 9 до 28 %, яким у період із 11.03.2016 по 22.11.2017 року у Силезькому центрі хвороб серця (Польща) було встановлено механічну підтримку кровообігу. У п’яти з обстежених хворих вже були імплантовані апарати ресинхронізаційної терапії з функцією дефібрилятора (рис. 1).
Соматичний стан обстежених пацієнтів відповідав 6–14 балам європейської системи оцінки ризику передопераційних втручань. Залежно від статусу за INTERMACS, Level 1 (кардіогенний шок) відзначався у 6 хворих, Level 2 (прогресуюча недостатність кровообігу) — у 4 обстежених.
Висока передтрансплантаційна легенева гіпертензія (транспульмональний градієнт більше 15 мм рт.ст. та/або легеневий судинний опір більше 4 Од Вуда) була виявлена в 7 пацієнтів. Два пацієнти були оперовані в стані затримки кровообігу з наданням серцево-легеневої реанімації, а один — із шлуночковою фібриляцією.
Хворим проводилась імплантація в умовах штучного кровообігу та помірної гіпотермії з t = +31 °C. Продуктивність апарата штучного кровообігу становила 2,5 л/хв/м². Для захисту міокарда використовувались системи змінного струму Schtoker (Німеччина), що створювали штучну фібриляцію на частоті 50 Гц, 12 В/25 А.
Моніторинг показників системної гемодинаміки проводився з використанням системи Intells Vue X2 Philips® (Нідерланди), показників серцевого індексу — за допомогою системи A7 Vigileo Monitor-Acsesories EDWARDS® systems, церебральна оксигенація — штатної системи INVOS Oximetr Somanetics® Inc. (СШA).
Операції проводилися в умовах комбінованого ендотрахеального наркозу по напівзакритому контуру з цільовим підтриманням концентрації інгаляційних анестетиків згідно з віковими показниками МАК. Для знеболювання використовувались фентаніл у дозі 1,7 ± 0,8 мкг/кг/хв або суфентаніл 0,015 ± 0,030 мкг/кг/хв.
У пацієнтів із високою легеневою гіпертензією здійснювалась інгаляційна подача NO під контролем електронного манометра у дозі 30–200 ppm, що використовувався до кількох діб у післяопераційному періоді.
Після закінчення операції штучна вентиляція у відділенні інтенсивної терапії (ІТ) проводилася апаратом Dräger Evita V300 повітряно-кисневою сумішшю з концентрацією кисню залежно від ступеня легеневої гіпертензії під контролем показників газового складу крові, які визначалися на апараті ABL800 (France).
Аналіз динаміки стану міокарда визначався за допомогою дослідження лактату крові, тропоніну І та МВ-фракції креатинфосфокінази. Всі вище-вказані аналізи та дослідження показників системи згортання крові проводились на системній лабораторній станції Multiplate® Roche (Франція).
Середня тривалість підтримки кровообігу за допомогою LVAD становила 49,7 ± 28,2 доби.
У ранньому післяопераційному періоді хворі з LVAD щодоби отримували антикоагулянтну цільову терапію (АКЦТ), що складалась з таких препаратів: гепарину (6–11 Од/кг/год), аспірину (75–150 мг), клопідогрелю (75–150 мг), варфарину (1,5–7 мг), надропарину кальцію (0,3–0,6 мл/2 р/д), фондапаринуксу натрію (2,5–5 мг/2 р/д). Два пацієнти отримували моногепаринотерапію, один пацієнт — монотерапію варфарином упродовж досліджуваних 14 днів. Інші пацієнти упродовж того ж терміну отримували комбіновану терапію з гепарином у перші три доби з наступним переходом на варфарин, аспірин, клопідогрель, фраксипарин або блокатор тромбіну.
Контроль дренованої рідини з перикардіальної та торакальної порожнин проводився системою двокамерних активних дренажних систем, під’єднаних до постійного негативного тиску, що спрощувало відхід рідини й оптимізувало погодинний розрахунок її кількості.
Результати
Під час раннього післяопераційного періоду у хворих із різними видами антикоагулянтної терапії спостерігалась досить різноманітна картина відповіді на антикоагулянтну цільову терапію.
Для порівняння пацієнти були розподілені на групи, в яких використовувалась класична антикоагулянтна цільова терапія гепарином та антикоагулянтом непрямої дії та альтернативними схемами комбінованої терапії з гепарином в перші три доби з наступним переходом на варфарин, аспірин, клопідогрель або блокатор Ха-фактора чи тромбіну, що мало доказану ефективність у попередніх дослідженнях [5].
Як видно з табл. 1, 1,80 % хворих (8 пацієнтів) отримували в перший тиждень гепаринотерапію шляхом подавання гепарину за допомогою інфузійного насоса зі швидкістю від 6 до 11 Од/кг/год, а 20 % хворих (2 пацієнти) перебували на монотерапії гепарином до кінця лікування в інтенсивній терапії. Половина хворих у перший тиждень та 70 % хворих (7 пацієнтів) — у другий отримували антикоагулянт непрямої дії варфарин у дозі 1,5–7 мг/добу.
Як альтернатива стандартній схемі АКЦТ, було застосовано такі препарати: 50 % хворих (5 пацієнтів) отримували протягом усього періоді аспірин в дозах 1,4 ± 0,7 мг/добу; 30 % прооперованих (3 пацієнти) протягом першого тижня і 50 % хворих (5 пацієнтів) — упродовж другого отримували клопідогрель — 1,3 ± 0,8 мг/добу; надропарин кальцію — 0,3–0,6 мл 2 р/д та фондапаринукс натрію — 2,5–5 мг 2 р/д) (табл. 1).
У перші дні гепаринотерапії в 1 пацієнта (10 %) виникла виражена гепериніндукована тромбоцитопенія, що призвело до зміни стратегії на альтернативну терапію за допомогою надропарину кальцію. В подальшому в даного пацієнта була зафіксована шлунково-кишкова кровотеча (ШКК) із невизначеною локалізацією.
20 % обстежених (2 пацієнти) з моногепаринотерапією мали повторне оперативне втручання з приводу дренування великої кількості ексудату після операції на 2-гу — 3-тю добу. В обох післяопераційний період був ускладнений нирковою недостатністю. В одного пацієнта розвинулися поширений геморагічний інсульт та печінкова недостатність. Обидва пацієнта померли через 92 ± 57 діб після імплантації LVAD.
Один із двох пацієнтів з комбінованою класичною терапією, яка включала інфузію гепарину в дозі 6–11 Од/кг/д протягом трьох діб із переведенням на непрямий антикоагулянт варфарин та аспірин, мав нефротичні ускладнення. В одного пацієнта цієї групи розвинулося порушення мозкового кровообігу за ішемічним типом, що ускладнило перебіг післяопераційної реабілітації. В одного пацієнта розвинувся тромбоз двигуна насоса пристрою з подальшою заміною системи LVAD, що дало лише тимчасовий ефект. На 126-ту добу пацієнт помер. Також в одного пацієнта розвинулася ШКК без визначеної локалізації, але без летального кінця.
В одного пацієнта, який отримував монотерапію варфарином, було проведено повторне оперативне втручання з приводу кровотечі з грудної клітки на першому тижні післяопераційного періоду, в подальшому післяопераційний період ускладнився тромбозом насоса пристрою з подальшою заміною системи LVAD, а також розвитком ниркової та легеневої недостатності в більш пізньому періоді, що призвело до летального кінця.
У пацієнта, який отримував фондапаринукс натрію в комбінації з аспірином та варфарином у перший тиждень, розвинулись ниркова дисфункція та ШКК невизначеної етіології і локалізації.
У пацієнта, який після трьох діб гепаринотерапії був переведений на терапію клопідогрелем, протягом другого тижня лікування розвинулося ішемічне ушкодження головного мозку.
У п’яти пацієнтів, які отримували комбіновану АКЦТ, що включала варфарин, аспірин і клопідогрель, у 30 % випадків розвинулось ШКК невизначеної етіології, а також у 20 % випадків — ниркова дисфункція.
Обговорення
Кровотеча є найбільш поширеним ускладненням після імплантації LVAD. Такі пацієнти потребують антитромбоцитарної й антикоагулянтної терапії, що збільшує імовірність кровотечі. Кровотеча, що відбувається в перші 14 днів після імплантації, в основному пов’язана з хірургічним втручанням. Причини кровотеч, що виникають пізніше, пов’язані з розвитком артеріовенозних мальформацій, дисфункцією печінки від післяімплантаційної правошлуночкової недостатності і набутим синдромом фон Віллебранда. Нехірургічні, ранні кровотечі, що розвиваються до 30 днів після імплантації, можуть виникати у 20–40 % пацієнтів. Протягом шести місяців після виписки кількість випадків кровотеч становить близько 13 % [4]. Визначення потенційних причин і факторів ризику кровотеч є важливим для покращання результатів лікування і якості життя в пацієнтів із LVAD.
Шлунково-кишкові кровотечі відбуваються в середньому через 30 діб після операції (діапазон — від 1 до 530 днів). Це найбільш поширена причина 30-денної повторної госпіталізації [3]. Сумарний ризик ШКК для пацієнтів, які отримують такі різновиди пристроїв механічної підтримки лівого шлуночка, як HeartMate II і HeartWare, становить 21, 27 і 31 % на один, три і п’ять років відповідно [5, 6]. При цьому попередні дослідження виявили, що верхні відділи шлунково-кишкового тракту є найбільш поширеним місцем кровотечі в пацієнтів, яким імплантовано LVAD [5, 7].
Недавнє невелике ретроспективне дослідження показало, що відеокапсульна ендоскопія, що за допомогою знімків пероральної одноразової мікрокамери робить фіксацію слизової всього ШКТ [6], є безпечним й ефективним способом для виявлення незрозумілих ШКК. Переважно тільки відеокапсульна ендоскопія виявляла кровотечі з тонкої кишки та ангіодиспластичні зміни тонкої кишки, які складно діагностувати загальновизнаним способом. Діагностичний ефект дослідження був позитивним у 40 % пацієнтів. Проте його проводили в середньому на шостий день після корекції коагулопатії і після інших ендоскопічних процедур, коли не вдавалося виявити причину незрозумілої ШКК [6].
Фактори, що сприяють ШКК, можуть бути пов’язані з підвищеним тиском у просвіті тонкої кишки, що призводить до розвитку ангіодисплазій шлунково-кишкового тракту. Іншим можливим поясненням високого ступеня ШКК серед реципієнтів із ламінарним LVAD є набутий синдром фон Віллебранда, що є вторинним явищем після гемолізу внаслідок високооборотності ротора двигуна, що пояснюється подальшим розщепленням високомолекулярних мультимерів на більш дрібні, які фільтруються і виходять із кров’яного русла, що призводить до втрати або зменшення великих мультимерів фактора фон Віллебранда, які необхідні для стимулювання тромбоцитів [7]. Нещодавні дослідження показали, що у всіх пацієнтів були діагностовані типові лабораторні результати набутого синдрому фон Віллебранда після імплантації LVAD, але не у всіх були відмічені кровотечі [8, 9]. Ці дані свідчать про те, що тільки набутого синдрому фон Віллебранда недостатньо для розвитку ускладнень при кровотечах після імплантації LVAD.
Іншим тяжким ускладненням є крововилив в центральну нервову систему, що відбувається порівняно пізно. У дослідженні з HeartMate II показано, що цільова терапія в перші два роки після імплантації LVAD супроводжується в 11 % випадків розвитком геморагічного інсульту як головного чинника відстроченої летальності [10]. У рандомізованому дослідженні 734 хворих було виявлено значно вищу частоту розвитку геморагічного інсульту в пацієнтів, які отримували HeartWare, порівняно з пацієнтами, які отримували HeartMate II [5]. У недавно проведеному ретроспективному огляді показано, що у 5 % із 114 пацієнтів із HeartMate II спостерігався внутрішньочерепний крововилив [11]. Частота розвитку порушення мозкового кровообігу за геморагічним типом була вищою в групі хворих, які приймали аспірин у дозі 325 мг порівняно з групою хворих, які приймали аспірин у дозі 81 мг у поєднанні з дипіридамолом, або просто аспірин у дозі 81 мг. Високі дози аспірину в пацієнтів із HeartMate II, які одночасно отримували варфарин, були пов’язані з підвищеною небезпекою кровотечі, але не зменшували тромботичних подій [11].
Важливою причиною ранньої повторної госпіталізації після імплантації LVAD є анемія без встановленого джерела кровотечі, що потребує переливання еритроцитарної маси, і це ускладнення становить 20 % всіх кровотеч [12].
Стратегії для зниження частоти і тяжкості такого ускладнення, як кровотеча, включають: зниження міжнародного нормалізованого відношення (МНВ), зменшення використання антитромбоцитарних засобів й адаптивну корекцію швидкості двигуна для забезпечення пульсуючого потоку.
Нещодавнє дослідження показало, що знижена пульсація при імплантації LVAD призвела до збільшення відсотка кровотеч. Згідно з даними О. Wever-Pinzon і співавт., у пацієнтів в групі з індексом низької пульсації коефіцієнт ризику становив 4,06
(p = 0,04) порівняно з групою, де використовувались високі індекси пульсації [13].
Оптимальне лікування пацієнтів із підвищеним ризиком кровотечі залишається емпіричним і завжди знаходиться залежно від комбінації факторів, пов’язаних із пацієнтом і пристроєм. Клінічний стан пацієнта часто вимагає тимчасової зміни показників МНВ в основному шляхом його зменшення або тимчасової відміни антикоагуляційного лікування для зупинки значних або навіть небезпечних для життя кровотеч. A.J. Boyle та співавт., досліджуючи коридор безпеки МНВ для пацієнтів з LVAD, дійшли висновку, що цільове МНВ від 1,5 до 2,5 може бути безпечним у пацієнтів із підвищеним ризиком кровотечі [14]. Проте ця перевага відбувається за рахунок значно вищого ризику розвитку тромботичних ускладнень [15].
Незважаючи на антитромботичне лікування, тромбоемболічні ускладнення після імплантації LVAD є поширеними. Вони включають: цереброваскулярне ішемічне ушкодження, транзиторну ішемічну атаку, артеріальну емболію центральної нервової системи або тромбоз двигуна пристрою.
Неврологічні пошкодження залишаються одним із найскладнійших ускладнень після імплантації LVAD і найчастіше є основною причиною летальних випадків [14]. Зазначена частота ішемічного інсульту під час підтримки з HeartMate II як ускладнення до пересадки серця становить 0,064–0,082 події на рік життя пацієнта (ПРП) з імплантованим LVAD [16]. Частота ішемічного інсульту для HeartWare становила 0,11 події на рік пацієнта [4]. Багатофакторний аналіз показав, що цукровий діабет, час перетискування аорти при штучному кровообігу та вищі значення міжнародного нормалізованого відношення є незалежними предикторами розвитку інсульту. Згідно з даними J.A. Morgan,
R.J. Brewer і співавт., середнє значення міжнародного нормалізованого відношення на момент інсульту було субтерапевтичним у всіх пацієнтів з емболічними інсультами. Пацієнти з діабетом в 6,36 раза частіше мали інсульт, ніж ті, у яких даної патології не було [17]. Повне перетискування аорти з використанням кардіоплегії порівняно з частковим бічним її перетисканням було пов’язане зі значно вищою частотою розвитку інсульту і було незалежним предиктором інсульту [16].
Фібриляція передсердь (ФП) є загальновизнаним фактором ризику тромбоемболічних ускладнень і часто зустрічається в пацієнтів із тяжкою серцевою недостатністю, включаючи пацієнтів, які пройшли імплантацію LVAD. Однак нещодавній ретроспективний аналіз даних INTERMACS первинних LVAD свідчить про те, що передопераційна ФП не збільшує ризик післяопераційних тромбоемболічних ускладнень або смертності пацієнтів під час проміжного періоду [18]. Це вказує на те, що звичайна післяопераційна антитромботична стратегія, найімовірніше, підходить також і пацієнтам із ФП, які проходять імплантацію LVAD.
Частота тромбозу насоса двигуна пристрою через три місяці після імплантації LVAD несподівано збільшується з 2,2 до 8,4 % після імплантації HeartMate II [16], тоді як частота серцевого тромбозу залишається стабільною. Тромбоз насоса, що вимагав його заміни, спостерігався у 4 % пацієнтів, а загальна захворюваність і поширеність ТНДП становила 0,08 події на рік життя пацієнта і 8,1 % відповідно [19].
Загалом альтернативні схеми антикоагулянтної цільової терапії були запропоновані для запобігання тромбозу насоса двигуна пристрою. Однак доказових даних, які підтримують будь-яку схему терапії, вкрай мало, що і стало причиною вивчення даної проблематики в Силезькому центрі хвороб серця.
Нещодавнє дослідження, спрямоване на оцінку амбулаторного лікування варфарином, показало, що тромботичні випадкі (підозри на ТНДП та ішемічний інсульт) були найвищими серед найнижчих показників міжнародного нормалізованого відношення (< 1,5 (0,40 тромботичної ПРП)), але значення МНВ від 1,5 до 1,99 також мали високі показники (0,16 тромботичної ПРП) [14]. Існує відсутність статистично значущого кореляційного зв’язку між рівнем міжнародного нормалізованого відношення і тромботичними подіями в період часу від моменту імплантації до трьох місяців після імплантації LVAD, що свідчить про те, що раннє ТНДП може бути викликане незалежними подіями, такими як вид оперативного втручання, вид приладу, вид післяопераційної антикоагуляційної бридж-терапії [15]. І навпаки, у ранньому післяопераційному періоді проведення терапії антикоагулянтами передбачає ТНДП. Результати аналізу показують, що цільові рівні міжнародного нормалізованого відношення 2,6 є оптимальними для уникнення як кровотечі, так і тромботичних ускладнень, а також мінімізації смертності [15]. Ці висновки підтверджують існуючу практику і переконують, що цільовий діапазон МНВ від 2,0 до 3,0 мінімізує всі значні побічні явища, що підтверджується даними досліджень M.E. Nassif та співавт. [15].
У відповідь на попередні дослідження, що показують ранні ТНДП до 8,4 % у пацієнтів, які отримували HeartMate II, дослідження, що було проведено в 24 центрах США та включало 300 пацієнтів, показало, що ТНДП розвивалося у 2,9 % випадків через три місяці після імплантації і 4,8 % — через 6 місяців [21]. У результаті проведених досліджень для зменшення частоти розвитку ТНДП було рекомендовано підтримувати значення міжнародного нормалізованого відношення в межах 2,0–2,5, проводити ранню терапію варфарином й аспірином, підтримувати оптимальний контроль швидкості (> 5000 об/хв)
і середній артеріальний тиск < 90 мм рт.ст.
Висновки
1. Геморагічний й ішемічний інсульти є одними з найтяжчих і прогностично несприятливих ускладнень, що мають прояви в 30 % пацієнтів в обстеженій групі.
2. Найбільший відсоток ускладнень у вигляді кровотеч та тромбоемболічних подій спостерігався в контрольній групі пацієнтів, які отримували монотерапію гепарином або варфарином або їх поєднання.
3. Альтернативна АКЦТ із застосуванням інгібіторів тромбіну, P1Y12-блокаторів та аспірину у хворих досліджуваної групи мала ефект, при якому летальність та кількість пошкоджень, пов’язаних із геморагічними та тромбоемболічними ускладненнями, були вірогідно меншими.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Kirklin J.K., Naftel D.C., Pagani F.D. et al. Seventh
INTERMACS annual report: 15,000 patients and counting // J. Heart Lung. Transplant. — 2015 Dec. — 34(12). — Р. 1495-504.
2. Akhter S.A., Badami A., Murray M. et al. Hospital Readmissions After Continuous-Flow Left Ventricular Assist Device Implantation: Incidence, Causes, and Cost Analysis // Ann. Thorac. Surg. — 2015 Sep. — 100(3). — Р. 884-9.
3. Wever-Pinzon O., Drakos S.G, Kfoury A.G. et al. Morbidity and mortality in heart transplant candidates supported with mechanical circulatory support: is reappraisal of the current United network for organ sharing thoracic organ allocation policy justified // Circulation. — 2013, Jan 29. — 127(4). — Р. 452-62.
4. Mandeep R. Mehra, M.D.,Daniel J. et al. The MOMENTUM 3 Investigators “Two-Year Outcomes with Magnetically Levitated Cardiac Pump in Heart Failure” // New England Journal of Medicine in ELSERVIER base.
5. Klaus Görlinger, Lars Bergmann, Daniel Dirkmann. Coagulation management in patients undergoing mechanical circulatory support // Journal homepage ELSERVIER base: www.elsevier.com/locate/bean.
6. Amornsawadwattana S., Nassif M., Raymer D., LaRue S., Chen C.H. Video capsule endoscopy in left ventricular assist device recipients with obscure gastrointestinal bleeding // World J. Gastroenterol. — 2016, May 14. — 22(18). — Р. 4559-66.
7. Kushnir V.M., Sharma S., Ewald G.A. et al. Evaluation of GI bleeding after implantation of left ventricular assist device // Gastrointest. Endosc. — 2012 May. — 75(5). — Р. 973-9.
8. Crow S., Chen D., Milano C. et al. Acquired von Willebrand syndrome in continuous-flow ventricular assist device recipients // Ann. Thorac. Surg. — 2010. — 90(4). — Р. 1263-9.
9. Meyer A.L., Malehsa D., Bara C., et al. Acquired von Willebrand syndrome in patients with an axial flow left ventricular assist device // Circ. Heart Fail. — 2010. — 3(6). — Р. 675-81.
10. Slaughter M.S., Rogers J.G., Milano C.A. et al. HeartMate II Investigators. Advanced heart failure treated with continuous-flow left ventricular assist device // N. Engl. J. Med. — 2009, Dec 3. — 361(23). — Р. 2241-51.
11. Saeed O., Shah A., Kargoli F. et al. Antiplatelet Therapy and Adverse Hematologic Events During Heart Mate II Support // Circ. Heart Fail. — 2016 Jan. — 9(1). — e002296.
12. Bunte M.C., Blackstone E.H., Thuita L. et al. Major bleeding during HeartMate II support // J. Am. Coll. Cardiol. — 2013, Dec 10. — 62(23). — Р. 2188-96.
13. Wever-Pinzon O., Selzman C.H., Drakos S.G. et al. Pulsatility and the risk of nonsurgical bleeding in patients supported with the continuous-flow left ventricular assist device HeartMate II // Circ. Heart Fail. — 2013 May. — 6(3). — Р. 517-26.
14. Boyle A.J., Russell S.D., Teuteberg J.J. et al. Low thromboembolism and pump thrombosis with the HeartMate II left ventricular assist device: analysis of outpatient anti-coagulation // J. Heart Lung. Transplant. — 2009 Sep. — 28(9). — Р. 881-7.
15. Nassif M.E., LaRue S.J., Raymer D.S. et al. Relationship Between Anticoagulation Intensity and Thrombotic or Bleeding Outcomes Among Outpatients With Continuous-Flow Left Ventricular Assist Devices // Circ. Heart Fail. — 2016 May. — 9(5).
16. Harvey L., Holley C., Roy S.S et al. Stroke After Left Ventricular Assist Device Implantation: Outcomes in the Continuous-Flow Era // Ann. Thorac. Surg. — 2015. — 100(2). — Р. 535-41.
17. Morgan J.A., Brewer R.J., Nemeh H.W. et al. Stroke while on long-term left ventricular assist device support: incidence, outcome, and predictors // ASAIO J. — 2014 May-Jun. — 60(3). — Р. 284-9.
18. Xia Y., Stern D., Friedmann P., Goldstein D. Preoperative atrial fibrillation may not increase thromboembolic events in left ventricular assist device recipients on midterm follow-up // J. Heart Lung. Transplant. — 2016. — 35(7). — Р. 906-12.
19. Najjar S.S., Slaughter M.S., Pagani F.D. et al. HVAD Bridge to Transplant ADVANCE Trial Investigators. An analysis of pump thrombus events in patients in the HeartWare ADVANCE bridge to transplant and continued access protocol trial // J. Heart Lung. Transplant. — 2014 Jan. — 33(1). — Р. 23-34.
20. Uriel N., Morrison K.A., Garan A.R. et al. Development of a novel echocardiography ramp test for speed optimization and diagnosis of device thrombosis in continuous-flow left ventricular assist devices: the Columbia ramp study // J. Am. Coll. Cardiol. — 2012 Oct. — 30. — 60(18). — Р. 1764-75.
21. Maltais S., Kilic A., Nathan S. et al. Prevention of HeartMate II Pump Thrombosis Through Clinical Management (PREVENT) // J. Heart Lung. Transplant. — 2016. — 35(4). — Р. 161-162.
22. Starling R.C., Moazami N., Silvestry S.C. et al. Unexpected abrupt increase in left ventricular assist device thrombosis // N. Engl. J. Med. — 2014. — 370(1). — Р. 33-40.
23. Saeed D., Maxhera B., Albert A., Westenfeld R., Hoffmann T., Lichtenberg A. Conservative approaches for HeartWare ventricular assist device pump thrombosis may improve the outcome compared with immediate surgical approaches // Interact Cardiovasc. Thorac. Surg. — 2016. — 23(1). — Р. 90-5.

/92-1.jpg)
/93-1.jpg)