Журнал «Медицина неотложных состояний» №2(97), 2019
Вернуться к номеру
Застосування катетерної субарахноїдальної блокади в абдомінальній хірургії
Авторы: Бишовець С.М.
Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. У сучасній абдомінальній хірургії значну частку займають тривалі оперативні втручання. Техніка пролонгованої субарахноїдальної блокади (СБ) катетерами G22, G24 дозволяє надійно ідентифікувати субарахноїдальний простір, швидко вводити анестетик, забезпечуючи його адекватне змішування з ліквором. Швидкість розвитку анестезії, її глибина, надійність, керованість та відсутність системної токсичності характеризують катетерну СБ як перспективну техніку у практиці анестезіолога. Мета. Удосконалення анестезіологічного забезпечення в абдомінальній хірургії шляхом катетеризації спинномозкового каналу і пролонгації СБ відповідно до тривалості операції. Матеріали та методи. Досліджені 15 пацієнтів (64,4 ± 5,2 року; 78,9 ± 6,6 кг; II–III за ASA). Захворювання: деструктивний холецистит (1), післяопераційна вентральна грижа, ожиріння (6), защемлена післяопераційна вентральна грижа з некрозом тонкого кишечника (1), гостра кишкова непрохідність із сегментарним тромбозом — некрозом тонкого кишечника (1), гостра кишкова непрохідність із приводу раку сигмоподібної кишки (2), рак сигмоподібної кишки (2), рак шлунка зі стенозом виходу зі шлунка (2). На рівні L2–3 виконувалась катетеризація спинномозкового каналу за допомогою набору Spinocath із діаметром катетера G22 (B. Braun, ФРН). СБ здійснювали гіпербаричним бупівакаїном у дозі 20 мг у поєднанні з 0,06 мг бупренорфіну. Положення хворого — на боці. Головний кінець операційного столу опущено (кут 10–15º). Після інтратекальної ін’єкції пацієнта повертали на спину, а стіл вирівнювали в горизонтальне положення. Рівень СБ — Th2–3. Подовження анестезії здійснювали за потребою додатковим уведенням гіпербаричного бупівакаїну по 10 мг. Пацієнти отримували до операції: перорально — по 6 мг мелатоніну перед сном напередодні втручання й за 1 год до операції; перорально/внутрішньовенно — 1 г парацетамолу; внутрішньом’язово — 20 мг нефопаму; внутрішньовенно — 8 мг дексаметазону; внутрішньовенно — 8 мг ондансетрону; внутрішньовенно — 50 мг декскетопрофену. Після операції протягом двох-трьох діб: перорально/внутрішньовенно — по 1 г парацетамолу кожні 8 год, внутрішньовенно — по 50 мг декскетопрофену кожні 8 год. Стабілізація гемодинаміки здійснювалася внутрішньовенним застосуванням адреналіну гідротартрату (0,09–0,27 мг/год або 0,019–0,057 мкг/кг/хв). У післяопераційному періоді інтратекально вводили по 0,06 мг бупренорфіну кожні 24 год протягом двох діб і вилучали спінальний катетер. Результати. Після премедикації мелатоніном і нефопамом хворі перебували у відносно спокійному психоемоційному статусі. Адекватність знеболювання визначалася самими пацієнтами, які характеризували свій стан як комфортний, із повною відсутністю болю. Аналгезія поширювалася на зону іннервації Тh2–3–S5. Максимальна доза бупівакаїну за час операції досягала 40 мг. Корекцію гіпотензії та брадикардії ефективно забезпечували інфузією малих доз адреналіну. Залежно від рівня артеріального тиску й частоти серцевих скорочень змінювали швидкість введення адреналіну. Оптимізація артеріального тиску і частоти серцевих скорочень відбувалася реципрокно. Частота дихання була в межах 12–16 за 1 хв, SpO2 — 96–99 %. Після операції пацієнтів переводили до хірургічних відділень. Під час транспортування та подальшого лікування хворі були притомні, гемодинамічні параметри, а також дихальна функція залишалися стабільними, зберігався частковий моторний блок, швидкість регресії якого залежала від інтратекальної дози бупівакаїну. В жодному випадку не відзначали постпункційного головного болю. У першу післяопераційну добу вислуховувалась активна перистальтика. Хворі починали активно рухатися через 2–3 год після переводу з операційної. Із першої доби після операції призначали раннє ентеральне харчування. Динаміка ступеня післяопераційного болю за числовою рейтинговою шкалою болю: через 3 год — 0 балів; через 10 год — 1,60 ± 0,02 бала (р = 0,0001); через 24 год — 1,20 ± 0,02 бала (р = 0,0001); через 48 год — 1,06 ± 0,01 бала (р = 0,0001). Через 30 хв після інтратекального введення бупренорфіну вираженість післяопераційного болю дорівнювала нулю. Висновки. Застосування технології катетеризації субарахноїдального простору дозволяло проводити СБ при абдомінальних операціях будь-якої тривалості й травматичності. Катетерна СБ бупівакаїном і бупренорфіном поєднано з нефопамом, декскетопрофеном та парацетамолом була ефективним методом контролю больового синдрому у післяопераційному періоді. Покращення якості аналгезії дозволяло проводити ранню активізацію та харчування пацієнтів і, відповідно, скорочувало період реабілітації.
Актуальность. В современной абдоминальной хирургии значительную часть занимают длительные оперативные вмешательства. Техника пролонгированной субарахноидальной блокады (СБ) катетерами G22, G24 позволяет надежно идентифицировать субарахноидальное пространство, быстро вводить анестетик, обеспечивая его адекватное смешивание с ликвором. Скорость развития анестезии, ее глубина, надежность, управляемость и отсутствие системной токсичности характеризуют катетерную СБ как перспективную технику в практике анестезиолога. Цель. Усовершенствование анестезиологического обеспечения в абдоминальной хирургии путем катетеризации спинномозгового канала и пролонгации СБ соответственно продолжительности операции. Материалы и методы. Исследованы 15 пациентов (64,4 ± 5,2 года; 78,9 ± 6,6 кг; II–III по ASA). Заболевания: деструктивный холецистит (1), послеоперационная вентральная грыжа, ожирение (6), ущемленная послеоперационная вентральная грыжа с некрозом тонкого кишечника (1), острая кишечная непроходимость с сегментарным тромбозом — некрозом тонкого кишечника (1), острая кишечная непроходимость по поводу рака сигмовидной кишки (2), рак сигмовидной кишки (2), рак желудка со стенозом выхода из желудка (2). На уровне L2–3 выполнялась катетеризация спинномозгового канала набором Spinocath с диаметром катетера G22 (B. Braun, ФРГ). СБ осуществляли гипербарическим бупивакаином в дозе
20 мг в сочетании с 0,06 мг бупренорфина. Положение больного — на боку. Головной конец операционного стола опущен (угол — 10–15º). После интратекальной инъекции пациента поворачивали на спину, а стол выравнивали в горизонтальное положение. Уровень СБ — Th2–3. Пролонгацию анестезии осуществляли по требованию дополнительным введением гипербарического бупивакаина по 10 мг. Пациенты получали до операции: перорально — по 6 мг мелатонина перед сном накануне вмешательства и за 1 ч до операции; перорально/внутривенно — 1 г парацетамола; внутримышечно — 20 мг нефопама; внутривенно — 8 мг дексаметазона; внутривенно — 8 мг ондансетрона; внутривенно — 50 мг декскетопрофена. После операции в течение двух-трех суток перорально/внутривенно — по 1 г парацетамола каждые 8 ч, внутривенно — по 50 мг декскетопрофена каждые 8 ч. Стабилизация гемодинамики осуществлялась внутривенным введением адреналина гидротартрата (0,09–0,27 мг/ч или 0,019–0,057 мкг/кг/мин). В послеоперационном периоде интратекально вводили по 0,06 мг бупренорфина каждые 24 ч в течение двух суток и извлекали спинальный катетер. Результаты. После премедикации мелатонином и нефопамом больные находились в относительно спокойном психоэмоциональном статусе. Адекватность обезболивания определялась самими пациентами, которые характеризовали свое состояние как комфортное, с полным отсутствием боли. Аналгезия охватывала зону иннервации Тh2–3–S5. Максимальная доза бупивакаина за время операции достигала 40 мг. Коррекцию гипотензии и брадикардии эффективно обеспечивали инфузией малых доз адреналина. В зависимости от уровня артериального давления и частоты сердечных сокращений изменяли скорость введения адреналина. Оптимизация артериального давления и частоты сердечных сокращений происходила реципрокно. Частота дыхания была в пределах 12–16 в 1 мин. SpO2 — 96–99 %. После окончания операции пациентов переводили в хирургические отделения. Во время транспортировки и дальнейшего лечения больные находились в сознания, гемодинамические параметры, а также дыхательная функция оставались стабильными, сохранялся частичный моторный блок, скорость регрессии которого зависела от интратекальной дозы бупивакаина. Отсутствовала постпункционная головная боль. В первые послеоперационные сутки выслушивалась активная перистальтика. Больные начинали активно двигаться через 2–3 ч после перевода из операционной. С первых суток после операции назначали раннее энтеральное питание. Динамика степени послеоперационной боли по числовой рейтинговой шкале боли: через 3 часа — 0 баллов; через 10 ч — 1,60 ± 0,02 балла (р = 0,0001); через 24 ч — 1,20 ± 0,02 балла (р = 0,0001); через 48 ч — 1,06 ± 0,01 балла (р = 0,0001). Через 30 мин после интратекального введения бупренорфина выраженность послеоперационной боли равнялась нулю. Выводы. Применение технологии катетеризации субарахноидального пространства позволяло проводить СБ при абдоминальных операциях любой продолжительности и травматичности. Катетерная СБ бупивакаином и бупренорфином в сочетании с нефопамом, декскетопрофеном и парацетамолом была эффективным методом контроля болевого синдрома в послеоперационном периоде. Улучшение качества аналгезии позволяло проводить раннюю активизацию и питание пациентов и, соответственно, сокращало период реабилитации.
Background. In modern abdominal surgery, significant proportion belongs to long surgical interventions. The technique of prolonged subarachnoid block (SB) with G22 and G24 catheters helps reliably identify the subarachnoid space, quickly inject the anaesthetic, ensuring its adequate mixing with liquor. The rate of anaesthesia development, its depth, reliability, controllability and the absence of systemic toxicity characterizes catheter SB as a promising technique in the practice of the anaesthesiologist. Materials and methods. The study involved 15 patients (64.4 ± 5.2 years; 78.9 ± 6.6 kg; II–III ASA). Diseases: destructive cholecystitis (1), postoperative ventral hernia, obesity (6), strangulated postoperative ventral hernia with necrosis of the small intestine (1), acute intestinal obstruction with segmental thrombosis — necrosis of the small intestine (1), acute intestinal obstruction due to sigmoid colon cancer (2), sigmoid colon cancer (2), gastric cancer with pyloric stenosis (2). At the L2–3 level, the spinal canal catheterization was performed using Spinocath kit with G22 catheter (B. Braun, Germany). SB was performed with hyperbaric bupivacaine at a dose of 20 mg in combination with 0.06 mg of buprenorphine. The position of the patient was lateral. The head end of the operating table was lowered (angle — 10–15°). After intrathecal injection, the patient was turned on his back, and the table was put in a horizontal position. SB level — Th2–3. The prolongation of anaesthesia was carried out “as needed” by the additional injection of hyperbaric bupivacaine 10 mg. Before the surgery, patients received: orally — 6 mg of melatonin at bedtime the day before intervention and 1 h prior to the surgery; orally/intravenously — 1 g of paracetamol; intramuscularly — 20 mg of nefopam; intravenously — 8 mg of dexamethasone; intravenously — 8 mg of ondansetron; intravenously — 50 mg of dexketoprofen. After the operation, for two/three days: orally/intravenously — 1 g of paracetamol every 8 h, intravenously — 50 mg of dexketoprofen every 8 h. Hemodynamic stabilization was carried out by administration of intravenous adrenaline hydrotartrate (0.09–0.27 mg/h or 0.019–0.057 μg/kg/min). In the postoperative period, 0.06 mg of intrathecal buprenorphine was injected every 24 h for 2 days, and a spinal catheter was removed. Results. After premedication with melatonin and nefopam, patients had a relatively quiet psycho-emotional status. The adequacy of anaesthesia was determined by the patients themselves, who characterized their condition as comfortable with “no pain”. Analgesia covered the Th2–3-S5 innervation zone. The maximum dose of bupivacaine during the operation reached 40 mg. Correction of hypotension and bradycardia was effectively provided by infusion of small doses of adrenaline. Depending on the level of blood pressure and heart rate, the rate of adrenaline injection was changed. Optimization of blood pressure and heart rate occurred reciprocally. Respiratory rate was 12–16 per minute, SpO2 — 96–99 %. After the operation, patients were transferred to the surgical department. During transportation and further treatment, patients were conscious, hemodynamic parameters and respiratory function remained stable, a partial motor block was detected, its regression rate depended on the intrathecal dose of bupivacaine. There was no postdural puncture headache. During the first postoperative day, active peristalsis was noted. Patients began to move actively 2–3 h after the transfer from the operating room. From the first day after the surgery, early enteral feeding was started. The dynamics of postoperative pain severity according to a numerical rating scale was: 3 h after — 0 points; 10 h — 1.60 ± 0.02 points (p = 0.0001); 24 h — 1.20 ± 0.02 points (p = 0.0001); 48 h after — 1.06 ± 0.01 points (p = 0.0001). Thirty minutes after the intrathecal administration of buprenorphine, the severity of postoperative pain was 0. Conclusions. The use of subarachnoid catheterization made it possible to perform SB during abdominal surgeries of any duration and injury rate. Catheter SB with bupivacaine and buprenorphine in combination with nefopam, dexketoprofen and paracetamol was an effective method for pain control in the postoperative period. Improving the quality of analgesia allowed for early activation and nutrition of patients and, accordingly, shortened the rehabilitation period.
субарахноїдальна блокада; спінальна анестезія; нейроаксіальна анестезія; інтратекальна анестезія; центральна блокада; катетеризація спинномозкового каналу
субарахноидальная блокада; спинальная анестезия; нейроаксиальная анестезия; интратекальная анестезия; центральная блокада; катетеризация спинномозгового канала
subarachnoid block; spinal anaesthesia; neuroaxial anaesthesia; intrathecal anaesthesia; central blockade; spinal canal catheterization
…если только в хирургических действиях
можно искать эстетики, то более красивого
и изящного, чем точно локализованная
корешковая анестезия, —
трудно что-нибудь подыскать.
С.С. Юдін [1]
Вступ
У сучасній абдомінальній хірургії значну частку становлять тривалі оперативні втручання. H. Nolte влучно зауважив: «Минули часи швидкої хірургії». Пролонгована субарахноїдальна блокада (СБ) відома ще з 1906 р., коли H.P. Dean оприлюднив власний досвід тривалої СБ, залишаючи спінальну голку в дуральному мішку [2]. З тих часів техніки пролонгованої СБ постійно удосконалювалися, й на сьогодні катетери середнього діаметра (G22, G24) дозволяють надійно ідентифікувати субарахноїдальний простір, швидко вводити анестетик, забезпечуючи його адекватне змішування з ліквором. Швидкість розвитку анестезії, її глибина, надійність, керованість та відсутність системної токсичності характеризують катетерну СБ як перспективну техніку у практиці анестезіолога. Основна сфера застосування катетерної СБ — ортопедія [3], також використовують цей метод знеболювання в акушерстві [4] та абдомінальній хірургії [5].
Нейроаксіальна анестезія локальними анестетиками створює якісний аферентний блок ноцицептивних імпульсів [6, 7]. Позитивний вплив регіонарних методів знеболювання на патофізіологію операційної травми, висока ефективність, відносна простота, економічність та мінімальна дія на функції життєво важливих органів призвели до суттєвого збільшення нейроаксіальних анестезій у загальній структурі методів знеболювання. Порівняно з тотальною анестезією центральні блокади зменшують ризик багатьох суттєвих ускладнень у хворих при різних оперативних втручаннях [8], запобігають розвитку інфекції, імунодепресії і метастазуванню [9], тромбозу глибоких вен, зменшують необхідність у гемотрансфузії [10].
Найбільше поширення серед усіх способів регіонарної анестезії отримала СБ, історія якої нараховує понад 100 років. Але вона не позбавлена хиб: наприклад, обмеження дії анестетика у часі, неможливість корегування дози. Застосування бупівакаїну й ад’ювантів подовжує тривалість СБ, проте вона лишається некерованою. СБ рутинно застосовується при операціях на нижніх кінцівках, в урології і майже не використовується в абдомінальній хірургії при оперативних втручаннях на середньому й верхньому поверхах черева. Розвиток технологій та удосконалення матеріалів сприяли створенню інтратекальних катетерів, таким чином СБ отримала нові можливості.
Мета роботи: удосконалити анестезіологічне забезпечення в абдомінальній хірургії шляхом катетеризації спинномозкового каналу і пролонгації субарахноїдального блоку відповідно до тривалості операції.
Матеріали та методи
Досліджені після отримання інформованої згоди 15 пацієнтів (5 жінок і 10 чоловіків) із такими фізичними параметрами: вік — 64,4 ± 5,2 року, маса тіла — 78,9 ± 6,6 кг, індекс маси тіла — 30,8 ± 2,2 кг/м2,
фізичний статус — II–III клас за ASA. Спектр захворювань, із приводу яких виконувались операції в ургентному та відстроченому порядках: деструктивний холецистит (1), післяопераційна вентральна грижа, ожиріння (6), защемлена післяопераційна вентральна грижа з некрозом тонкого кишечника (1), гостра кишкова непрохідність із сегментарним тромбозом — некрозом тонкого кишечника (1), гостра кишкова непрохідність із приводу раку сигмоподібної кишки (2), рак сигмоподібної кишки (2), рак шлунка зі стенозом виходу зі шлунка (2).
Після локальної анестезії бупівакаїном (0,25% — 1,0 мл) місця інтервенції на безпечному рівні L2–3 виконувалась катетеризація спинномозкового каналу за допомогою набору Spinocath діаметром катетера G22 (B. Braun, ФРН). СБ здійснювали гіпербаричним розчином бупівакаїну в дозі 20 мг у поєднанні з 0,06 мг бупренорфіну. Положення хворого — на боці. Головний кінець операційного столу опущено (кут 10–15º). Після інтратекальної ін’єкції пацієнта повертали на спину, а стіл вирівнювали в горизонтальне положення. Таким чином досягався високий рівень СБ (Th2–3), що дозволяло проводити оперативні втручання на будь-якому поверсі черевної порожнини. Подовження анестезії здійснювали за потребою додатковим уведенням гіпербаричного бупівакаїну по 10 мг.
Пацієнти отримували до операції: перорально — по 6 мг мелатоніну перед сном напередодні втручання й за 1 год до операції; перорально/внутрішньовенно — 1 г парацетамолу; внутрішньом’язово — 20 мг нефопаму; внутрішньовенно — 8 мг дексаметазону; внутрішньовенно — 8 мг ондансетрону; внутрішньовенно — 50 мг декскетопрофену. Після операції протягом двох-трьох діб: перорально/внутрішньовенно — по 1 г парацетамолу кожні 8 год, внутрішньовенно — по 50 мг декс-кетопрофену кожні 8 год. Стабілізація гемодинаміки здійснювалася внутрішньовенним застосуванням розчину адреналіну гідротартрату (0,09–0,27 мг/год
або 0,019–0,057 мкг/кг/хв) [11].
У післяопераційному періоді інтратекально вводили по 0,06 мг бупренорфіну кожні 24 год протягом двох діб і вилучали спінальний катетер. Вираженість больового синдрому оцінювали за числовою рейтинговою шкалою болю (ЧРШБ) від 0 до 10 балів через 3, 10, 24 і 48 год після операції [12], а також через 30 хв після інтратекального введення бупренорфіну. Матеріали оброблено програмою статистичного аналізу BioStat.
Результати та обговорення
Після премедикації мелатоніном і нефопамом хворі перебували у відносно спокійному психоемоційному статусі. Троє (20,0 %) пацієнтів повідомили про інсомнію напередодні операції. В усіх хворих у періопераційному періоді не спостерігалося м’язового тремтіння. Адекватність знеболювання визначалася самими пацієнтами, які характеризували свій стан як комфортний, з повною відсутністю болю.
Початкова доза бупівакаїну для СБ становила 20 мг (0,25 мг/кг). Температурна чутливість знижувалася через 3–4 хв, аналгезія розвинулася через 7–8 хв, якісний моторний блок — через 10 хв. Аналгезія поширювалася на зону іннервації Тh2–3–S5. Тривалість анестезії після стартової дози бупівакаїну дорівнювала 124 ± 8 хв, потім вводили 50 % первісної дози препарату. У чотирьох випадках через 140 ± 25 хв виникла потреба у третій порції (50 % первісної дози) бупівакаїну. Максимальна доза цього анестетика при тривалій операції сягала 40 мг. Необхідно відзначити, що об’єм заповнення катетера та бактеріального фільтра становив 0,4 мл (катетер — 0,03 мл, фільтр — 0,37 мл). Це значить, що при першому введені 2 мг бупівакаїну не потрапляло до спинномозкового каналу.
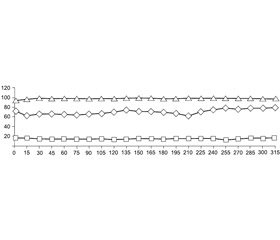
Під час оперативного втручання спостерігалась якісна міорелаксація. Систолічний артеріальний тиск (АТс) знижувався на 20–26 % (p < 0,05), діастолічний артеріальний тиск (АТд) — на 18–29 % (p < 0,05), відповідно середній артеріальний тиск (САТ) — на 25–29 % (p < 0,05) порівняно з вихідним фоном. Графічну динаміку показників артеріального тиску наведено на рис. 1.
Корекцію гіпотензії та брадикардії, що прогнозовано виникали внаслідок високої СБ, ефективно забезпечували інфузією малих доз адреналіну гідротартрату. Введення препарату починали відразу після виконання СБ. Залежно від рівня АТ і частоти серцевих скорочень (ЧСС) змінювали швидкість введення адреналіну гідротартрату в діапазоні 0,09–0,27 мг/год або 0,019–0,057 мкг/кг/хв. Оптимізація АТ і ЧСС внаслідок інфузії розчину адреналіну гідротартрату в основному відбувалася реципрокно. В 1 (6,7 %) випадку ефективна корекція АТ не супроводжувалася настільки ж якісною ліквідацією брадикардії, тому для оптимізації ЧСС титровано внутрішньовенно вводили розчин атропіну.
Частота дихання (ЧД) хворих була в межах 12–16 вдихів/хв. Насичення артеріальної крові киснем за даними пульсоксиметрії (SpO2) зберігалося на рівні 96–99 % при спонтанному диханні повітрям, що збагачене потоком кисню — 4 л/хв. Будь-яких скарг на проблеми з диханням у пацієнтів не виникало.
Альтернатива СБ — тотальна анестезія, в тому числі й глибока седація, — вимагає агресивного підходу до забезпечення газообміну у хворого під час абдомінальної операції. Анестетики знижують функціональну залишкову ємність легенів і викликають обструктивні процеси в дихальних шляхах. Загальне знеболювання характеризується небезпечним поєднанням дисфункції інспіраторних та експіраторних м’язів, а також погіршенням механічних властивостей легенів. Наркоз не тільки ушкоджує окремі компоненти вентиляції, а й порушує систему взаємної компенсації цих складових. Навіть індукція анестезії супроводжується легеневим дисбалансом через зміни механіки грудної клітки та дисфункції діафрагми, викликаючи ателектази, порушення газообміну й співвідношення вентиляція/перфузія. Застосування тиску вище від атмосферного при штучній вентиляції легенів призводить до їх ушкодження, ступінь якого залежить від дихального об’єму, пікового тиску та позитивного тиску наприкінці видиху. Протезування функції зовнішнього дихання в умовах тотальної анестезії на 40 % знижує серцевий індекс, на 50 % підвищує загальний периферичний судинний опір і в три рази збільшує внутрішньолегеневий шунт. Ключове значення в розвитку різного ступеня післяопераційної дихальної дисфункції має якість постнаркозного відновлення, а кращою профілактикою післяопераційної пневмонії є можлива заміна наркозу регіонарною анестезією.
Графічну динаміку показників ЧСС, ЧД та SpO2 наведено на рис. 2.
Після операції пацієнтів відразу переводили до профільних хірургічних відділень. Під час транс-портування та подальшого лікування хворі були притомні, гемодинамічні параметри, а також дихальна функція залишалися стабільними, зберігався частковий моторний блок, швидкість регресії якого залежала від інтратекальної дози бупівакаїну.
Спінальний катетер із субарахноїдального простору вилучали через дві доби після операції. В жодному випадку не відмічали постпункційного головного болю. У першу післяопераційну добу вислуховувалась активна перистальтика та відходили гази. Термін першого самостійного підйому з ліжка визначався тривалістю моторного блоку. В середньому хворі починали активно рухатися через 2–
3 год після переводу з операційної. Через добу пацієнти починали легкі прогулянки. З першої доби після операції призначали раннє ентеральне харчування.
Післяопераційне знеболювання здійснювали протягом двох-трьох діб: перорально/внутрішньовенно — по 1 г парацетамолу кожні 8 год, внутрішньовенно — по 50 мг декскетопрофену кожні 8 год, інтратекально вводили по 0,06 мг бупренорфіну кожні 24 год протягом двох діб. Вираженість больового синдрому оцінювали за ЧРШБ від 0 до 10 балів через 3, 10, 24 та 48 год після операції, а також через 30 хв після інтратекального введення бупренорфіну. Динаміку ступеня післяопераційного болю відображено в табл. 1.
Динаміка ступеня післяопераційного болю за ЧРШБ через 3 год була 0 балів; через 10 год — 1,60 ± 0,02 бала (р = 0,0001); через 24 год — 1,20 ± ± 0,02 бала (р = 0,0001); через 48 год — 1,06 ± 0,01 бала (р = 0,0001). Через 30 хв після інтратекального введення бупренорфіну вираженість післяопераційного болю за ЧРШБ дорівнювала нулю.
Отже, аналіз результатів дослідження показав, що фармакологічний вплив на процеси больової імпульсації, модуляції ноцицепції за допомогою специфічних агентів дозволяв значно зменшити рівень больового потоку на всьому шляху його слідування — від периферичних ноцицепторів до центральних структур мозку, що забезпечувало ефективне періопераційне знеболювання, а також створювало якісні умови для виконання оперативного втручання.
Катетерна СБ має низку переваг перед значно поширеною епідуральною анестезією з огляду на такі обставини:
— застосування наборів для СБ Spinocath (B. Braun, ФРН) робить методику пролонгованої СБ атравматичною та безпечною в аспекті розвитку неврологічних і інфекційних ускладнень;
— значно менші дози препаратів, відповідно низька токсичність та кошторис;
— адекватність аналгезії та міорелаксації;
— не зустрічається нерівномірність анестезії.
Висновки
1. Застосування технології катетеризації суб-арахноїдального простору дозволяло проводити спінальну анестезію при абдомінальних операціях будь-якої тривалості й травматичності.
2. Катетерна субарахноїдальна блокада бупівакаїном та бупренорфіном поєднано з нефопамом, декскетопрофеном і парацетамолом була ефективним методом контролю больового синдрому у післяопераційному періоді.
3. Покращення якості аналгезії дозволяло проводити ранні активізацію та харчування пацієнтів і, відповідно, скорочувало період реабілітації.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Юдин С.С. Спинномозговая анестезия: история, основания, техника и клиническая оценка метода и его применения. — Серпухов, 1925. — 348 с.
2. Dean H.P. The importance of anaesthesia by lumbar injection in operations for acute abdominal diseases // Br. Med. J. — 1906. — Vol. 1. — P. 1086-1090.
3. Krämer S. Continuous spinal anesthesia versus continuous femoral nerve block for elective total knee replacement / S. Krämer, M. Wenk, G. Fischer, M. Möllmann, D.M. Pöpping // Minerva Aneshesiol. — 2011. — Vol. 77. — P. 394-400.
4. Palmer C.M. Continuous spinal anesthesia and analgesia in obstetrics // Anesth. Analg. — 2010. — Vol. 111. — P. 1476-1479.
5. Imbelloni L.E. Continuous spinal anesthesia with high dose of local aneshetics / L.E. Imbelloni, S.G. Neto, E.M. Ganem // Rev. Bras. Anesthesiol. — 2010. — Vol. 60. — P. 537-543.
6. Осипова Н.А. Системная и регионарная антиноцицептивная защита пациента в хирургии: проблема выбора / Н.А. Осипова, В.В. Петрова, С.В. Митрофанов, В.А. Берсенев, Ю.С. Донскова, В.И. Бирюков, В.М. Крайник // Анестезиология и реаниматология. — 2006. — № 4. — С. 12-16.
7. Шифман Е.М. Эпидуральная блокада в анестезиологическом обеспечении лапароскопических операций в гинекологии / Е.М. Шифман, А.В. Бутров, И.В. Федулова // Анестезиология и реаниматология. — 2007. — № 2. — С. 65-68.
8. Mauermann W.J. A comparison of neuraxial block versus general anesthesia for elective total hip replacement: meta-analysis / W.J. Mauermann, A.M. Shilling, Z. Zuo // Anesth. Analg. — 2006. — Vol. 103(4). — P. 1018-1025.
9. Wada H. Combined spinal and general anesthesia attenuates liver metastasis by preserving Th1/Th2 cytokine balance / H. Wada, S. Seki, T. Takahashi, N. Kawarabayashi, H. Higuchi, Y. Habu, S. Sugahara, T. Kazama // Anesthesiology. — 2007 — Vol. 106(3). — P. 499-506.
10. Rashiq S. The effect of spinal anesthesia on blood transfusion rate in total joint arthroplasty / S. Rashiq, B.A. Finegan // Can. J. Surg. — 2006. — Vol. 49(6). — P. 391-396.
11. Бышовец С.Н. Коррекция гемодинамики инфузией малых доз адреналина при высокой спинальной анестезии в абдоминальной хирургии / С.Н. Бышовец // Экстренная медицина. — 2014. — № 2(10). — С. 47-54.
12. Kainzwaldner V. Quality of postoperative pain therapy: evaluation of an established anesthesiology acute pain service / V. Kainzwaldner, B. Rachinger-Adam, T. Mioc-Curic, T. Wöhrie, L.C. Hinske, B. Luchting, T. Ewert, S.C. Azad // Anaesthesist. — 2013. — Vol. 62(6). — P. 453-459.

/126-1.jpg)
/127-1.jpg)